血清Nogo-A、Adropin蛋白水平与2型糖尿病合并大血管病变的相关性
2020-06-28王维李丽疆崔阳
王维 李丽疆 崔阳
(佳木斯大学附属第一医院内分泌科,黑龙江 佳木斯 154002)
糖尿病性大血管病变(MVC)是糖尿病中最常见并发症之一。其病理生理基础是动脉粥样硬化性血管,动脉粥样硬化的发生发展包括脂质浸润、炎性反应、血管平滑肌细胞(VSMC)激活等〔1~6〕。研究指出,Nogo-A蛋白、Adropin蛋白与氧化应激、炎性反应、脂质代谢等MVC发生发展因素有联系〔7~11〕。本文测定这两种蛋白在2型糖尿病(T2DM)MVC患者中的表达,分析其相关性,以期对疾病的诊断与治疗提供新的思路与途径。
1 资料与方法
1.1一般资料 随机选取2018年12月至2019年3月于佳木斯大学附属第一医院内分泌科的T2DM患者(均符合1999 年 WHO 糖尿病诊断标准)。其中,选取符合心脑血管疾病发生史、临床CT、磁共振成像(MRI)、动脉造影等检查确诊大血管疾病史等MVC诊断标准患者40例为MVC组,无任何并发症患者40例为T2DM组。同期健康体检者40名为对照组。MVC组男17例、女23例,年龄(57.05±5.277)岁;T2DM组男19例、女21例,年龄(55.73±4.552)岁;对照组男22例、女18例,年龄(55.65±3.570)岁。3组性别构成及年龄无显著差异(P>0.05)。选择对象应排除传染病患者、严重肝病、肾病、具有长期药物应用史、外伤、感染或处于围术期、微血管疾病、除糖尿病外其他内分泌代谢性疾病患者、患糖尿病前合并大血管疾病患者等。
1.2研究方法 收集患者病程等数据,测量身高、体重,计算体重指数(BMI)。采集空腹静脉血,离心取血清,检测空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)(拜耳全自动生化分析仪)、C反应蛋白(CRP)、糖化血红蛋白(HbA1c)(免疫比浊法,德国拜耳 DCA2000+仪)等,Nogo-A、Adropin(ELISA,芬兰Labsystems Multiskan MS公司酶标仪),试剂盒采购于上海信帆生物,严格按照说明书操作。
1.3统计学处理 应用SPSS21.0统计软件进行单因素方差分析及Pearson相关分析、多因素逐步回归分析。
2 结 果
2.1各组生化指标比较 MVC组、T2DM组与对照组FPG、HbA1c、CRP、TG、TC、HDL-C、Adropin、Nogo-A差异具有统计学意义(P<0.05);MVC组BMI明显高于对照组和T2DM组;MVC组、HbA1c、CRP、Nogo-A显著高于T2DM组,而Adropin显著低于T2DM组(均P<0.05)。见表1。
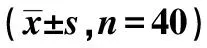
表1 各组一般资料及生化指标比较
与对照组比较:1)P<0.05;与T2DM组比较:2)P<0.05
2.2T2DM患者血清Nogo-A、Adropin与其他变量的相关性 血清Nogo-A与FPG、HbA1c、CRP、病程呈正相关(r>0,P<0.05),与Adropin、HDL-C呈负相关(r<0,P<0.05);Adropin与HDL-C呈正相关(r>0,P<0.05),与FPG、HbA1c、CRP、Nogo-A、病程、TG、TC呈负相关(r<0,P<0.05)。见表2。
2.3多元线性逐步回归分析 以CRP为因变量,Nogo-A、Adropin、FPG、HbA1c、TG、TC、HDL-C、LDL-C为自变量进行多元线性逐步回归分析,进入方程的自变量有Nogo-A、Adropin、HbA1c(P<0.05),即CRP的独立相关因素。以Nogo-A为因变量,Adropin、CRP、FPG、HbA1c、TG、TC、HDL-C、LDL-C为自变量进行多元线性逐步回归分析,进入方程的自变量有CRP、TG(P<0.05),即Nogo-A的独立相关因素。以Adropin为因变量,Nogo-A、CRP、FPG、HbA1c、TG、TC、HDL-C、LDL-C为自变量进行多元线性逐步回归分析,进入方程的自变量有CRP、FPG、HbA1c(P<0.05),即Adropin的独立相关因素。见表3。
表2 血清Nogo-A、Adropin影响因素的相关性

表3 多元线性逐步回归分析CRP、Nogo-A、Adropin的影响因素
3 讨 论
糖尿病中致死、致残率最高的并发症就是MVC〔6〕,其主要原因就是动脉粥样硬化。研究表明,高血糖、高脂血症、肥胖等都是MVC发生与发展的危险因素〔1〕,与本实验研究结果一致。研究表明,在除外其他炎症反应疾病导致CRP升高的情况下,CRP或可作为反映机体动脉粥样硬化程度的因子之一〔12〕。因此,CRP水平是预判患者MVC发生的重要因子。
研究发现,Nogo-A通常被认为是神经系统中轴突最重要的抑制剂,但除了在中枢神经系统神经元再生中的重要作用外,Nogo-A具有调节葡萄糖稳态、致使细胞凋亡和影响氧化应激等作用〔13〕。研究表明,冠心病患者体内Nogo-A和炎性因子水平升高〔14〕。研究表明,Nogo-A的表达水平在缺血性脑卒中患者体内也会上升〔15〕。Nogo-A蛋白水平升高可以导致机体血糖和炎性因子水平上升等。而血糖水平升高、脂质代谢异常和炎性介质水平升高均会致使动脉粥样硬化的发生发展〔16〕。由此可推,Nogo-A蛋白水平升高会促使MVC发生与发展。
Adropin由Enho基因编码,可以调节能量代谢的平衡〔17〕。升高Adropin的浓度可以促进脂肪代谢,减轻肥胖程度,抑制胰岛素抵抗,降低T2DM的发生率。低水平的Adropin与内皮损伤有关。高浓度的Adropin可以激活内皮型一氧化氮合酶(eNOS),促进一氧化氮(NO)生成,保护内皮细胞;高浓度的Adropin还可以抑制炎性介质的产生。当Adropin缺乏时,血管内皮生成因子的表达会增强,促使内皮细胞生成分泌白细胞介素-1和肿瘤坏死因子-α,导致炎症反应发生〔18〕。动脉粥样硬化的形成离不开血管内皮细胞的损伤与炎性介质生成的增加。因此,Adropin水平的下降可以引起动脉粥样硬化。血清 Adropin 水平降低会引起炎性因子和血糖水平升高等反应,最终导致动脉粥样硬化发生发展。因此可以推测,Adropin水平降低也是引起MVC的重要因素。
本研究结果显示,Nogo-A与Adropin呈负相关。也就是说,在多种因素影响下,Nogo-A与Adropin可能互相拮抗。CRP作为炎性因子的一种,在其表达水平升高时,可以破坏血管内皮,促使动脉粥样硬化的发生与发展。这说明,Nogo-A和Adropin的水平都可以影响CRP的表达,从而影响T2DM MVC发生发展的过程。但目前,关于Nogo-A引起炎性反应机制的还不明确,相关研究较少,且本实验的样本量有所不足,仍需要进一步研究。
综上,血清 Adropin水平明显降低与Nogo-A水平明显升高可以引起机体炎性因子水平升高等反应,最终导致MVC发生与发展。因此,Adropin和Nogo-A水平的变化有望成为新的早期预测T2DM MVC的依据,并为其治疗提供新的靶点。
