淀粉质原料发酵生产L-乳酸过程中的残糖控制
2020-06-28顾永华姜建友唐晓玲
顾永华,崔 洋,姜建友,唐晓玲
(1.河南金丹乳酸科技股份有限公司,河南 郸城 477150 ; 2.天津大学,天津 300072)
乳酸(lactic acid)又名2-羟基丙酸(α-羟基丙酸,丙醇酸)。其分子结构中含有一个不对称碳原子,因此具有光学异构现象,具有L-型和D-乳酸两种[1]。L-乳酸生产主要是以淀粉质为原料经微生物发酵精制而成,广泛应用于食品、医药、化工、新材料、饲料等领域。以乳酸为单体合成的聚乳酸(PLA)可替代石油原料制成的塑料制品,被认为是当前最有前途的生物可降解高分子材料。
实验室研究中,L-乳酸生产主要采用结晶葡萄糖为原料,发酵结束后的残糖较少。但受生产成本限制,工业化生产中,L-乳酸多以淀粉质为原料,经液化、糖化、发酵进行制备。发酵结束后不可避免地会残留一部分乳酸菌种无法利用的糖类,这部分糖被称为发酵残糖,又叫发酵残总糖,其中的还原性糖类,被称为发酵残还原糖。残糖量是影响L-乳酸经济效益和产品质量的一项重要指标,残糖量高,则发酵产酸相应较低,同时会增加L-乳酸的提取难度,降低L-乳酸提取收率,也影响成品的色度和残糖含量。虽然L-乳酸发酵工艺已经较为成熟,但发酵残糖的控制仍是当前L-乳酸工业生产企业面临的主要难题。本研究通过优化L-乳酸发酵工艺,平稳控制L-乳酸的菌体生长速率及产物合成速率,达到降低发酵残糖的目的,为L-乳酸生产企业提高产品质量和效益提供借鉴。
1 材料和方法
1.1 菌种
凝结芽孢杆菌JD-24625,河南省乳酸工程技术研究中心分离和保藏。
1.2 培养基
种子培养基:乳酸细菌培养基MRS。发酵培养基:玉米淀粉糖水160 g/L,适量营养盐,pH值自然。
1.3 培养方法
种子培养:115 ℃高压灭菌15 min,接入乳酸菌种,温度45 ℃±1 ℃,100 r/min振荡培养12 h。发酵培养:装入发酵罐容积60%的发酵培养基,0.1 MPa蒸汽灭菌30 min。接入适量菌种,温度50 ℃±1 ℃,搅拌转速75 r/min发酵培养。
1.4 分析方法
发酵残总糖和残还原糖,费林试剂热滴定法;发酵液中葡萄糖,生物传感分析仪;光学纯度和发酵液中L-乳酸,高压液相色谱法;OD值(光密度),发酵液分光光度计600 nm波长处的吸光值;pH值,酸度计。
2 结果和讨论
2.1 接种量对L-乳酸光学纯度和发酵残糖的影响
L-乳酸发酵过程中,接种量的大小直接影响发酵料L-乳酸的光学纯度和发酵残糖。较大的接种量可以缩短发酵周期,但会引起菌体初期生长加快,发酵培养基糖分和营养物质消耗速率过快,菌体易进入早衰期,后期发酵耗糖和产酸能力降低[2]。较少的接种量,则会延长发酵周期,易造成发酵不彻底,并且增加发酵培养基染杂菌的几率,从而会降低发酵料L-乳酸纯度。因此,淀粉质原料发酵生产L-乳酸过程中,适宜的接种量对控制发酵残糖和L-乳酸光学纯度十分必要。试验不同接种量对L-乳酸光学纯度和发酵残糖的影响,结果见图1。
由图1可知,当接种量≤10%时,发酵残糖较低且变化不大,为(0.52~0.53)g/(100 mL),但L-乳酸光学纯度降低明显。当接种量≥12%时,L-乳酸光学纯度达到最高,随着接种量增大光学纯度一定程度下降,同时发酵残糖迅速增加。实际生产中,选择L-乳酸光学纯度尽可能大,发酵残糖尽可能低为最佳指标范围。最佳的接种量10%~12%。

图1 接种量对发酵料L-乳酸光学纯度和发酵残糖的影响
2.2 不同中和剂浓度对L-乳酸发酵残糖和发酵周期的影响
目前L-乳酸发酵过程中,pH值调控采用的中和剂被报道较多的氨水和NaOH,但因L-乳酸后提取困难,在现有L-乳酸生产中较少被使用[3]。钙中和剂仍是L-乳酸工业化生产的主流,我们采用Ca(OH)2为中和剂,在5 t容积的发酵罐中,试验不同浓度的中和剂对L-乳酸发酵残糖和发酵周期的影响,结果见图2。

图2 不同中和剂浓度对L-乳酸发酵残糖和发酵周期的影响
由图2可知,中和剂氢氧化钙的浓度对L-乳酸发酵残糖和发酵周期有较大的影响。当中和剂浓度>14%时,发酵周期变化不大,发酵残糖随着浓度增大迅速增加,这是由于过高的中和剂浓度,在流加进发酵培养基过程中,会在发酵罐局部造成碱性过高,从而抑制了菌体的生长和性能。当中和剂浓度<12%时,发酵残糖变化不大,但发酵周期过长,这是由于过低的中和剂浓度,调节发酵培养基pH值速度过慢,并且使培养基体积增加,L-乳酸和菌体浓度被稀释,降低了发酵效率。因此,L-乳酸工业化生产过程中,必须稳控中和剂浓度,以确保发酵调控加碱的稳定性。中和剂浓度在12%~14%时,发酵残糖相对较少,发酵周期短,选择最佳中和剂氢氧化钙的浓度范围为12%~14%。
2.3 pH值分段控制对发酵残糖的影响
L-乳酸发酵过程中,由于菌种生长需要经历迟缓期、对数期、稳定期和衰亡期,只有控制条件使菌体在各生长阶段处于较佳的环境中,才能最大限度地合成产物,但单一因素满足菌种生长各阶段的最佳值是不一样的,这就必须对发酵过程进行分阶段控制[3-5]。pH值对于处于生长期的兼性厌氧菌来说是必须的,若在菌体生长期通过控制pH值进行控制菌体生长快慢,从而为菌体生长与代谢提供适当的微环境,控制菌体生长快慢的同时,进而可控制平稳的降糖速率。L-乳酸发酵前期,菌种增长较快,通过一定程度降低发酵pH值,可以降低菌种增速,避免菌种进入早衰期。发酵pH值在稳定期维持一段时间之后回升,可保持菌种活性,增加产酸。L-乳酸菌种进入衰亡期,适当降低pH值,有利于L-乳酸光学纯度的提升和降低残糖。试验L-乳酸发酵过程中pH值分段控制对菌体生长的影响,见图3,pH值一直维持6.0发酵对菌体生长的影响见图4,pH值分段控制与单一pH值发酵结果对比见表1。

图3 发酵过程中pH值分段调控对菌体平稳生长的影响

图4 pH值6.0发酵菌体生长情况
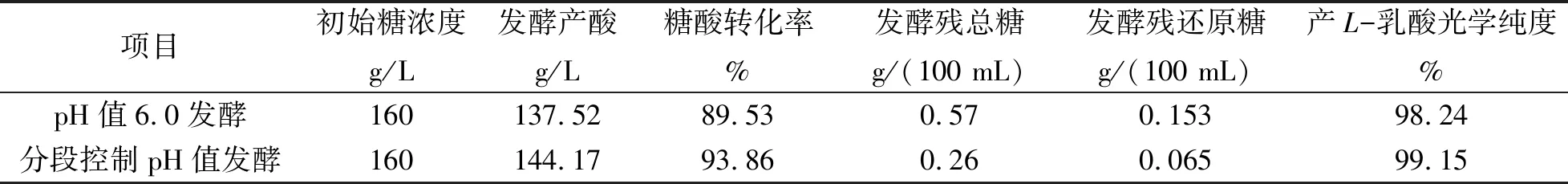
表1 分段控制pH值与单一pH值发酵结果对比
由图3、图4和表1可知,L-乳酸发酵过程pH值分段控制,较单一pH值发酵,发酵产酸、糖酸转化率和L-乳酸光学纯度均提高明显,发酵残糖降低效果显著。这是由于单一pH值发酵,菌种对数期生长较快,营养物质过快地被消耗,后期菌种易进入早衰,产酸、耗糖等能力下降。同时说明通过pH值分段控制,稳控菌体生长速率及产酸合成速率,是影响L-乳酸发酵残糖的主要因素。因此,发酵过程中实施pH值分段控制,能对L-乳酸发酵生产较好地进行稳控。
3 结论
在L-乳酸发酵过程中,发酵残糖是发酵质量的一项重要指标,平稳控制乳酸的菌体生长速率及乳酸合成速率,是控制发酵残糖的主要因素。本试验研究了接种量、中和剂浓度和pH值对L-乳酸发酵残糖的影响,得出接种量范围10%~12%,中和剂氢氧化钙的浓度范围12%~14%,发酵过程采用pH值分段控制的方式,发酵残糖较低,可为进一步工业化生产中稳控发酵残糖提供相关参考。
