银杏叶注射液对丙泊酚麻醉引起的大鼠认知功能障碍的影响
2020-06-24胡雅娟胡格吉胡石海霞贺娜杜雪江王利
胡雅娟 胡格吉胡 石海霞 贺娜 杜雪江 王利

摘要 目的:觀察银杏叶注射液对麻醉引起的认知功能障碍的影响。方法:将75只大鼠随机分为正常对照组、模型组、银杏叶组、抑制剂组、激动剂组,每组15只。银杏叶组、抑制剂组、激动剂组从麻醉前3 d腹腔注射银杏叶注射液(2 mL/kg),1次/d,连续给药3 d;抑制剂组在麻醉前腹腔注射EX527(5 mg/kg);激动剂组在麻醉前腹腔注射SRT1720(200 mg/kg)。水迷宫观察认知功能程度,观察大鼠脑组织神经元形态学变化,透射电镜观察脑组织组织超微结构,检测Iba-1、IL-6、IL-8、TNF-α、SOD、MDA、SIRT1、NF-κB、IκB-α、Bcl-2、Bax、Caspase-3指标变化。结果:与模型组、抑制剂组比较,银杏叶组和激动剂组大鼠逃避潜伏期缩短、穿越平台次数增多、脑组织神经细胞形态改善,突触数量增多,SIRT1、IκB-α、Bcl-2、SOD表达升高,IκB-α、Bax、Caspase-3、IL-6、IL-8、TNF-α、MDA表达降低(P<0.05);与银杏叶组比较,激动剂组的上述情况均较优(P<0.05);与模型组比较,抑制剂组的上述情况均较优(P<0.05)。结论:银杏叶注射液改善麻醉引起的认知障碍,其机制之一可能通过SIRT1/NF-κB通路介导。
关键词 银杏叶注射液;丙泊酚麻醉;认知功能障碍;SIRT1/NF-κB通路
Effects of Ginkgo Biloba Injection on Cognitive Impairment Induced by Propofol Anesthesia in Rats and Its Mechanism
HU Yajuan1,HU Gejihu1,SHI Haixia1,HE Na1,DU Xuejiang1,WANG Li2
(1 Affiliated Hospital of Inner Mongolia Medical University,Hohhot 010050,China; 2 Inner Mongolia Medical University,Hohhot 010050,China)
Abstract Objective:To observe the effects of ginkgo biloba injection on cognitive dysfunction induced by anesthesia.Methods:A total of 75 rats were randomly divided into a normal control group(n=15),model group(n=15),a ginkgo biloba group(n=15),an inhibitor group(n=15)and an agonist group(n=15).Ginkgo biloba group,inhibitor group and agonist group were injected intraperitoneally with ginkgo biloba injection(2 mL/kg)once a day for 3 days before anesthesia,EX527(5 mg/kg)was injected intraperitoneally before anesthesia in inhibitor group,and SRT1720(200 mg/kg)was injected intraperitoneally before anesthesia in agonist group.The degree of cognitive function and the morphological changes of hippocampal neurons were observed by water maze,the ultrastructure of hippocampus was observed by transmission electron microscope,and the changes of Iba-1,IL-6,IL-8,TNF-α,SOD,MDA,SIRT1,NF-κ B,I κ B-α,Bcl-2,Bax and Caspase-3 were detected.Results:Compared with the model group and inhibitor group,the escape latency in ginkgo biloba group and agonist group was shorter,the number of crossing platform was higher,the morphology of hippocampal nerve cells improved,the number of synapses and the expression of SIRT1,I κ B-α,Bcl-2,SOD increased,and the expression of I κ B-α,Bax,Caspase-3,IL-6,IL-8,TNF-α and MDA decreased in ginkgo biloba group and agonist group(P<0.05).Compared with the ginkgo biloba group,the above conditions in the agonist group were better than those in the model group(P<0.05),and those in the inhibitor group were better than those in the model group(P<0.05).Conclusion:Ginkgo biloba injection can improve the cognitive impairment induced by anesthesia,and one of its mechanisms may be mediated by SIRT1/NF-κ B pathway.
Keywords Ginkgo biloba injection; Propofol anesthesia; Cognitive impairment; SIRT1/NF-kappa B pathway
中圖分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.23.017
50年年代始,术后认知功能障碍(Postoperative Congnitive Dysfunction,POCD)逐渐引起研究人员的重视[1]。一项大型流性病学调查研究显示约25.8%的手术患者在术后1周均发生了POCD,直至术后3个月仍有近10%的患者存在POCD[2],虽然部分学者认为POCD具有自限性,但仍有大量学者证实POCD的存在增加了术后第一年内死亡的风险,且导致患者过早丧失劳动力和社会独立能力[3-4]。丙泊酚是目前临床最常用的麻醉药物,其以起效快、作用时间段、清除迅速等特点被广泛应用于各科手术中,但其导致的POCD临床时有报道。
POCD属于中医“呆病”“善忘”“健忘”等范畴,脑髓空虚、神机失用是该病的主要病机,张景岳在注释《素问·刺禁论》中“刺头,中脑户,立死”解释到“脑为髓海,乃元阳精气之所聚”,可见脑髓为主宰神志之根本。多数POCD为老年患者,多有髓海不足,脑髓不充,势必影响脑主神志之功,从而导致POCD的发生发展。银杏叶是重要的中药药材,有活血化瘀通络,化浊降脂之功。现代药理研究及临床文献[5-7]均证实银杏叶注射液可有效改善认知功能减退性疾病,但其作用机制目前尚无统一定论。为了进一步明确银杏叶注射液改善POCD的作用机制,本研究以吸入丙泊酚来诱导高龄大鼠发生POCD,以其为媒介探讨银杏叶注射液丙泊酚所致POCD的疗效及可能机制,具体报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级健康雄性SD大鼠,体质量(230±20)g,由中国中医科学院中药研究所提供[合格证号:SYXK(京)2017-0003]。所有大鼠均在内蒙古医科大学实验动物中心适应性喂养5 d后进行模型制备。饲养环境:温度(23±3)℃,湿度(50±1)%。食物和水在整个实验过程中均由实验动物自由索取。实验经内蒙古医科大学动物管理制度和使用委员会批准而进行,实验过程中动物的处理均严格按照国际道德准则和国家健康指南关于维护和使用实验动物先关条例进行(伦理审批号:28392-01)。
1.1.2 药物 银杏叶注射液(悦康药业集团有限公司,国药准字H20070226)
1.1.3 试剂及仪器 主要试剂:PMSF(货号:283922)、SDS-PAGE电泳胶(货号:22934)、BCA工作液(货号:22228)、聚丙烯酰胺凝胶(货号:39123),以上试剂购于碧云天公司;DAPI染色液(货号:K9787)、SIRT1(货号:8469s)、NF-κB(货号:8242s)、IκB-α(货号:4814s)、Bcl-2(货号:15071s)、Bax(货号:89477s)、Caspase-3(货号:9662s)、Iba1(货号:17198s)、β-actin(货号:3700s),以上购于美国CST公司。IL-6(货号:83932)、IL-8(货号:37483)、TNF-α(货号:18293)、SOD(货号:28322)、MDA ELISA试剂盒(货号:83724),以上购于艾美捷科技有限公司。主要仪器:水迷宫分析系统(诺达思,型号:RT1908B),激光共聚焦荧光显微镜(Bio-rad,美国,型号:TE300),酶标仪(Leica,德国,型号:200 PRO),凝胶成像系统(Bio-rad,美国,型号:ChemiDoc XRS+)等。
1.2 方法
1.2.1 分组与模型制备 将75只大鼠随机分为正常对照组、模型组、造模+银杏提取物(银杏叶)组、造模+银杏提取物+抑制剂(抑制剂)组、造模+银杏提取物+激动剂(激动剂)组,每组15只。模型组、银杏叶组、抑制剂组、激动剂组大鼠均经腹腔注射丙泊酚(100 mg/kg)进行麻醉。
1.2.2 干预方法 银杏叶组、抑制剂组、激动剂组从麻醉前3 d腹腔注射银杏叶注射液(2 mL/kg),1次/d,连续给药3 d;抑制剂组大鼠在丙泊酚麻醉前腹腔注射EX527(5 mg/kg,EX527用DMSO溶解,生理盐水稀释);激动剂组大鼠在丙泊酚麻醉前腹腔注射SRT1720(200 mg/kg,SRT1720用DMSO溶解,生理盐水稀释)。
1.2.3 检测指标与方法
1.2.3.1 认知行为学检测 麻醉后第2天行水迷宫试验:1)定位航行测试:大鼠面向池壁4象限入水点入水,记录大鼠2 min寻找平台时间(逃避潜伏期),每天上午、下午各检测1次,持续3 d;2)空间探索测试:麻醉后第4天,随机选取入水点,记录2 min内穿越原平台次数。
1.2.3.2 苏木素-伊红染色(HE染色)观察大鼠脑组织神经元形态学变化 每组取4只大鼠麻醉后经4%多聚甲醛溶液灌注固定后取脑。常规脱水、包埋、切片(厚5 μm)、烘片、脱蜡。将切片放入苏木素溶液中染色3 min后,酸水及氨水中,各10~20 s用以分色;最后放入乙醇伊红溶液染色3 min;水洗后,置于梯度乙醇溶液中分别脱水5 min,透明、分片。采用光学显微镜(×400)观察海马组织的形态学特征。
1.2.3.3 透射电镜观察脑组织超微结构 每组大鼠随机选取6只大鼠,大鼠用10%水合氯醛腹腔注射麻醉后处死,用锋利手术刀于冰山快速取下脑组织,将样本置于3%戊二醛→1.5%多聚甲醛→0.1 mol/L PBS进行前固定,随后再用0.1 mol/L PBS漂洗3次,15 s/次,再将样本置于1%锇酸-1.5亚铁氰化溶液中4 ℃环境下固定2 h,再用0.1 mol/L PBS漂洗3次,15 s/次,70%乙醇(10 min)→80%乙醇(10 min)→90%乙醇(10 min)→95%乙醇(10 min)→无水乙醇(10 min)脱水后将样本置于包埋剂中35 ℃(12 h)→35 ℃(24 h)→45 ℃(12 h)→60 ℃(60 h)进行包埋聚合,超薄切片后用醋酸铀染色30 min,蒸馏水漂洗3次,20 s/次,再用柠檬酸铅染色5 min后再用蒸馏水漂洗3次,20 s/次,置于透射电镜下观察拍照。
1.2.3.4 免疫荧光染色法检测脑组织小胶质细胞标志物Iba-1表达 常规石蜡包埋、切片、脱蜡、抗原修复(100 μL/样本);内源性过氧化物酶阻断剂消除过氧化物酶的活性(100 μL/樣本),室温孵育10 min;加入非特异染色阻断剂(100 μL/样本),室温孵育10 min;除去非特异染色阻断剂,加入Iba1一抗工作液(100 μL/样本),37 ℃孵育1~2 h或4 ℃过夜;PBS漂洗后加入相应的荧光二抗37 ℃反应1 h;PBS漂洗后甘油封片,荧光及激光共聚焦显微镜下观察。结果以Iba1阳性细胞率表示:Iba1阳性细胞数/总的细胞数×100%。
1.2.3.5 采用双抗体/夹心酶联免疫吸附测定(ELISA)测定IL-6、IL-8、TNF-α、SOD、MDA水平 采用双抗体/夹心酶联免疫吸附测定(ELISA)方法检测脑组织匀浆IL-6、IL-8、TNF-α、SOD、MDA的含量,严各指标格按照ELISA试剂盒说明书操作,酶标仪读取结果并统计分析。
1.2.3.6 Western blot检测脑组织SIRT1、NF-κB、IκB-α、Bcl-2、Bax蛋白表达量 干预后每组随机取5只大鼠,用水合氯醛以3 mL/kg的比例进行麻醉,冰上迅速于冰山快速取下脑组织,将样本置于含1%PMSF的蛋白裂解液中充分裂解,裂解后置于离心机中分离上清与沉淀,提取上清,用BCA法进行蛋白测定并计算上样量,随后进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,再将凝胶上的蛋白转至聚偏氟乙烯(PVDF)膜上,随后在室温条件下的封闭液中振摇1.5 h进行封闭。将SIRT1、NF-κB、IκBα、Bcl-2、Bax以及β-actin一抗按比例稀释后,将膜放置于4 ℃孵育过夜,次日用TBST液漂洗,每次摇床漂洗10 min,3次后相应加入按比例稀释好的二抗中,室温孵育2 h,再次用TBST漂洗3次,随后用显影液进行发光显色,并用Image(BIO-RAD公司)的图像处理软件进行灰度分析,测定条带吸光度,将目的条带与内参条带的灰度值进行比较,二者比值表示目的蛋白的表达水平。
1.2.3.7 免疫荧光染色法检测脑组织Caspase-3水平变化 常规石蜡包埋、切片、脱蜡、抗原修复(100 μL样本);内源性过氧化物酶阻断剂消除过氧化物酶的活性(100 μL/样本),室温孵育10 min;加入非特异染色阻断剂(100 μL/样本),室温孵育10 min;除去非特异染色阻断剂,加入Caspase-3一抗工作液(100 μL/样本),37 ℃孵育1~2 h或4 ℃过夜;PBS漂洗后加入相应的荧光二抗37 ℃反应1 h;PBS漂洗后甘油封片,荧光及激光共聚焦显微镜下观察。结果以Iba1阳性细胞率表示:Iba1阳性细胞数/总的细胞数×100%。
1.3 统计学方法 采用SPSS 22.0统计软件进行统计分析,数据以均值±标准差(±s)表示。数据符合正态分布,采用单因素方差分析;数据不符合正态分布,采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经行为学评分的比较 术后第2天,与对照组比较,其余4组大鼠逃避潜伏期均升高(P<0.05),且4组间差异无统计意义(P>0.05);术后第3天及第4天,各组逃避潜伏期的时间均较前有所下降,但银杏叶组和激动剂组的逃避潜伏期的时间较模型组和抑制剂组短(P<0.05),且银杏叶组和激动剂组穿越平台次数亦较模型组和抑制剂组多(P<0.05);与银杏叶组比较,激动剂组逃避潜伏期的时间较短,穿越平台次数较多(P<0.05);与抑制剂组比较,模型组潜伏期的时间较长,穿越平台次数较少(P<0.05)。见表1、表2。
2.2 各组大鼠脑组织神经元形态学变化的比较 HE染色观察脑组织神经元形态学变化。结果显示,对照组大鼠脑神经元细胞排列整齐、形态规则,细胞核大小形态正常,细胞质丰富,未见胶质细胞增生;模型组组和抑制剂组可见大量神经元细胞排列疏松,细胞核固缩且形态不规则,细胞质稀少,胞核与胞质界限模糊,见胶质细胞增生增多;银杏叶组和激动剂组见少部分排列紊乱神经元细胞,少量细胞核固缩深染、细胞质减少,胶质细胞增生不多。见图1。
2.3 各组大鼠脑组织超微结构变化的比较 电镜观察银杏叶注射液对大鼠脑组织突触形态的影响,结果显示:与模型组、抑制剂组比较,银杏叶组和激动剂组脑组织突触的结构较完整,数量明显增多(P<0.05);且激动剂组突触数量较银杏叶组多(P<0.05),抑制剂组突触数量较模型组多(P<0.05)。见图2、表3。
2.4 各组大鼠脑组织Iba1表达的比较
免疫荧光观察银杏叶注射液对大鼠脑组织小胶质细胞活化的影响,结果显示:与模型组、抑制剂组比较,银杏叶组和激动剂组脑组织小胶质细胞活化数量较少(P<0.05);且激动剂组小胶质细胞活化数量较银杏叶组少(P<0.05);抑制剂组小胶质细胞活化数量较模型组少(P<0.05)。见图3、表4。
2.5 各组大鼠脑组织IL-6、IL-8、TNF-α、SOD、MDA表达的比较 ELISA检测了脑组织匀浆液IL-6、IL-8及TNF-α水平、SOD活性及MDA水平。如图3结果显示,与模型组、抑制剂组比较,银杏叶组和激动剂组海马区SOD活性升高、MDA活性降低、IL-6、IL-8、TNF-α含量明显降低(P<0.05);与激动剂组比较,银杏叶组SOD活性降低、MDA、IL-6、IL-8及TNF-α含量明显升高(P<0.05);与抑制剂组比较,模型组SOD活性降低、MDA、IL-6、IL-8及TNF-α含量升高(P<0.05)。见表5。
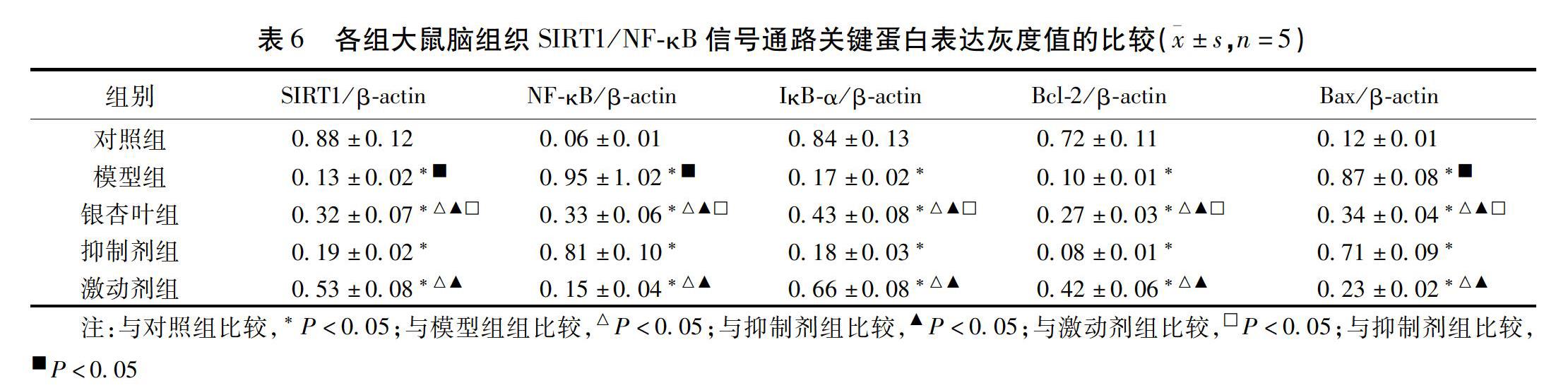
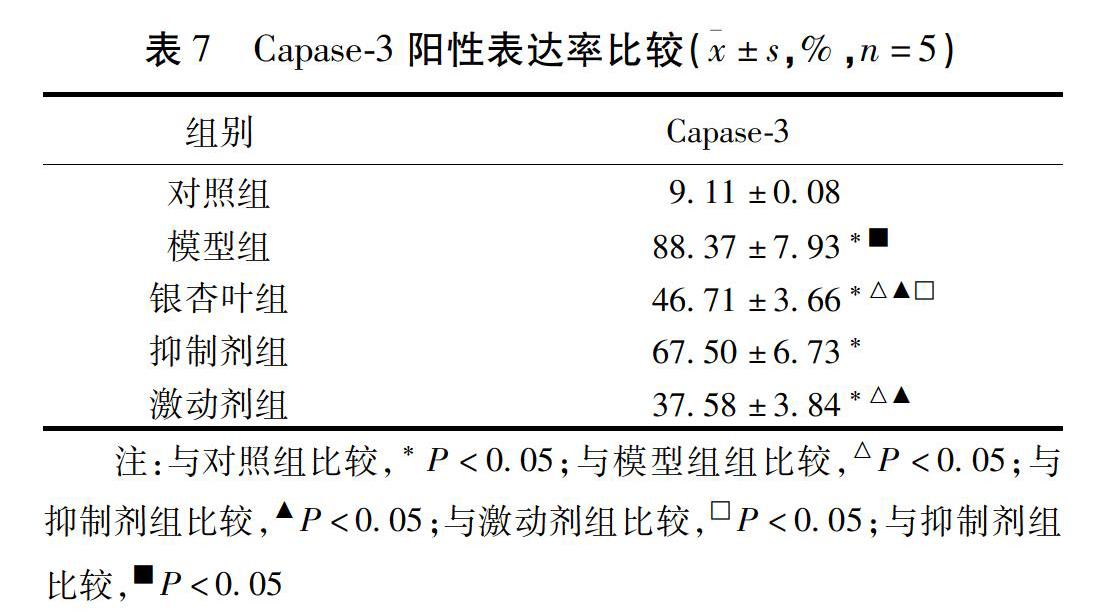
2.6 各组大鼠脑组织中SIRT1/NF-κB信号通路关键蛋白表达的比较 Western blot法检测了脑组织SIRT1、NF-κB、IκB-α、Bcl-2、Bax蛋白水平,免疫组化检测Caspase-3蛋白表达。结果显示,与模型组、抑制剂组比较,银杏叶组和激动剂组海马区SIRT1、IκB-α、Bcl-2蛋白表达升高,IκB-α、Bax、Caspase-3蛋白表达降低(P<0.05);与激动剂组比较,银杏叶组SIRT1、IκB-α、Bcl-2蛋白表达降低、IκB-α、Bax、Caspase-3蛋白表达升高(P<0.05);与抑制剂组比较,模型组SIRT1蛋白表达下降,IκB-α、Bax、Caspase-3蛋白表达升高(P<0.05)。见图4、表6、图5、表7。
3 讨论
有研究显示麻醉药品可导致小胶质细胞的大量活化,从而诱发细胞内Ca2+超载、炎性反应递质释放增多、活化氧(SOD、MDA)活性增加,由此加重炎性反应和氧化应激反应程度[8-9]。此外,随着神经元受损时间的延长,机体瀑布式炎性反应级联反应被激活,进一步导致炎性反应因子(IL-6、IL-8、TNF-α等)、活性氧及各类活性酶的释放,TNF-α是重要的促炎因子,可启动炎性反应细胞因子活性,IL-6广泛参与免疫应答和炎性反应调控,是招募炎性反应细胞、放大炎性反应的重要因子之一。长此以往,脑组织尤其是海马组织的神经元细胞破坏明显,细胞间紧密连接物质大量流失,脑区功能逐渐受损,最终导致认知障碍[10-12]。NF-κB是炎性反应通路中重要的中转转录因子,活性氧浓度的增加可促使IκB发生磷酸化,由此对NF-κB的抑制作用被削弱,随后NF-κB移位至细胞核,激活了其转录过程,促进了其他炎性反应细胞及因子(单核细胞、中性粒细胞、IL-6、TNF-α等)、COX-2、趋化因子及黏附分子等的表达,加剧了炎性反应浸润程度,诱导神经元凋亡[13-14]。据研究可知SIRT1是NF-κB主要调控蛋白,一旦SIRT1被激活,可与p65亚基上Lys310残基产生结合效应,从而促使NF-κB发生去乙酰胆碱化蛋白修饰,导致活性消失,其诱导的炎性反应及氧化应激反应随之减轻。超氧化物歧化酶(SOD)是中枢系统重要的抗氧化酶之一,丙二醛(MDA)是自由基作用于细胞膜磷脂发生过氧化反应的产物,故SOD和MDA联合检测被认为可准确反映脑组织氧化应激状态。本研究我们发现与空白组比较,POCD模型制备的大鼠海马组织的神经元细胞排列紊乱,密度减低,这提示POCD与海马组织的病理变化确实存在密切关系。我们通过TUNNEL检测发现POCD神经元细胞凋亡率明显升高,这揭示POCD发生发展过程中神经元细胞确实发生了过度凋亡,Bcl-2家族在细胞凋亡中占据重要位置,Bcl-2和Bax的表达浓度决定细胞的转归,Bcl-2表达占优势时抑制细胞凋亡,反之,当Bax表达占优势时促进细胞凋亡,在本研究中我们通过ELISA证实POCD模型鼠Bcl-2/Bax比值下调,这说明Bcl-2/Bax均参与调控POCD模型的神经元细胞凋亡过程。于此同时我们还证实POCD模型鼠SIRT1、IκBα表达下降,NF-κB、SOD、MDA表达上调,外周血IL-6、IL-8、TNF-α的浓度增加。上述指标的变化提示丙泊酚诱导麻醉导致POCD可激活NF-κB表达,增强炎性反应,加重神经元损伤,诱导海马神经元细胞凋亡。
早在《本草纲目》时期即已记载银杏叶可防病、治病,但具体资料偏少。直至20世纪60年代,大量研究人员通过临床及药理研究[15-16]证实银杏叶可作为法定药材,其性味甘、苦、涩、平,具有活血化瘀通络,化浊降脂之功。药理研究人员发现银杏叶伴有20余种黄酮类成分,可明显改善机体血液流变学、血脂代谢等,是迄今为止被认为可有效改善认知的中医药材之一[17-18]。本研究利用银杏叶注射液对POCD模型进行干预,结果显示银杏叶注射液确对海马组织有明显保护效应,可修复海马组织的病理改变,改善神经元细胞的形态,同时抑制机体炎性反应及氧化应激反应,与此同时我们发现干预后SIRT1、IκBα、Bcl-2浓度上调,NF-κB、Bax含量减少,神经元细胞凋亡率下降,说明银杏叶注射液有效抑制了模型鼠海马神经元细胞的凋亡,为POCD病情的改善提供了条件。在进一步的机制研究中我们发现侧脑室注射SIRT1/NF-κB通路的抑制剂和激动剂对银杏叶注射液改善模型鼠认知能力亦存在明显的影响,这进一步证实银杏叶注射液有效治疗POCD的作用机制是通过SIRT1/NF-κB信号通路实现的。
参考文献
[1]帅兵,柯毓文,朱彩艳,等.从海马区自噬水平探讨右美托咪定缓解老年患者全身麻醉术后认知功能障碍的作用机制[J].中国临床药学杂志,2020,29(2):99-102.
[2]王大亮,陈慧娟,魏盼.丙泊酚持续输注对老年食管癌患者术后认知功能障碍的临床观察[J].老年医学与保健,2020,26(3):397-401.
[3]高峻峰,秦小杰,郭有才,等.不同麻醉方式对骨科手术患者血流动力学、术后精神状态及认知功能的影响[J].现代生物医学进展,2020,20(11):2143-2147.
[4]赵一鸣,余建明.术后认知功能障碍研究进展[J].浙江中西医结合杂志,2020,30(7):604-607.
[5]杨晓君,陆敏敏,汪建胜.银杏叶注射液调节异氟烷所致高龄大鼠认知功能障碍的实验研究[J].河南中醫,2020,40(4):552-556.
[6]雒鸿飞.银杏叶注射液治疗老年人术后认知功能障碍的疗效观察[J].临床医学,2014,34(11):123-124.
[7]刘艳红.银杏叶注射液预处理对老年患者腹部手术后认知功能的影响[J].中国老年学杂志,2014,34(14):4068-4069.
[8]邓福谋.右美托咪定通过lncRNA-LOC102546895对老年大鼠术后认知功能障碍的作用机制研究[D].南昌:南昌大学,2020.
[9]张文远.七氟醚吸入麻醉通过促进星形胶质细胞的活化对围术期神经认知紊乱的影响[D].南昌:南昌大学,2020.
[10]高媛媛,王旭,任路.“肾脑相济”电针对阿尔茨海默病模型小鼠行为学及IL-1β、TNF-α表达的影响[J].上海针灸杂志,2020,39(3):359-364.
[11]郑智慧.注射用鼠神经生长因子联合多奈哌齐对老年痴呆患者认知功能的影响[J].西藏医药,2020,41(1):76-77.
[12]肖永.PINK1/Parkin自噬信号通路在丙泊酚减轻睡眠剥夺诱发的大鼠海马神经元损伤中的作用[D].南宁:广西医科大学,2019.
[13]靳秀,王圣海,马晓佳,等.痴呆患者认知功能障碍与血清IL-1β、IL-6、TNF-α、Hcy、hs-CRP和IL-1RA水平的相关性[J].精神医学杂志,2019,32(2):111-114.
[14]季艳.珍枣胶囊治疗老年阴虛火旺型失眠患者临床观察及对血TNF-α、IL-6、COR、ACTH水平的影响[D].南京:南京中医药大学,2019.
[15]王锐利,黎明,李琛,等.银杏叶提取液对不同类型脑小血管病患者认知功能改善的观察[J].心脑血管病防治,2020,20(3):256-259.
[16]陈冬,刘洋,梁晓,等.银杏叶制剂对缺血性脑卒中认知功能障碍患者血液流变学及神经保护作用的研究[J].湖北中医药大学学报,2020,22(3):33-36.
[17]苗国印.银杏叶制剂联合盐酸多哌奈齐治疗血管性痴呆的效果观察[J].四川解剖学杂志,2020,28(1):92-93.
[18]徐睿,王雪鹏,周兵.银杏叶提取物对血管性痴呆大鼠记忆力及GAT1、CREB表达的影响[J].中国实验诊断学,2020,24(2):295-298.
(2020-08-14收稿 责任编辑:王明)
