中药人源性毒性评判的科学基础、策略与技术关键点
2020-06-24马红红魏桂林潘秋莎杨凌
马红红 魏桂林 潘秋莎 杨凌


摘要 中药毒性研究中因伦理原则不可能在人体进行还原论模式的临床研究,体内外结合、动物与人体临床研究的结合成为研究模式的必然选择。有毒中药药材面临着药材组成成分的定性与定量水平差异、各不同产地药材组成成分巨大变异、毒理机制的万变、体内外模型差异、种属差异、器官组织细胞组成差异、代谢与功能非均一性、评价指标与检测方法多重性等差异的众多挑战与难题。现代毒理学高度重视与强调对人源性毒理学(而非动物毒性或细胞毒性)特征及其本质的研究,但人源性毒性在体内外体系、种属差异、脏器组织特征差异、形态结构学与分子组成差异等众多影响因素的干扰下,常常迷失本质性、机制性或原理性研究方向,理清研究逻辑,选择正确的策略与技术切入点才能避免中药毒性评价与研究误入歧途。
关键词 有毒中药;人源性;系统毒理学;标志物
Scientific Basis,Strategy,Key Technical Point and of Human-derived Toxicity Evaluation of Traditional Chinese Medicines
MA Honghong,WEI Guilin,PAN Qiusha,YANG Ling
(Institute of Interdisciplinary Integrative Medicine Research,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Abstract Owning to the ethics concerns,it is impossible to carry out clinical research of reductionism model in human body for the toxicity research of the traditional Chinese medicine,the combination of in vivo and in vitro,animal and human clinical research has become the inevitable choice of research mode.Toxic traditional Chinese medicine(TCM)are faced with many challenges and difficult problems,such as qualitative and quantitative differences in composition,huge variation in composition of medicinal materials from different origin,variation of toxicological mechanism,differences in models in vivo and in vitro,species differences,differences in organ tissue and cell composition,heterogeneity of metabolism and function,multiplicity of evaluation indexes and detection methods.Modern toxicology attaches great importance to and emphasizes the research of the characteristics and nature of the human-derived toxicity rather than animal toxicity or cytotoxicity.However,due to the interference of many influential factors,such as in vivo and in vitro systems,species differences,organ tissue characteristics differences,morphological structure and molecular composition differences,the evaluation of human-derived toxicity often loses its essential,mechanism or theoretical research direction.Only by clarifying the research logic and choosing the right strategy and technical breakthrough point can we avoid the wrong way of toxicity evaluation and research of traditional Chinese medicine.
Keywords Toxic traditional Chinese medicine; Human-derived; System toxicology; Biomarker
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.23.006
中药的有效性和安全性是中医药传承和发展的基石,中医药千百年的临床实践也使得中医药的用药经验及方式具有多样性与多变性,同时也有“人源性”“辨证论治”和“整体观”等优势,但在物质基础发现和机制研究方面仍然存在天然缺陷,中药毒性的人源性与其中药的多成分、多靶点作用使得中药的毒性评价具有极高难度,因此建立“有毒”中药材的效应物质、毒性效应和致毒机制数据库、毒效标志物与检测方法学的数据库,构建符合中医特色且国际认可的中药毒效评价模式,形成针对“有毒”中药材的科学认知、客观评价和安全使用、有效防控的系统方法尤为重要,也可进一步为中药临床合理用药,建立有效的质量控制标准提供科学依据。
1 有毒中藥材组成成分的复杂性
中药材成分极其复杂,所含成分还因品种、产地、炮制工艺等发生变化;同时药材还有可能受重金属,霉菌等成分的污染。根据所含有效成分或有效成分的不同,中药可分为道地药材普通药材。我国土地辽阔,地形错综复杂,气候条件多种多样。不同地区的地形、土壤、气候等条件,形成了不同的道地药材。独特的环境下,物种形成了自己的品质与生长、繁衍习性,所含成分也因此而发生变化。因此,中药因来源于天然或种植,其组成稳定性是一极大挑战[1]。
中药经炮制后,由于加热、加辅料等处理,可以使某些中药中的化学成分发生变化,有的成分被溶解出来,有的成分被分解或转化成新的成分,有的成分有量的增减,只有在搞清楚中药在炮制过程中多成分之间的转变及机制,才能完成中药质量的稳定及控制[2]。更好地了解中药炮制的目的,进而为探讨中药炮制原理,据现代药学研究表明,炮制对中药材成分有着很显著的影响。例如,生物碱是一类含氮有机物,通常有似碱的性质,味苦。炮制此类中药材常用的辅料有醋、酒2种。醋,呈弱酸性。可使生物碱成盐而易被水煮出(溶水性),增强疗效。酒,弱极性。可使生物碱游离其内,便于煎出有效成份。许多中药经炒制后,可杀酶保苷,如芥子,牛蒡子等;煅制常用于处理矿物药,动物甲壳及化石类药物,能使质脆易碎,而且作用也会发生变化。如白矾煅后燥湿、收敛作用增强。血余煅炭后能止血。川乌、草乌加热煮制后,其毒性显著降低,保证了临床用药安全有效。中药经辅料制后,在性味、功效、作用趋向归经和不良反应方面都会发生某些变化,从而最大限度地发挥疗效。除以上可造成中药成分复杂性增加之外,由于储存不当,中药还会受到霉菌污染,使成分发生改变,产生毒性或其他不良反应[3]。中医药理论认为,毒性是中药最基本的性能之一。如中药药源性肝损伤,是指由于中药自身或其代谢产物导致的肝脏损伤。在2016版的《中草药相关肝损伤临床诊疗指南》中也提到了常见的中药肝损伤就按损伤靶细胞类型分为肝细胞损伤型,混合型,胆汁淤积型和肝血管损伤型[4]。不仅是肝毒性,许多中药活性成分都具有潜在的毒性,如《中华人民共和国药典》中列出的10大有毒中药,川乌,马钱子等[5]。多数具有生物碱,例如早已耳熟能详的草乌,因含有双酯型二萜生物碱,其可对神经系统产生不良反应,那是否会有更多中药的各类生物碱具有毒性有待进一步研究。由此可见,中药毒性机制的复杂多样同时也是中药材复杂的重要原因之一。
2 人源性毒性的特点
中药的毒性/药效是中药多成分与机体相互作用的结果,其效应评价不仅取决于中药本身成分还取决于被作用的评价模型,模型不同其作用效果也不同。在实际研究中,也需依据中药材所作用的靶器官或者中药材中某一活性成分作用的靶细胞及亚细胞器选定评价模型,若此中药材或成分现并未有文献对其毒性/药效进行报道,应先从其活性成分组成及分子结构特征推断其可能毒性/药效,并进一步推进整体动物实验,从而观察其真实毒性/药效靶器官、靶细胞及靶细胞器,最后再在体外模型上对其机制进行研究。虽然哺乳动物与人体绝大多数组织/器官的形态和解剖结构相似,但其成分组成(如蛋白种类和水平等)及主要代谢通路/网络存在较大差异,因此,中药成分在不同种属中的代谢过程及关键影响因素往往存在较大差异,这直接导致动物实验结果与临床数据间的不匹配[6]。因模型选择的不匹配性,重复性研究往往变成为不断创新的探索性研究。
3 体外模型的缺陷
在对中药材人源性毒性的研究中,因模型存在着各种局限及困难,例如,体外研究常常因使用细胞而将组织或器官特征简单化,是不同来源器官或组织特征同质化,例如只有线粒体代谢,其他特征性代谢的信息缺失,如果再缺乏针对性的评价指标及技术方法,其提供的毒性信息十分有限。体外研究模式的不确定性或者说在学术界并未形成学术共识,这导致大量的新颖的体外模型不断引入,但研究的系统性、目标性与规范性极差。其中体外模型及其缺陷还存在大量的技术障碍。
体外模型指的是在体外对人体的生理环境进行模拟,进而揭示疾病本身的发生发展,或者借以体外模型对相关治疗药物的药理学或毒理学机制进行研究。在科学研究中,体外模型建模依据的多样性也决定了其具体模型的多样性及复杂性,同时随着科学研究与日俱增的严谨性及准确性,体外模型也能更加精确的对体内真实情况进行模拟,且体外模型简便易行,实验条件容易控制,在药物的机制研究上能极大程度的减少类似于体内反应所带来的的连带作用,如在研究药物在肠道的吸收及转运机制时,就常采用Caco2细胞模型对药物的肠道吸收进行模拟,且Caco2模型也是最为常用的肠道转运模型及上皮转运模型[7]。
4 动物模型的缺陷
体内研究因使用动物,又常常忽视种属差异、过程信息缺失、低通量高耗费、致毒机制不清、致毒过程不明、无法前瞻预测等缺点,且个体及脏器之间也存在巨大的差异,这就造成了中药材人源性毒性的甄别产生巨大阻碍及困难。对于应用中药动物模型,由于同样缺乏系统评价,其中引发的问题更加严重[8]。
在一项对221起引起人类毒性反应的150种药物的调查中发现,啮齿动物和非啮齿类动物与人类毒性反应阳性一致率为71%,其中非啮齿类动物仅可预测63%的人类毒性反应,仅啮齿类动物仅可预测43%的人类毒性反应[9]。
动物模型是指依靠实验动物对疾病或者治疗药物对相关疾病治疗情况进行模拟,以进一步阐释其药物在动物体内的作用。实验动物和人的各器官系统不仅在形态上相似,而且生理解剖功能都与人体有一定的相似性,可极好的对人体各功能进行模拟,如皮肤、心血管系统、内分泌系统、胃肠道和泌尿系统,因此采用动物进行实验为科学研究中必不可少的环节。动物胰腺的生理功能与人体类似,在糖的吸收、转运和利用研究中可以用动物模型进行前期模拟[10-11],如猪的胰岛素与人类的胰岛素只差一个氨基酸,因此,用猪制作糖尿病模型对糖尿病的研究极其重要[12]。动物中有着与人类相似的细胞色素氧化酶P450系统,所以,在药物的代谢研究中常用动物模型进行前期的探究[13]。
动物与人体之间种属差异大,如多种CYP酶在物种间的表达和活性均存在差异[14]。生物体由多个系统组成,而各个系统又构成一个复杂的有机体,而人体是更为复杂且有感情的有机体,所以机体内所发生的都不是单一反应,均是复杂的级联反应,这就使得了解简单具体体内某一反应或某一通路变化变得困难,进而使得药效预测能力较差,难以实现真实模拟人类反应的目的,因此,动物实验只能作为药物的临床前研究模型,药物的安全性及疗效必须依靠临床试验得出最终结论。动物实验费用高,且饲养条件要求也较高。
5 本研究团队的策略与研究优势
中药材成分的复杂性直接决定了其作用于人体后药效与毒效研究的难度和局限,同时机体的复杂内部环境也使得中药的体内研究成为一个难以透视化及标准化的“黑箱”。本研究团队一方面借以系统生物学从整体动物到单靶点(分子)对中药的药效及毒效进行研究。见图1。采用组学、数据库及各种算法筛选中药复方或成分对机体的调节途径及代谢通路,并进一步根据其作用模型及作用组织的特征对其在器官水平及整体水平上做出互作关系网络图,另一方面,有害结局路径逻辑框架对中药的作用进行预判,即从早期起始分子事件-亚细胞损伤-细胞生死-组织病理结构改变-终点效应间存在严格的逻辑与因果关系,也即组织病理结构改变这一有害结局出现前,微观水平的代谢异常和细胞异常死亡等往往早已出现,因此,如果以毒性发生的“起始事件”、代谢紊乱、细胞生死异常凋亡/死亡为早期评判标准,则可能完成早期“有害结局”预判。本研究团队拟通过以上策略及研究优势阐明药物各成分“黑箱操作”,进而推动中药发展。
5.1 生物标志物 标志物首先是源于机体器官、组织、细胞、亚细胞器中的标志性或/和功能性分子。我们从标志物的相似性评价角度首先来规范与评价体内外模型的差异、人源性与动物种属间差异性、脏
器组织细胞及亚细胞间的差异性。因此,标志物的选取是最核心的技术切入点,也是科学问题的落脚点。尽管病理学改变是目前毒性评价的金标准,但由于病理学改变往往发生在毒性的中后期、具有不
可逆性,因此,找到早期毒性的定量检测指标,是药物毒性研究首先需要解决的问题。通过分析代谢水平、细胞水平和组织整体水平毒性数据指标,筛选出可准确定量检测的毒性特征性指标和生物标志物,能够在毒性发生的早、中、晚期对毒性进行定量监测。再结合离体器官、细胞水平等体外技术及毒代动力学结果,揭示“有毒”中药材的毒性剂量、靶器官、毒性物质基础、制毒机制,多成分的相互作用规律。利用标志物,将机体(分子、细胞、组织与器官种类)的组成、结构与功能紧密结合,实现系统生物学水平的中药毒物学与毒理学突破。
5.2 体外技术 依照人源性器官、组织、细胞的组成与结构要求,构建时空多维度一体化整合的微流控器官芯片[15-16],将检测与反应体系整合进入芯片体系,实现生化、细胞与组织三水平工程上的生长、反应、控制与检测的协调与统一。例如,通过将人源实质细胞与基质细胞共培养的方式,模拟器官的生理结构,构建系列“高仿生”动物/人源的肝、肾、肠、心、神经系统等微流控器官芯片以及多器官集成芯片;与组学等检测技术相结合,构成能够动态连续性多维度定性/定量评价中药安全性与有效性微流控器官集成芯片。以模块化的方式构建组织的器官微流控芯片系统,模拟药物在体内的吸收(A)、分布(D)、代谢(M)和排泄(E)过程,测出药时曲线,得到药物的达峰时间、半衰期、消除速率常数等药代动力学参数,并与动物实验结果比较,取得可比性和关联性,实现吸收、分布、代谢和消除等过程的参数测定。在整体毒性评判水平,逐渐形成一个具有普适性、接近或不低于实验动物毒性评价能力与标准的体外模拟与研究平台,应用于有毒中药材的“量-时-毒-效”关系的评估。
5.3 体内技术 基于微流控器官芯片技术衔接人体与动物源、体外与体内研究体系,揭示并解决有毒中药安全性和有效性[17]。利用公认的造模方法,在严格的质控标准指导下,建立与人源性毒性相匹配或相似度极高的动物毒性评判模型,具体目标是建立肝、肾、肠、神经、心脏毒性的动物模型;作为研究的阳性对照,检测活体动物的各项指标,其中包括内源性物质与能量变化与外源性毒物及其代谢变化随时间的同步监测体系,具体利用各种组学技术,对可能收集到的体液与组织样本如尿液和血液中的内外源性相关代谢物进行定性定量分析,在对动物进行最终处理时,结合解剖与病理学结构形态学检查,在时间上,将组成、功能与结构的变化同步。通过多变量数据分析,筛选出分子水平、细胞水平、组织水平等多水平的差异性指标,结合同步的功能性变化,解析毒性发生、发展的机制。在理念上,高度正视传统采用动物试验方法进行毒性研究的缺陷。特别是注意试验结果的简单种属间外推或经验性外推[18]。
5.4 多系统毒性的“量-时-效-毒”信息与数据的整合 利用体外和整体动物的数据构建模式动物的整体PBPK-PD/TK模型,预测单味药材单成分、多成分在血浆及肝肾等重要毒靶器官的暴露量的经时变化关系和多成分互作关系;在此基础上,整合用药剂量、毒效和暴露量数据,构建单味药材的整体量-时-效关系,对多系统毒性的量-时-效-毒关系进行人体内动力学行为的定量预测,为临床合理用药提供可靠准确的资料。见图2。
评价细胞活性及毒性效应是中药人源性毒性的评价手段之一。通过分子、细胞、组织水平上毒效标志物的确立和验证,例如,早期毒性标志物的建立,通过对体外人源细胞/类组织与组学分析技术的结合,以代谢异常及亚细胞特征性标志物的异常泄露,结合各组学数据和组织病理学、生化指标,从而可准确定量检测的毒性生物标志物,能够在毒性发生的各个时期对毒性进行定量监测。通过构建动物模型,对有毒中药进行量时毒效关系评价以及相关整体实验与验证。再在体外代谢中研究建立不同毒性靶器官的有害结局评价方法,分别采用血液生化与组织学指标进行比较研究。构建模式动物的整体PBPK-PD/TK模型,进行人体内源性物质代谢谱与外源性物质代谢谱间的动力学行为整合,形成定量预测模型。通过系统药理学和网络药理学技术,对特定的分子水平、细胞水平、组织水平等多水平的毒物靶点进行整合,整合各种体内外模型构建技术,以及针对相应毒效指标及标志物开发建立的组学、酶活检测、组织病理检查等定性定量检测技术,进而预测和评价中药成分-机体、成分相互、量-毒关系,阐明有毒中药成分在体内的效应物质基础和多成分互作关系,预测这些成分在人体的“量-时-毒-效”关系,可以确定中药的安全用药范围及可能的易感物质和易感機制。
基于生物信息学和网络药理学技术的毒性成分预测和分析是对实验的必要补充。1)利用前期开发计算ADME技术和药物体内半衰期数学模型,确定候选有毒成分。借助系统药理学和网络药理学技术,预测多成分之间的互作关系及其所产生的不良反应,借此剖析中药单味药以及复方内有毒成分群;2)采用人工智能、机器学习以及现代统计理论构建人体主要脏器药物毒性数学模型、构建人体多脏器生物富集模型。开展和完善前期所开发的化学成分在多个脏器内(主要包括肠、肝肾、大脑等)分布、富集预测数学模型。借助前期开发的药物靶点预测方法,开展有毒中药多成分毒性互作蛋白的预测和验证研究,以锁定毒物靶点,揭示有毒中药的易感分子机制;3)开展基于靶点和通路作用的有毒成分毒性分级评价。借助基元动力学技术结合网络药理学分析工具,构建定量预测和评价多成分互作量-毒关系。
5.5 有毒中药的毒性将怎样进行研究? 目前,有毒中药材其毒性分为3级:“有大毒”“有毒”“有小毒”,这一种模糊定量概念。中药产生毒性的机制复杂多样,何种药材中的何种成分会导致毒性,这是需要首先定性的问题。我们从以下几方面来展开:1)物质基础的分析与确定;2)主要靶细胞模型与生物标志物的选择;3)代谢或转运干扰机制以及引发的多成分或药药相互作用模型;4)整体内动力学变化过程与毒性产生动力学间的关系。
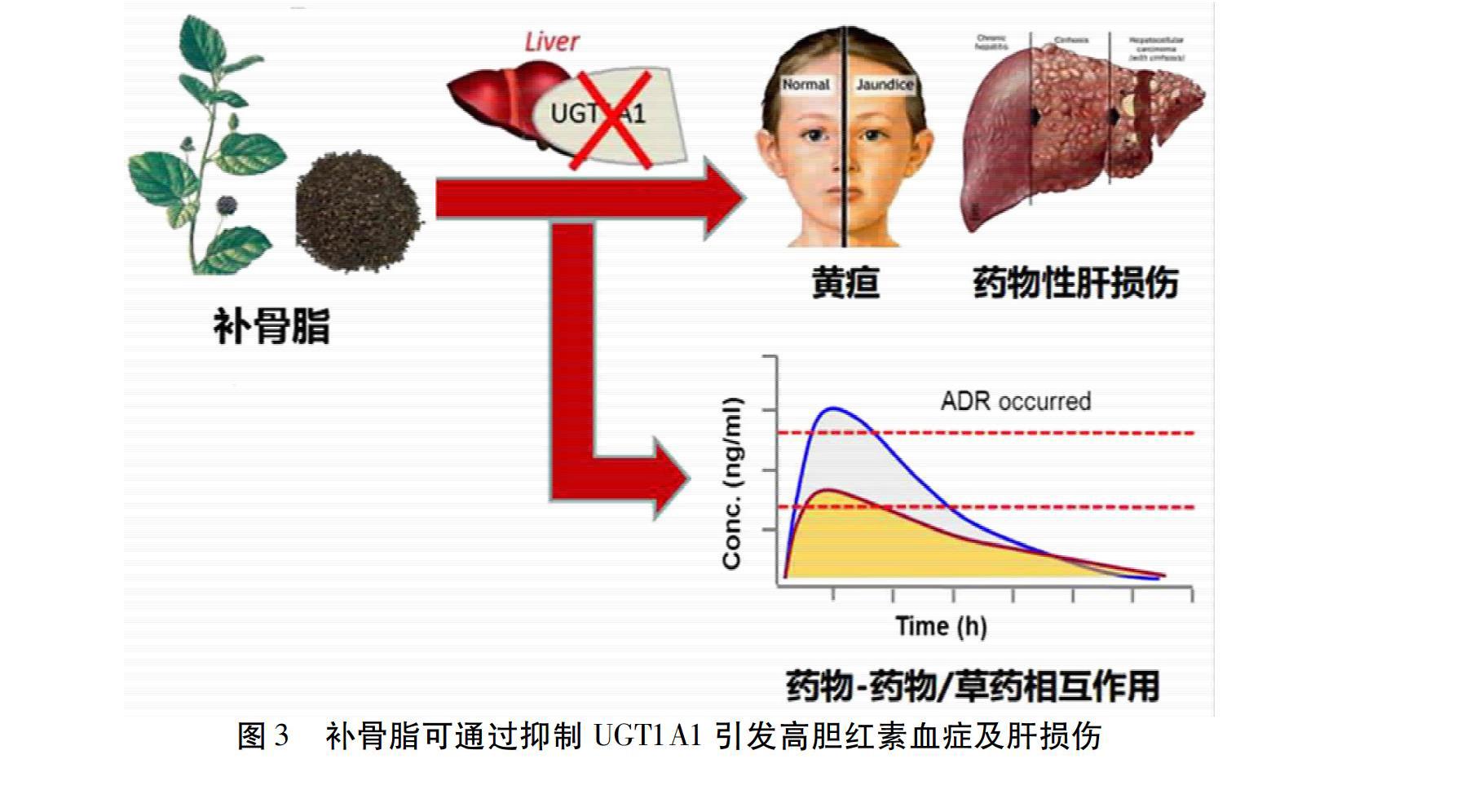
尿苷二磷酸葡萄糖醛酸转移酶(Uridine 5′-diphospho-glucuronosyltransferase,UGTs)是一种紧密相连细胞膜内表面且存在于细胞内质网腔内的膜蛋白,主要分布在肝脏和肠道中,介导多种葡萄糖醛酸结合反应[19]。众多UGTs亚型中,只有尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1)酶能代谢肝脏中胆红素,通过促进葡萄糖醛酸与间接胆红素接合,并将其转化为直接胆红素[20]。UGTIA1在维系机体内源性物质的代谢平衡中发挥的作用是至关重要的,它介导了大量药物、毒物或致癌物质的代谢清除。但是,当UGT1A1活性受到抑制时,将会导致内源性物质胆红素代谢紊乱,还能够引起临床上不良的药物/草药-药物相互作用,从而引发多种与人体密切相关的疾病,如黄疸、高胆红素血症、肝毒性、神经毒性等[14]。例如,中药及其活性成分会通过抑制UGT1A1的活性导致高胆红素血症及引发其他不良反应,诸如补骨脂、首乌、穿心莲等提取物均可以强效抑制UGT1A1[21-22]。见图3。
总之,针对“有毒”中药材的药效物质、毒性成分、安全用药剂量尚未明确等问题,结合人源性毒性发生特点、选择明确的标志物、建立高仿生微流控整合体外技术,完成体外的初步筛选;明确目标毒性,建立一套质控系统,选择与人体体系相似的模型动物,通过系统生物如组学技术,开展目标物质的“量-时-毒-效”关系研究,确定安全用药范围、易感因素与和机制;最终建立毒-效关系的中药质量控制标准,建立符合中医药特点的中药安全性评价模式和技术体系。见图4。为临床合理用药和建立有效的质量控制标准提供科学依据。
参考文献
[1]Luo X,Chen X,Shen X,et al.Rapid identification and analysis of the active components of traditional Chinese medicine Xiaoxuming decoction for ischemic stroke treatment by integrating UPLC-Q-TOF/MS and RRLC-QTRAP MSn method[J].J Chromatogr B Analyt Technol Biomed Life Sci,2019,1124:313-322.
[2]闫晓哲.中药炮制方法对中药饮片临床疗效的影响[J].深圳中西医结合杂志,2020,30(18):52-53.
[3]张宏,谷伟玲.中药炮制对其化学成分及临床应用的作用探讨[J].當代化工研究,2020,10(19):167-168.
[4]肖小河,李秀惠,朱云,等.中草药相关肝损伤临床诊疗指南[J].中国中药杂志,2016,41(7):1165-1172.
[5]金若敏.中药肝毒性的评价与思考[A].中国毒理学会、台湾毒物学学会.2019年海峡两岸暨港澳青年科学家毒理学学术交流会论文集[C].中国毒理学会、台湾毒物学学会:中国毒理学会,2019:2.
[6]Wang YQ,Shang XF,Wang L,et al.Interspecies variation of clopidogrel hydrolysis in liver microsomes from various mammals[J].Chem Biol Interact,2020,315:108871.
[7]Hulbert ML,Shenoy S.Hematopoietic stem cell transplantation for sickle cell disease:Progress and challenges[J].Pediatr Blood Cancer,2018,65(9):e27263.
[8]唐素勤,于国俊.中药肾毒性原由及应对策略探析[J].中药与临床,2020,11(4):30-33,46.
[9]Harry Olson,Graham Betton,Denise Robinson,et al.Concordance of the Toxicity of Pharmaceuticals in Humans and in Animals[J].Regul Toxicol Pharmacol,2000,32(1):56-67.
[10]Iansante V,Mitry RR,Filippi C,et al.Human hepatocyte transplantation for liver disease:current status and future perspectives[J].Pediatr Res,2018,83(1-2):232-240.
[11]atej M,Zupani Slavec Z.Development of homologous skin,bone and other soft tissues transplantation in Slovenia[J].Acta Med Hist Adriat,2017,15(1):151-158.
[12]古展辉,郭姣.实验小型猪2型糖尿病模型的研究进展[J].广东药科大学学报,2019,35(2):301-306.
[13]Bodzin AS,Baker TB.Liver Transplantation Today:Where We Are Now and Where We Are Going[J].Liver Transpl,2018,24(10):1470-1475.
[14]Llull R,Murase N,Ye Q,et al.Chimerism,graft-vs-host disease,rejection,and their association with reciprocal donor-host immune reactions after cell,organ,and composite tissue transplantation[J].Transplant Proc,1997,29(1-2):1203-1204.
[15]Noor N,Shapira A,Edri R,et al.3D Printing of Personalized Thick and Perfusable Cardiac Patches and Hearts[J].Adv Sci(Weinh),2019,6(11):1900344.
[16]Maares M,Haase H.A Guide to Human Zinc Absorption:General Overview and Recent Advances of In Vitro Intestinal Models[J].Nutrients,2020,12(3):762.
[17]曲玥阳,邓九,王帅,罗勇.基于肾、肝和心脏芯片的药物毒性鉴定新方法[A].中国毒理学会中药与天然药物毒理专业委员会.中国毒理学会中药与天然药物毒理专业委员会第二次(2017年)学术交流大会论文集[C].苏州:中国毒理学会中药与天然药物毒理专业委员会:中国毒理学会,2017:1.
[18]蔡乐.基于肝器官芯片的中草药成分肝毒性评价[D].大连:大连理工大学,2019.
[19]Tukey RH,Strassburg CP.Human UDP-glucuronosyltransferases:metabolism,expression,and disease[J].Annu Rev Pharmacol Toxicol,2000,40:581-616.
[20]Lv X,Xia Y,Finel M,et al.Recent progress and challenges in screening and characterization of UGT1A1 inhibitors[J].Acta Pharm Sin B,2019,9(2):258-278.
[21]劉新豫,吕侠,吴敬敬,等.胆红素代谢酶UGT1A1介导的中药不良反应研究进展[J].药物评价研究,2018,41(5):716-726.
[22]Wang XX,Lv X,Li SY,et al.Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltransferase 1A1 in Fructus Psoraleae(Bu-gu-zhi)[J].Toxicol Appl Pharmacol,2015,289(1):70-78.
(2020-11-19收稿 责任编辑:王明)
