体外构建工程化汗腺类器官的初步研究
2020-06-24陈润开付小兵孙晓艳
陈润开,付小兵,孙晓艳*
1天津医科大学研究生院,天津 300070;2解放军总医院医学创新研究部创伤修复与组织再生研究中心,北京 100853;3解放军总医院第四医学中心组织修复与再生全军重点研究实验室,北京 100048
作为人体最重要的皮肤附属器之一,汗腺在维持机体代谢平衡方面具有不可替代的作用。大面积烧伤、严重撕脱伤患者创面瘢痕愈合后汗腺的结构和功能缺失,致使机体无法通过汗液蒸发进行体温调节,严重影响了患者的生存质量。研究表明,外胚层发育不全(ectodysplasin,EDA)基因是汗腺发育过程中的主要功能基因之一[1]。在胚胎发育时期,EDA通过激活核因子-κB(nuclear factor-κB,NF-κB)与EDA受体联合调节汗腺的发育与成熟[2],因此EDA可作为汗腺再生的治疗性靶点进行干预。目前,第三代基因编辑技术CRISPR/Cas9系统已经成为细胞重编程最热门的手段之一[3],利用该技术可以跨谱系重编程成体细胞为另一类型的成体细胞,具有效率高、脱靶率低等优势。在此基础上,Kearns等[4]开发了一种受强力霉素(doxycycline,Dox)调控的dCas9-effector系统,该系统由dCas9与VP16四聚体激活结构域(VP64)融合而成,使目的基因的表达更加受控。类器官是一种高度还原原位组织生理结构及功能的新型微器官模型,由具有干性的细胞在三维条件下自我组装形成[5]。类器官体系克服了细胞二维培养模式的局限性,尽可能地还原了器官发育过程[6-8],具有传统方式无法比拟的优势。本研究拟利用CRISPR/dCas9系统靶向EDA启动子序列,上调内源性EDA基因的表达水平,将人永生化表皮角质细胞重编程为汗腺样细胞,在体外三维环境下培养诱导其发育为汗腺类器官,以促进体内汗腺的功能性再生。
1 材料与方法
1.1实验材料 人永生化表皮细胞系(human immortalized keratinocyte,HaCaT)、293T细胞购买于国家实验细胞资源共享服务平台;SPF级BALB/c雌性裸鼠(20只)购自斯贝福(北京)生物技术有限公司;Dulbecco's Modified Eagle's F12培养基、Epilife培养基、HKGS购自美国Gibco公司;Real Master Mix(SYBR Green)购自日本TOYOBO公司;角蛋白18(cytokeratin,CK18)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、EDA、水通道蛋白5(aquaporin 5,AQP5)、GAPDH一抗购自美国Abcam公司,二抗购自北京中杉金桥生物技术有限公司。Matrigel购自美国康宁公司。dCas9质粒(含neo位点)、psPAX2、pMD2.G包装质粒由本实验室保存。EDA基因启动子(正义:5'-ACCCGTTCCTGCGCGACAG-3';反义:5'-CTGTCGCGCAGGAACGGGT-3')由本实验室提供。单链向导RNA(sgRNA)质粒由苏州吉玛基因公司负责构建。
1.2病毒包装与收集 293T细胞在DMEM完全培养基中培养。将dCas9质粒和构建完成的sgRNA质粒分别与慢病毒psPAX2、pMD2.G包装质粒按3:1:4质量比混合,使用Lip 2000共转染293T细胞,培养6 h后更换为完全培养基,培养48、72 h后分别收集细胞上清液,过滤,-80 ℃保存备用。
1.3细胞转染与筛选 HaCaT细胞在含1% HKGS的Epilife培养基中培养。HaCaT细胞接种于10 cm培养皿,待细胞融合度达40%时更换为含10 μg/ml聚凝胺的新鲜培养基6 ml孵育0.5 h,随后加入6 ml含有sgRNA质粒的病毒液继续孵育,12 h后更换为新鲜培养基。48 h后观察绿色荧光蛋白(green fluorescent protein,GFP)表达情况,并采用荧光激活细胞分选技术筛选出GFP阳性细胞。在此基础上,重复上述步骤进行dCas9质粒包装、转染,400 μg/ml的G418培养7 d后筛选出双阳性细胞,并命名为HaCaT-E细胞。
1.4RT-PCR、Western blotting检测EDA表达水平 汗腺培养基的组成如前期研究所示[9]。将细胞分为4组:HaCaT组(HaCaT细胞使用汗腺培养基培养)、HaCaT+Dox组(HaCaT细胞使用含5 μg/ml Dox的汗腺培养基培养)、HaCaT-E组(HaCaT-E细胞使用汗腺培养基培养)、HaCaT-E+Dox组(HaCaT-E细胞使用含5 μg/ml Dox的汗腺培养基培养)。诱导培养7 d后收集各组细胞,Trizol裂解提取RNA,并反转录为cDNA。RT-PCR:按照Real Master Mix 10 μl、上下游引物各1 μl、cDNA模板2 μl、ddH2O补足20 μl配制反应体系。反应条件为:95 ℃ 2 min预变性;95 ℃ 30 s、60 ℃ 40 s,40个循环后进行熔链分析。引物序列如下(5'→3');EDA:F-GGACGGCACCTA CTTCATCT,R-TGTAGTTGGTCTTGCCCGTC;GAPDH:F-CTGGAAGATGGTGATGGGATT,R-TGTGAAGGTCGGAGTCAACGGAT。Western blotting检测EDA蛋白的表达:细胞经RAPI裂解提取总蛋白;热变性后,行SDS-PAGE电泳;转膜后浸没于5%脱脂奶粉室温封闭0.5 h,抗体孵育后进行检测。一抗为EDA(兔抗,1:1000)、GAPDH(鼠抗,1:1000)。
1.5经诱导后HaCaT-E的细胞免疫荧光染色 由于汗腺培养基及Dox均不能诱导HaCaT细胞,因此后续实验均使用HaCaT-E细胞进行。HaCaT-E细胞铺板于24孔板,HaCaT-E组细胞使用不含Dox的汗腺培养基培养,HaCaT-E+Dox组细胞使用含Dox的汗腺培养基培养。培养7 d后,使用预冷的4%多聚甲醛固定0.5 h;PBS洗涤3次,每次5 min;0.2% TritonX-100室温孵育10 min;PBS洗涤3次,每次5 min;5%山羊血清室温封闭30 min,一抗CK18(鼠抗,1:500)、α-SMA(兔抗,1:200)、AQP5(兔抗,1:200)4 ℃孵育过夜;PBS洗涤3次,每次5 min;二抗(1:100)室温避光孵育2 h;PBS洗涤3次,每次5 min。DAPI复染封片,荧光显微镜下观察拍照。
1.6汗腺类器官的体外构建与免疫荧光染色 Matrigel提前解冻,重悬HaCaT-E细胞并调整细胞浓度为5×106/ml,与Matrigel按1:9混合均匀后,置于预冷的24孔板中,37 ℃孵育30 min使其凝固。HaCaT-E+Dox组加入含Dox的汗腺培养基300 μl,HaCaT-E组加入同体积不含Dox的汗腺培养基,孵育培养7 d后,收集实验组细胞团,4%多聚甲醛固定并进行免疫荧光染色,染色步骤、抗体同1.5。
1.7烫伤模型的建立及多细胞结构的移植 20只裸鼠随机均分为治疗组与对照组,每组10只。小鼠脚掌常规消毒,采用金属烫伤仪85 ℃接触5 s造成深Ⅱ度烫伤,迅速浸没于冰水中,观察见掌垫发白变性为建模成功[10]。收集诱导7 d的汗腺类器官,按5×105个/ml重悬于含Dox的汗腺培养基中,采取多点注射方式将类器官混悬液(50 μl)注射到治疗组小鼠烫伤创面皮下。对照组按相同方式注射同体积的汗腺培养基。24 h后重复注射一次。治疗组及对照组小鼠饲喂含Dox(2 μg/kg)的维持饲料,同时按100 g/kg体重的剂量腹腔注射10 mg/ml的Dox溶 液[11],每5天重复注射一次。
1.8碘-淀粉发汗实验及组织免疫荧光染色 移植实验后4周,将碘酒均匀涂抹于小鼠烫伤掌面并充分干燥。将小鼠置于铺满淀粉的鼠笼中,使掌垫与淀粉充分接触,于掌垫皮下注射100 μmol/L乙酰胆碱50 μl,5 min后观察掌垫表面淀粉颜色变化,出现散在的蓝黑色斑点为发汗实验阳性。发汗实验后取鼠掌组织固定、包埋后石蜡切片。脱蜡后切片进行抗原修复,5%山羊血清室温封闭30 min,滴加一抗CK18(1:500)、α-SMA(1:200),4 ℃孵育过夜。PBS洗涤3次,每次5 min;荧光二抗避光室温孵育2 h,PBS洗涤3次,每次5 min。DAPI复染封片,荧光倒置显微镜下观察拍照。
1.9统计学处理 采用SPSS 22.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1质粒转染及阳性细胞筛选 转染sgRNA质粒48 h后,荧光显微镜下观察可见GFP阳性细胞散在表达,阳性率为51.0%±2.1%。GFP阳性细胞转染dCas9质粒后,在添加G418抗生素(400 μg/ml)的培养基中继续筛选7 d,挑取阳性克隆(47.1%±1.8%)进行扩增培养,获得HaCaT-E细胞。
2.2RT-PCR、Western blotting检测EDA的表达 RT-PCR检测结果显示,汗腺培养基诱导7 d后,与HaCaT组比较,HaCaT-E+Dox组细胞中EDA mRNA的表达水平上调(4.62±0.19)倍,差异有统计学意义(P<0.05),而HaCaT+Dox组及HaCaT-E组的EDA表达水平未见明显上调(P>0.05,图1A)。Western blotting检测结果显示,HaCaT组、HaCaT+Dox组、HaCaT-E组及HaCaT-E+Dox组的EDA蛋白表达趋势与RT-PCR检测结果基本一致(图1B)。
2.3H a C aT-E 细胞的形态特征及表型鉴定 HaCaT-E细胞在不含DOX的汗腺培养体系中形态变化不明显。加入5 μg/ml Dox孵育培养7 d后,其胞体呈长梭形改变,并出现网络样生长趋势(图2)。免疫荧光染色结果显示,诱导培养后HaCaT-E细胞表达汗腺表面标记物CK18、AQP5、α-SMA为阳性(图3)。

图1 经诱导培养后4组细胞中EDA mRNA(A)及蛋白(B)表达水平比较Fig.1 Expression levels of EDA mRNA(A) and protein (B) in HaCaT-E cells after induction culture

图2 HaCaT-E组(A)及HaCaT-E+Dox组(B)细胞诱导培养7 d后的形态对比(倒置显微镜)Fig.2 Comparison of morphological changes between the HaCaT-E (A) and HaCaT-E+Dox group (B) after 7 days induction culture (Inverted microscope)
2.4汗腺类器官的结构特征及表型鉴定 将HaCaT-E与Matrigel混合,采用含Dox的汗腺培养基诱导培养7 d后,细胞增殖、发育形成多细胞团状球体结构,镜下可见其体积增大,具有中空囊腔样结构。而HaCaT-E组由于培养体系中不含Dox,无法启动内源性EDA基因的表达,因此诱导培养至第4天时,细胞团表现出增殖迟滞,形态崩解,不能长期维持多细胞的球体结构(图4)。免疫荧光染色结果显示,HaCaT-E+Dox组中多细胞球体结构表达汗腺标记物CK18、α-SMA、AQP5(图5)。
2.5汗腺类器官促进体内汗腺的功能性修复 给予乙酰胆碱刺激后,治疗组与对照组小鼠脚掌的发汗情况有明显差异。大体观察可见治疗组小鼠掌垫表面有少量散在分布的蓝黑色斑点,为发汗实验阳性表现;对照组掌垫均为阴性表现(图6)。发汗实验阳性掌垫组织切片免疫荧光染色结果显示,其表皮增厚,层数增多,基底层及亚基底层分布着大量表达GFP的工程化细胞,真皮深层及皮下组织内散在分布着管腺样结构,同时表达GFP及汗腺标志性蛋白CK18及α-SMA;对照组则无上述改变, 且表皮基底层光滑,呈现典型的烫伤后愈合形态(图7)。
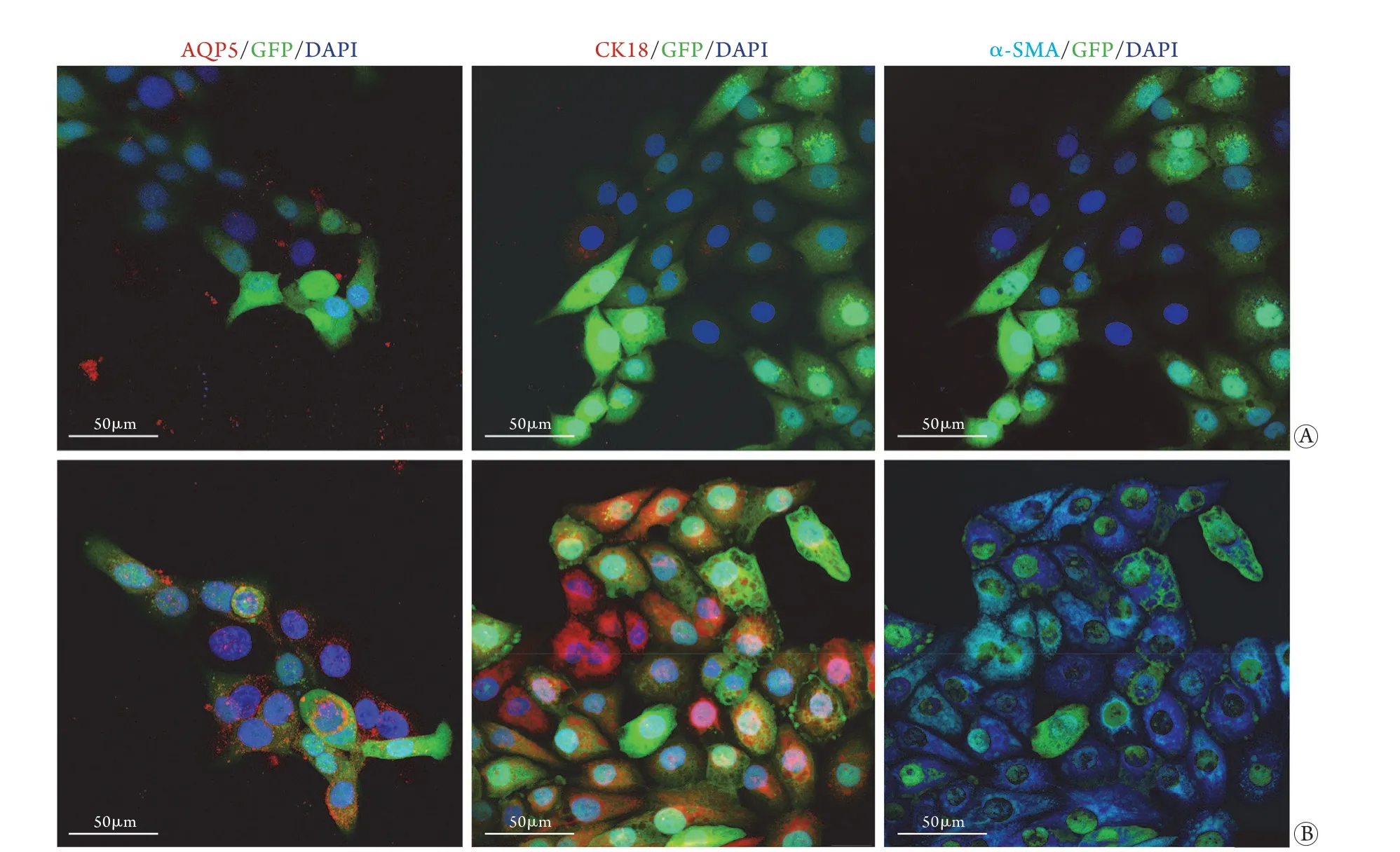
图3 HaCaT-E组(A)与HaCaT-E+Dox组(B)诱导培养7 d后汗腺表面标志物对比Fig.3 Comparison of sweat gland-associated proteins in HaCaT-E (A) and HaCaT-E+Dox group (B) after 7 days induction culture

图4 HaCaT-E组(A)及 HaCaT-E+Dox组(B)汗腺类器官形态特点(倒置显微镜)Fig.4 Morphological characteristics of sweat gland organoids in HaCaT-E (A) and HaCaT-E+Dox group (B) (Inverted microscope)

图5 CK18(A)、α-SMA(B)、AQP5(C)在汗腺类器官中的表达Fig.5 Expressions of CK18 (A), α-SMA (B), AQP5 (C) in sweat gland organoids

图6 对照组(A)及治疗组(B)裸鼠掌垫移植汗腺类器官4周后碘-淀粉发汗实验大体观察结果Fig.6 General observation of sweating test 4 weeks after transplantation with sweat gland organoids in nude mice of control group (A) and treatment group (B)
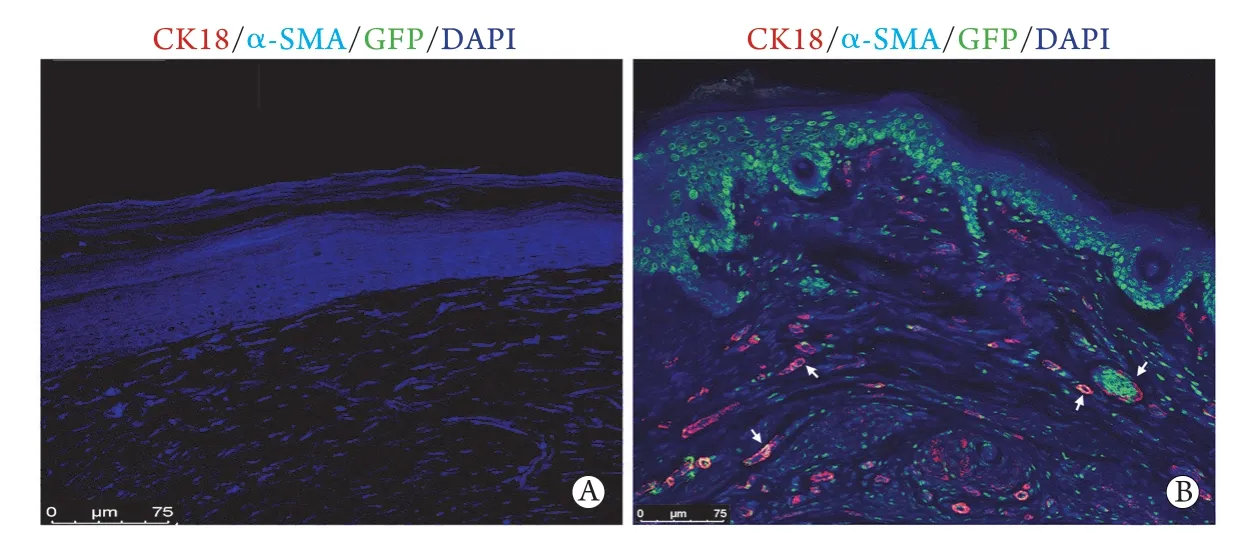
图7 对照组(A)及治疗组(B)碘-淀粉发汗实验阳性脚掌组织的免疫荧光染色结果Fig.7 IF staining of sweat gland-related markers in nude mice of control group (A) and treatment group (B) engrafted with sweat gland organoids
3 讨 论
大面积烧伤及严重创伤患者由于创面瘢痕愈合导致汗腺结构损毁或导管堵塞,从而丧失了泌汗功能,严重影响了患者的生存质量,给患者的生理和心理带来了巨大的创伤。目前,汗腺的功能性修复是再生医学研究的热点及难点。在前期工作中,本课题组将骨髓间充质干细胞与汗腺细胞共培养,成功诱导其定向分化为汗腺样细胞[9]。人体移植实验表明,这些诱导而来的汗腺样细胞不但可以促进创面内汗腺的结构修复,再生的汗腺还具备排汗功能。此外,Sun等[12]采用CRISPR/dCas9技术上调EDA在骨髓间充质干细胞内的表达,在体外重编程其为汗腺样细胞,重编程而来的汗腺细胞在获得汗腺表型的同时,还能在体内促进小鼠创面的功能性修复。
汗腺再生是一个复杂的生物学过程,由多种细胞、多种因子及细胞外基质组分共同参与。然而种子细胞获取困难,且缺乏允许汗腺生存的微环境是研究者面临的重要挑战。为解决这一难题,研究者开始探索新的治疗策略,如采用生长因子、基因治疗、干细胞移植及智能生物材料等。类器官是当前生物医药及组织工程研究的前沿领域。相较于采用干细胞移植促进皮肤附属器再生的传统方法,类器官技术在构建汗腺原基初级形态及基本功能的基础上,更加准确地模拟了胚胎时期汗腺的起始、延伸、发育及成熟过程。如Klaka等[13]采用悬滴培养法在体外构建类汗腺三维立体模型,高度模拟了汗液分泌的生理学过程;Liu等[14]借助3D打印仿生技术构建具有自组装功能的类汗腺组织,模拟汗腺的自然发育进程;Diao等[15]将分离获得的汗腺细胞与Matrigel进行混合培养,构建汗腺类器官,并成功实现了体内汗腺的修复与再生。但是此类方法均为采用汗腺组织细胞来构筑类器官,而大面积烧创伤患者的汗腺细胞获取困难,移植后不易存活,不利于开展大规模的临床应用。相比之下,表皮细胞来源广泛,容易获得,且与汗腺同属外胚层来源。因此,利用表皮细胞再生汗腺大大降低了跨谱系的难度,同时解决了种子细胞获取困难的问题。本研究以HaCaT细胞作为种子修复细胞,采用CRISPR/dCas9技术上调内源性EDA的表达,诱导其跨谱系重编程为汗腺样细胞,随后采用Matrigel作为主体支架与重编程而来的汗腺样细胞进行混合培养,在体外构建汗腺类器官。该汗腺类器官构建技术克服了传统二维平面培养的局限性,最大程度模拟了体内三维空间环境中细胞-细胞间、细胞-细胞外基质间的相互作用,为在三维立体空间内模拟汗腺的生理微环境,研究汗腺的发育、再生、疾病建模提供了基础。
此外,本研究在移植实验中发现,GFP阳性细胞在表皮层及其下方的真皮、皮下组织内均有分布。真皮及皮下组织内分布的GFP阳性细胞形成管腺状结构,并且表达汗腺相关蛋白(如CK18、α-SMA等),表明汗腺类器官不但参与了创面的再上皮化,还能促进汗腺组织学结构的修复与再生。同时碘-淀粉实验结果进一步提示,汗腺类器官移植能够促进创面的功能性修复,再生的汗腺具有发汗功能。因此,利用谱系重编程结合类器官三维培养技术构建工程化的汗腺类器官具有可行性,为实现汗腺再生、解决皮肤的功能性修复问题提供了新的思路。
本研究虽然实现了裸鼠体内汗腺再生,但该体系能否稳定地保持遗传学特性,汗腺功能能否长期高标准的维持仍需进一步研究。此外,进一步优化体外培养环境,使用组织工程皮肤等仿生程度更高的生物材料替代Matrigel进行汗腺类器官培养,是今后值得探讨的问题。
