液质饲料喂养制备酒精性心肌病小鼠模型
2020-06-24刘立会
廉 虹,刘立会,聂 宇
(中国医学科学院,北京协和医学院,国家心血管病中心,阜外医院,心血管疾病国家重点实验室,北京 100037)
酒精性心肌病是一类由于长期过量饮酒导致的心肌病,是临床上常见的引起心力衰竭的原因,主要特征表现为左心室质量增加、心室扩张、室壁变薄和心室功能不全或伴有不同类型的心律失常[1]。 其具有发病率高,预后差的特点,早期不易发现,容易被误诊,晚期易出现心力衰竭,有些患者最终走向必须进行心脏移植的地步[2-3]。 随着社会经济的高速发展,人民生活水平不断提高,饮酒已不再是一种奢侈行为,导致酒精性心肌病发病率逐年上升。
酒精性心肌病临床表现类似扩张型心肌病,并且目前尚无特异性的组织病理、生化标志物作为病理学方面判断酒精性心肌病的依据,所以区分酒精性心肌病和扩张型心肌病,一直是临床上的难题[4-6]。 目前而言,酒精性心肌病的诊断只能通过患者的过量长期的饮酒史将其从扩张型心肌病中区分出来[7]。 虽然这两种心肌病的临床表型非常相似,但是造成同样结局的机制理论上来说是完全不同:扩张型心肌病主要的原因是遗传导致的[8-9],而酒精性心肌病发病原因很显然不属于经典遗传学范畴。 因此,用于研究扩张型心肌病机制的动物模型,虽然与酒精性心肌病具有相同的表型特征,但是不能用于酒精性心肌病的病理机制研究的。所以,为了揭示酒精性心肌病的发病机制以及得到更好的预后和治疗方法,构建良好的酒精性心肌病模型是十分必要的。
本研究通过添加了乙醇的成分明确、能量平衡的液体饲料长期喂食,成功构建了酒精性心肌病小鼠模型,为酒精性心肌病的机制研究提供了良好动物模型。
1 材料和方法
1.1 实验动物
8 周龄SPF 级别C57BL/6 小鼠30 只购买于维通利华实验技术有限公司[SCXK(京)2016-0011],全部为雄鼠,饲养至16 周(体重27~32 g)进行液体饲料喂养。 小鼠饲养于中国医学科学院阜外医院心血管疾病国家重点实验室小动物平台屏障环境动物房[SYXK(京)2017-0015],饲养间温度(23±2)℃,12 h/12 h 明暗交替照明。 动物实验中涉及的动物所有操作程序符合3R 原则,已经得到中国医学科学院阜外医院实验动物管理和使用委员会的批准,批准号:FW-2017-0004。
1.2 主要试剂与仪器
液体饲料成分(Lieber-DeCarli)购自创亚化工(上海)有限公司,产自德国Bio Serv 公司(货号:F1697SP);麦芽糖糊精(货号:3585),液体饲料喂养瓶(货号:9019),喂养瓶固定器(货号:9015),95%乙醇购于北京化工厂;4% 多聚甲醛溶液购于北京益利精细化学品有限公司;小鼠心脏超声仪(Vevo 2100);组织脱水机、石蜡包埋机、石蜡切片机购自德国Leica 公司;图像拍摄显微镜(Leica TCS NT)。
1.3 实验方法
1.3.1 液体饲料的配制
由于饲料配制过程中涉及到一些重要的细节问题,所以以制备1 L 饲料(乙醇浓度4.8%)为例描述流体饲料的配制,配制过程如下:(1)称量130 g 的饲料粉和5 g 麦芽糖糊精;(2)将三分之一称量好的固体粉末倒入一个2.5 L 的玻璃瓶中,加入890 mL 温热的自来水(非蒸馏水),剧烈振摇后,磁力搅拌器搅拌5 min;(3)待溶解均匀后,再加入三分之一固体粉末,继续搅拌约5 min;(4)重复步骤(3),直至全部固体粉末溶解均匀,加入63.6 mL 的95%乙醇,充分混合后待喂食。 同理配制对照饲料,由于不添加乙醇,所以缺失的能量用麦芽糖糊精补充,以平衡乙醇组中乙醇的卡路里。 固体粉末溶解过程同前所述,切记不可将固体粉末一次性全部溶解,由于固体饲料粘度很高,一次性倒入很难溶解。制备好的饲料应该冰箱保存,宜在3 d 内使用,防止饲料变质。
液体饲料喂养瓶添加饲料方法:用拇指堵住喂养孔,从上方填充液体饲料30 mL,并旋紧螺帽。 颠倒喂养管排除滞留的气泡,将其放置在鼠笼的喂养管固定器上(图1A)。 由于液体饲料极易变质,需要每天进行饲料更换和饲养瓶的清洗、高压,所以饲养瓶最好准备两套,可轮换使用。
1.3.2 小鼠模型的建立
本研究采用乙醇量逐步增加的方式进行酒精性心肌病模型的构建[10]。 16 周龄的雄性小鼠每笼三只,其中对照组(WT 组)9 只,乙醇组(WT+Alc组)21 只,进行乙醇饲料或等热量麦芽糖糊精对照饲料喂养(表1),共喂养8 周,每两周升高一次乙醇含量(%,w/v),具体为:第1、2 周是4.8%,第3、4周是5.0%,第5、6 周是5.2%,第7、8 周升高至5.4%(图1B)。 每三天配制一次液体饲料,冰箱冷藏,每天进行饲料的添加,添加量与前1 d 小鼠的食量相当。 每周进行一次体重的测量,同时记录饲养过程中死亡小鼠个数。 喂养8 周后,对小鼠进行超声心动图检测,检测结束进行安乐死后,取心脏组织进行组织病理学检测(图1B)。
1.3.3 心脏超声检查
流体饲料喂养8 周后,采用异氟烷气体麻醉的方式进行小鼠麻醉,脱去心前区的被毛,利用小动物心脏超声仪(探头型号:550)。 记录左心室前壁厚度(left ventricular anterior wall,LVAW)、左心室后壁厚度(left ventricular posterior wall,LVPW)、左心室内径(left ventricular internal diameter at endsystole,LVID)等参数,射血分数(percent ejection fraction,EF%), 短轴缩短率( percent fractional shortening,FS%)由计算得出。
1.3.4 小鼠心脏组织标本的获取和HE 染色
液体饲料喂养8 周后,行颈椎脱臼法进行安乐死,采用眼科剪打开胸腔,摘取心脏。 PBS 冲洗后用擦手纸吸拭心脏表面液体,称重后立即浸入4%多聚甲醛液体中进行固定,将固定管置于摇床上进行摇晃,使固定液充分浸入组织,固定48 h 后,流水冲洗30 min,组织进行脱水、石蜡包埋。 利用切片机将包埋好的蜡块按纵切面切片,厚度4 μm,展台展开后用病理片捞起,常温晾干备用。
备用的切片68℃烘烤45 min 后,梯度乙醇脱蜡后,水冲洗1 min,苏木精染液染色5 min 后水冲1 min,1% 盐酸乙醇分化2 s,自来水冲洗泛蓝,0.5%的伊红染液浸入2 min,水冲洗后放置70%乙醇中,然后梯度乙醇脱水,树脂封片,晾干后镜下观察,Leica 显微镜拍摄图片。
1.4 统计学方法
实验数据使用SPSS 统计软件进行分析。 先进行数据的方差齐性检验,数据用平均数±标准差(±s)表示,组间比较采用student’t 检验,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 体重和生存率分析
在液体饲料喂养的8 周过程中,每天进行液体饲料的更换,3 d 配制一次饲料,每周进行一次体重的测量,同时记录小鼠的死亡情况。 对照组(WT,n=9)和乙醇喂养组(WT+Alc,n=21)两组小鼠,液体饲料喂养8 周后,两组小鼠体重均有增长,WT 组小鼠体重增长17.3%,WT+Alc 组增加8.2%,WT 组较WT+Alc 组增长明显。 在接受液体饲料喂养前,WT组和WT+Alc 组体重无显著差异(WT:(31.3±1.0);WT+Alc:(30.5 ± 2.1),P=0.347),喂养一周后,WT+Alc 组小鼠较WT 组体重开始降低,并且差异具有显著学差异(WT:(31.6 ±1.2);WT+Alc:(29.9 ±1.2),P=0.048),直至第八周,WT+Alc 组小鼠体重较对照组降低9.8%(WT:(36.7 ±2.5);WT+Alc:(33±2.6),P=0.003)(图2A)。 在喂养过程中,WT 组小鼠未出现死亡现象,生存率100%;WT+Alc 组小鼠在不同的时间点出现死亡现象,共死亡7 只,生存率66.7%(图2B)。

表1 不同浓度酒精饲料和对照饲料的配方Table 1 ingredients of different concentrations of alcohol feed and control feed
2.2 模型小鼠心脏整体结构和功能分析
流体饲料喂养8 周后,对两组小鼠进行心脏超声检测发现,无论在舒张期还是收缩期,左心室前后壁厚度以及左心室腔内径均有显著差异,并且心脏功能也出现明显差异。 WT+Alc 组小鼠较WT 组变化差异具体描述如下:舒张期左室前壁厚度(LVAW;d)减少13.40 %(WT 组:(0.97± 0.11)mm,WT+Alc 组:(0.84± 0.11) mm;P=0.025),收缩期左室前壁厚度(LVAW; s)减少10.94 %(WT组:(1.28 ± 0.13) mm,WT+Alc 组:(1.14 ± 0.16)mm;P = 0.026)(图2A);舒张期左室后壁厚度(LVPW;d)减少20.88 %(WT 组:(0.91±0.18)mm,WT+Alc 组:(0.72 ± 0.08)mm;P=0.004),收缩期左室后壁厚度(LVPW; s)减少14.00%(WT组:(1.00 ± 0.12) mm,WT+Alc 组:(0.86 ± 0.08)mm;P=0.003)(图3B);舒张期左室内径(LVID;d)增加11.83%(WT 组:(3.72±0.29) mm,WT+Alc组:(4.16 ± 0.39) mm;P=0.011),收缩期左室内径(LVID; s)增加19.17%(WT 组:(2.66 ± 0.33)mm,WT+Alc 组:(3.17 ± 0.49) mm;P=0.011)(图3C);射血分数(EF%)增加18.47%(WT 组:(59.06± 6.65)%,WT+Alc 组:(48.15 ± 9.40)%;P =0.029),短轴缩短率(Fs%)增加16.49%(WT 组:(28.87 ± 4.32) %,WT+Alc 组:(24.11 ± 5.54)%;P=0.028)(图3D)。 综上所述,WT+Alc 组小鼠较WT 组心室前后壁厚度均有显著减少,左室腔内径显著增大,射血分数和短轴缩短率降低,出现明显的心脏功能降低的表型。

图1 酒精性心肌病小鼠模型构建方法Note. A, the fluid feed bottle and how to set up the bottle rack. B, the control group mice were given control feed for eight weeks. The alcoholic group (Alc group) mice were fed with liquid feed containing different high-concentrations of alcohol every two weeks, and the alcohol concentration was changed from 4.8%-5.4%.Figure 1 Establishing a mouse model of alcoholic cardiomyopathy
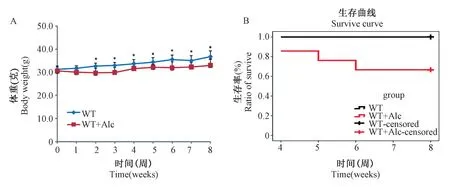
图2 酒精性心肌病模型体重和生存情况监测Note. A, mouse weight monitoring,*P <0.05. B, survival curve. WT, wild type control mice, n=9. WT-Alc, wild type mice were fed with alcohol feed, n=21.Figure 2 The body weights and survival of alcoholic cardiomyopathy model mice were monitored
2.3 模型小鼠呈现典型的扩张型心肌病病理表型
流食喂养8 周后,将两组小鼠心脏进行取材,称量心脏湿重,为了减少重量误差,所有小鼠取材过程保持基本一致。 本研究发现WT+Alc 组小鼠心重/体重指数较WT 组升高了12.20% (WT 组:(4.12±0.28) mg/g;WT+Alc 组:(4.57±0.48) mg/g;P=0.035)(图4A)。 同时心脏M 型超声截图和整个心脏组织H&E 染色结果均显示,WT+Alc 组小鼠的心脏组织确实较WT 组显著增大,并且左室心腔增大明显,超声结果左室壁厚度明显降低以及心脏功能降低(图4D、C)。 因此,WT+Alc 组小鼠的心脏表现出了典型的心腔变大、室壁变薄、心脏功能下降的酒精性心肌病的临床表型。 上述结果充分表明,利用流食添加乙醇喂养方法可以成功构建酒精性心肌病小鼠模型,为酒精性心肌病机制的研究提供良好的动物模型。
3 讨论
酒精性心肌病临床表型与扩张型心肌病极其相似,均以心室扩张、心肌功能降低为主要表现,但是发病机制截然不同。 所以对于表型相同,但是发病机制不同的疾病,动物模型需要有针对性的应用。 由于酒精性心肌病主要由饮酒导致,因此本研究基于饮酒这一特征,进行了酒精性心肌病模型的构建。 本研究利用添加了乙醇的成分明确、能量平衡的Lieber-DeCarli 流质饲料进行长期的喂养,成功构建了典型的心室扩张、室壁变薄和心室功能不全的酒精性心肌病小鼠模型。
目前, 酒精性心肌病模型主要以小鼠为主[10-12],也有利用犬等大动物制备模型的,但使用较少[13]。 由于小鼠的体型较小、繁殖能力强以及成熟的基因工程操作手段等原因,小鼠是使用最广泛的模型之一。 关于酒精性心肌病模型,目前认为C57BL/6 品系是最好的制备模型小鼠品系,其它品系如BALB/6 和DBA 要么不食用含有乙醇的饲料,要么会出现大量的死亡现象[14]。
酒精性心肌病小鼠模型制备方法主要分为乙醇灌胃法[15-18]、乙醇饮水法和液质饲料喂养法[10-12]三种。 其中乙醇灌胃法是指将一定溶度的乙醇通过灌胃的方法直接注射到小鼠胃里面,由于模型制作一般需要较长的时间,长时间的灌胃对小鼠的咽、食道会造成反复的创伤,操作不当还可能引起乙醇进入气管,死亡率高,还有的操作人员为了快速造模成功,短期内大剂量给予乙醇灌胃,引起急性肝损伤或者急性胃扩张,并且与临床上酒精性心肌病慢性发展过程不相符;乙醇饮水法,是指经乙醇加入到小鼠的日常饮水中进行酒精性心肌病造模的方法。 这种方法操作简单,但是效果较差。 由于小鼠的个体差异,每只小鼠的饮水量不同,所以会造成较大差异,其次乙醇在饮水瓶中经过几天的挥发,浓度也很难精准控制,因此,此方法的缺陷相对较大,造模成功率也不高,目前采用此方法造模的文献相对较少;
第三种方法是液质饲料喂养法,这种方法是利用液体饲料喂养的方式进行模型的制备。 其中液体饲料是通过蛋白质、脂肪、维生素以及矿物质等等按相应比例配制成粉末溶解而成的成分清楚、营养均衡的液体饲料,并且由于对照组较乙醇喂食组缺少了高能量的乙醇,利用麦芽糖糊精补充到对照组的饲料中,达到了饲料能量的均衡,使误差减少到最低。 此种饲料尽可能控制了所有会造成营养和能量误差的一种饲料,保证了实验的科学性,因此,这种方法也是目前国际上最流行一种制备酒精性心肌病模型的方法。 尽管液质饲料制备酒精性心肌病模型已经被普遍接受,但是乙醇浓度和造模周期并未统一,乙醇浓度从4%到10%,甚至有研究利用20%乙醇浓度进行短暂喂养,喂养过程中有的研究利用统一的喂养浓度,有的研究则采取了设置乙醇浓度梯度的喂养方式;由于乙醇浓度和喂养方式的不同,喂养周期也相差很大,总体来看最短的喂养时间是8 周,而最长周期达到16 周龄[10,19-23]。本文利用了一种产自德国的Bio Serv 公司的一种营养成分均衡、明确且精准实现乙醇组和对照组之间能量平衡的目前国际广泛应用的液质饲料Lieber-DeCarli[12],进行了为期8 周的小鼠喂养,并且乙醇浓度采取了梯度递增(4.8%~5.4%)的喂养方式,最终成功得到了具有心腔变大、室壁变薄、心脏功能降低的典型的酒精性心肌病表型特征的小鼠。

图3 8 周后心脏超声评价酒精性心肌病模型小鼠心脏结构和功能Note. A, Comparison of the left ventricular anterior wall thickness of the two groups of mice in the WT and WT+Alc groups. LVAW. d, the left ventricular anterior wall thickness during diastole. LVAW. s, the left ventricular anterior wall thickness during systole. B, Comparison of the left ventricular posterior wall thickness of the two groups. LVPW, d, diastolic left ventricular posterior wall thickness. LVPW. s, systolic left ventricular posterior wall thickness. C, Comparison of left ventricular diameter. LVID. d, left ventricle diameter during diastole. LVID; s, left ventricle diameter during systole. D, The cardiac ejection fraction and short-axis shortening rate were compared between the WT and WT+Alc groups. EF, ejection fraction, FS, fractional shorting, WT, wild mice fed a control diet, WT +Alc, wild mice fed an alcohol diet.Figure 3 Echocardiographic evaluation of cardiac structure and function after 8 weeks

图4 酒精性心肌病小鼠模型呈现典型的扩张型心肌病表型Note.A, the ratio of heart weight to body weight. WT group, n=9, WT+Alc group,n=14. B, the M-ultrasound image of the left ventricular short-axis from WT and WT+Alc groups. C, HE staining of longitudinal sections of the whole heart of mice in the WT and WT+Alc groups.Figure 4 A mouse model of alcoholic cardiomyopathy showing a typical dilated cardiomyopathy phenotype
尽管本研究成功构建了酒精性心肌病模型,但是在模型的制备过程中,本研究也发现了问题以及总结了经验。 喂养过程中出现了小鼠体重下降的现象,虽然下降的绝对值不是很多,但是体重下降是具有统计学意义的,这一现象在前人的研究中也有发现[21]。 体重下降可能由于小鼠对液质饲料适应不足,为了克服体重下降,本文认为可以给予每周一次的正常固体饲料,不仅在体重降低方面起到一定的缓解作用,而且也可能降低模型组小鼠的死亡率,这一方法将在今后的模型制备过程中加以应用,期待获得更好的效果。 另外,在模型的制备过程中,有些研究为了便于控制小鼠每天的饮食量[12-19],进行两只一笼的饲养方式,但是我们的预实验中发现模型组存在一定的死亡率,出现死亡的饲养笼里面就会发生单只一笼的情况,独笼饲养违背啮齿类动物的生活习性以及实验动物伦理,因此在本研究中分组时采用了三只一笼的方法,这样基本上不会出现单只饲养的情况,同时液体饲养瓶一次性所装饲料也能够满足三只小鼠的一天所需的食量。
综上,本研究应用目前国际上广泛认可的流质饲料进行慢性乙醇喂养,制备了表型良好的酒精性心肌病小鼠模型,为酒精性心肌病机制的研究提供了有力的工具。
