肝癌经皮射频消融治疗后完全消融率的影响因素研究
2020-06-24刘丛丛施宝民
刘丛丛,施宝民
1.同济大学附属同济医院超声诊断科,上海 200065;2.同济大学附属同济医院普外科,上海 200065
原发性肝癌是我国第四位的常见恶性肿瘤和第三位的肿瘤致死病因,严重威胁着国民的生命健康[1-2]。而肝脏因为同时具有肝动脉和门静脉双重血供,又是恶性肿瘤远处转移的好发部位。目前外科手术是肝癌首选的治疗手段,然而许多肝癌患者因同时合并有肝硬化或确诊时已为中晚期,能获得手术切除机会的患者仅占20%~30%[3]。近年来,射频消融(Radiofrequency ablation,RFA)技术作为一种局部消融治疗手段被广泛应用于临床,使得一些不能或不宜手术治疗的肝癌患者也可以获得治疗的机会[4]。消融的路径包括经皮、腹腔镜、开腹3 种方式,其中超声引导下经皮射频消融(percutaneous radiofrequency ablation,PRFA)治疗损伤小,操作方便,疗效较好,术后患者恢复良好[5-6]。且随着技术的不断改进,PRFA 治疗肝癌的成功率也逐渐提高,其临床应用更加方便安全,消融范围更大,效果更确切。但即使如此,临床上仍有很多PRFA 治疗后消融不完全而术后复发的案例存在。肝癌是否达到完全消融(complete response,CR)是影响PRFA 疗效及术后患者生存率的重要因素[7]。本研究以同济大学附属同济医院接受超声引导下PRFA 治疗的肝癌患者为研究对象,对可能影响术后CR 率的因素进行分析和探讨,希望能给临床PRFA 术前及术中评估提供更有价值的依据,从而进一步提高PRFA治疗肝癌的疗效。
1 资料与方法
1.1 研究对象
选择2014年6月—2018年9月于同济大学附属同济医院接受超声引导下PRFA 治疗的肝癌患者60例,其中男36例,女24例,年龄36~78岁,平均(59.0±14.6)岁。治疗前均经过病理穿刺活检、2种及以上的影像学检查等综合确诊,其中原发性肝癌共32例,转移性肝癌共28例。纳入标准:(1)患者全身情况功能状态评分(ECOG)0~2 分;(2)治疗前肝功能分级(Child-Pugh 分级)为A 级或B 级;(3)患者肝脏未接受过手术或介入治疗。排除标准:(1)肝癌已侵犯周围空腔脏器或已经远处转移者;(2)合并严重的心脑血管疾病、糖尿病及甲状腺功能亢进等疾病者;(3)有不可纠正的凝血功能障碍者。
1.2 仪器与方法
1.2.1 超声造影
采用Esaote MyLab Twice 彩色超声诊断仪,造影剂采用Bracco 公司的SonoVue,造影微泡为六氟化硫(SF6)。嘱患者仰卧位,先用二维超声观察肝内肿块的数目、大小、位置及肿瘤内部回声特征,并用彩色多普勒观察肿瘤内血供。然后行超声造影(contrast-enhanced ultrasound,CEUS)检查,启动CnTI,静脉注射超声造影剂后实时观察并记录重点位置的灌注情况,观察动脉期、门静脉期和实质期病灶内回声强度改变,实时连续观察超过6 min。观察同一切面时,可在相邻切面小幅度移动探头行扇形扫查来观察近处是否有病变。CEUS 结束后将影像进行回放,由2 位有经验的超声医师进行分析并最终作出超声诊断。
1.2.2 经皮射频消融治疗
(1)治疗装置:使用Radiotherapeutics 公司制造的RF2000 型射频治疗系统,频率500 kHz,最大功率为100 W。配以15G 的LeVeen 针式电极,长15 cm,内有10 根伞状电极,最大展开直径为3.5 cm。消融范围呈球状,最大消融直径为5 cm。治疗时间、能量及电极间阻抗等数据由计算机自动控制并记录。(2)治疗方法:术前超声造影明确的肿瘤消融范围,确定穿刺肿瘤的位置和深度,静脉注射镇痛剂及麻醉后在超声引导下选择最佳的进针路径。对于直径≤3.5 cm的肿瘤,可将电极针插入肿瘤中心部位的深面,一针完成消融治疗;对于直径>3.5 cm的肿瘤,右肝占位以肋间隙为分层标志,左肝以一定的层间距,均从边缘起,将肿瘤分层“切割”治疗。层内用放射状穿刺或多点穿刺,由深部开始治疗,渐向浅部退针,治疗点间距、针道间距及层间距均不超过3 cm。治疗时起始功率为10 W,每分钟上升10 W,最高至90 W,中心治疗温度为90~110 ℃。持续治疗后肿瘤组织发生凝固性坏死,阻抗迅速增高,计算机自动控制功率降低,阻抗最高时功率降至最低,即完成一次治疗。
1.2.3 PRFA术中满意效果的评估
治疗中,采用超声实时监测治疗区域组织的回声变化,完全凝固性坏死的肿瘤组织在超声上显示为极强回声,以强回声团作为消融范围的估计指征,记录强回声区对肿瘤的覆盖程度,使消融范围尽可能覆盖肿瘤周围0.5~1.0 cm的非瘤肝组织。通过计算机监测消融能量及中心治疗温度,对术中消融效果不满意者,操作者可根据超声下消融灶及患者耐受等情况,采取如延长每个消融点的消融时间、增加消融点的数量等方法来达到满意的消融效果。如术中超声造影检查发现残留病灶则再次消融。术中要密切观察患者的情况,超声下观察是否出现癌灶出血、内脏出血、血气胸等并发症,见图1。

图1 术中病灶的超声表现A.Fully coagulated necrotic tumor tissue shows strong echo on ultrasound,B.CEUS check for residual tumor tissue.Fig.1 Ultrasound image during PRFA
1.3 疗效评价
患者治疗后1个月回院复查CEUS,观察肿瘤局部消融情况。若病灶动脉期、门静脉期及实质期均无灌注并且动脉期无增强,判断为达到CR。若病灶内局部动脉期有强化,即有肿瘤残留,判断为不完全消融(incomplete response,ICR)。将所有最终达到CR的患者定义为CR组,其余患者定义为ICR组,见图2。

图2 术后1个月病灶的超声表现Fig.2 Ultrasound image one month after PRFA
1.4 统计学方法
应用SPSS 19.0 统计软件进行分析。计数资料以率(%)表示,组间比较用卡方检验,不满足卡方比较条件的采用Fisher精确概率法比较。采用多因素logistic 回归方法分析PRFA 术后肿瘤CR 率的独立影响因素。P<0.05时认为差异有统计学意义。
2 结果
2.1 术前CEUS情况
肝癌患者60例,术前CEUS 共发现103 个病灶。原发性肝癌患者32例,共发现58 个病灶;转移性肝癌者28例,共发现45个病灶。肿瘤位于肝左叶者16例,共31个病灶;位于肝右叶者44例,共72个病灶。肿瘤位于肝包膜表面、靠近肝门或重要脏器等特殊解剖位置者21例,共29 个病灶;肿瘤不处于特殊解剖位置者39例,共74个病灶。肿瘤单发者37例,共37 个病灶;2~3 个者18例,共42 个病灶;多于3 个者5例,共24个病灶。肿瘤最大直径≤3 cm 者31例,共59 个病灶;最大直径在3~5 cm 者21例,共35 个病灶;最大直径≥5 cm者8例,共9个病灶。
2.2 PRFA术后1个月CEUS情况
60例患者共消融肝内病灶103 个,其中共有94个病灶被评价为CR,CR 率为91.26%;共有9个病灶被评价为ICR,ICR 率为8.74%。原发性肝癌患者完全消融56个病灶,CR率为96.55%;转移性肝癌患者完全消融38 个病灶,CR 率为84.44%。肝左叶完全消融病灶28 个,肝右叶完全消融病灶66 个,CR 率分别为90.32%和91.66%。位于肝内特殊解剖位置的肿瘤,共完全消融病灶23 个,CR 率为79.31%;不处于肝内特殊解剖位置的肿瘤,共完全消融71 个,CR率为95.94%。单发肿瘤完全消融病灶34个,2~3个肿瘤者完全消融病灶38 个,多于3 个肿瘤者完全消 融 病灶22 个;CR 率 分 别为91.89%、90.47%、91.66%。肿瘤最大直径≤3cm 者完全消融57 个病灶,CR 率为96.61%;最大直径在3~5 cm 者完全消融31 个病灶,CR 率为88.57%;最大直径≥5 cm 者完全消融6 个病灶,CR 率为66.67%。80 个病灶使用单针治疗,完全消融73 个,CR 率为91.25%;23 个病灶使用多针治疗,完全消融21个,CR率为91.30%。治疗过程中,消融范围未超过病灶边缘5 mm 者9 个,完全消融4 个,CR 率为44.44%;消融范围超过病灶边缘5~10 mm 者72 个,完全消融68 个,CR 率为94.44%;消融范围超过病灶边缘10 mm 者22 个,完全消融22 个,CR 率为100%。治疗中,消融能量达目标量者88 个病灶,完全消融83 个,CR 率为94.31%;消融能量未达目标值者15 个病灶,完全消融11 个,CR 率为73.33%。中心治疗温度<90 ℃者14 个,完全消融10 个,CR 率为71.43%;中心治疗温度≥90 ℃者89个,完全消融84个,CR率为94.38%。
2.3 PRFA术后肿瘤CR率的单因素分析
将肿瘤类型、肿瘤位置、肿瘤是否位于特殊解剖位置、肿瘤数量、肿瘤最大直径、消融针数量、消融范围、消融能量和中心治疗温度等进行单因素分析,结果显示肿瘤类型、肿瘤是否位于特殊解剖位置、肿瘤最大直径、消融范围、消融能量和中心治疗温度与肿瘤的CR 率明显相关,差异具有统计学意义(P<0.05)。肿瘤位置、肿瘤数量、消融针数量与肿瘤的CR 率无明显相关,差异不具有统计学意义(P>0.05),见表1。
2.4 PRFA术后肿瘤CR率的logistic多因素分析
对单因素分析存在统计学意义的因素进行进一步的logistic 多因素分析。结果显示:肿瘤类型(P=0.024)、肿瘤是否位于特殊解剖位置(P=0.031)、肿瘤最大直径(P=0.001)、消融范围(P<0.001)、消融能量(P=0.003)和中心治疗温度(P=0.009)是影响PRFA术后肿瘤CR率的独立影响因素,见表2。
3 讨论
近年来,超声引导下PRFA 因其损伤小、操作方便、疗效精准等优点,在原发性肝癌和转移性肝癌的治疗中被越来越多地应用,成为治疗无手术适应证肝癌患者的重要手段。PRFA 的目标是完全消融病灶内的癌组织与周围部分正常肝组织,尽可能杀死全部的癌细胞。但有很多患者由于多种原因术后不能达到CR,仍有癌组织残留,从而导致肝癌的局部复发等不良后果[8-9]。因此,明确会对PRFA 术后消融效果产生影响的因素,有助于临床通过选择与制定PRFA 治疗方案与术中操作来提高PRFA 术后CR率,对防止术后肝癌复发至关重要。
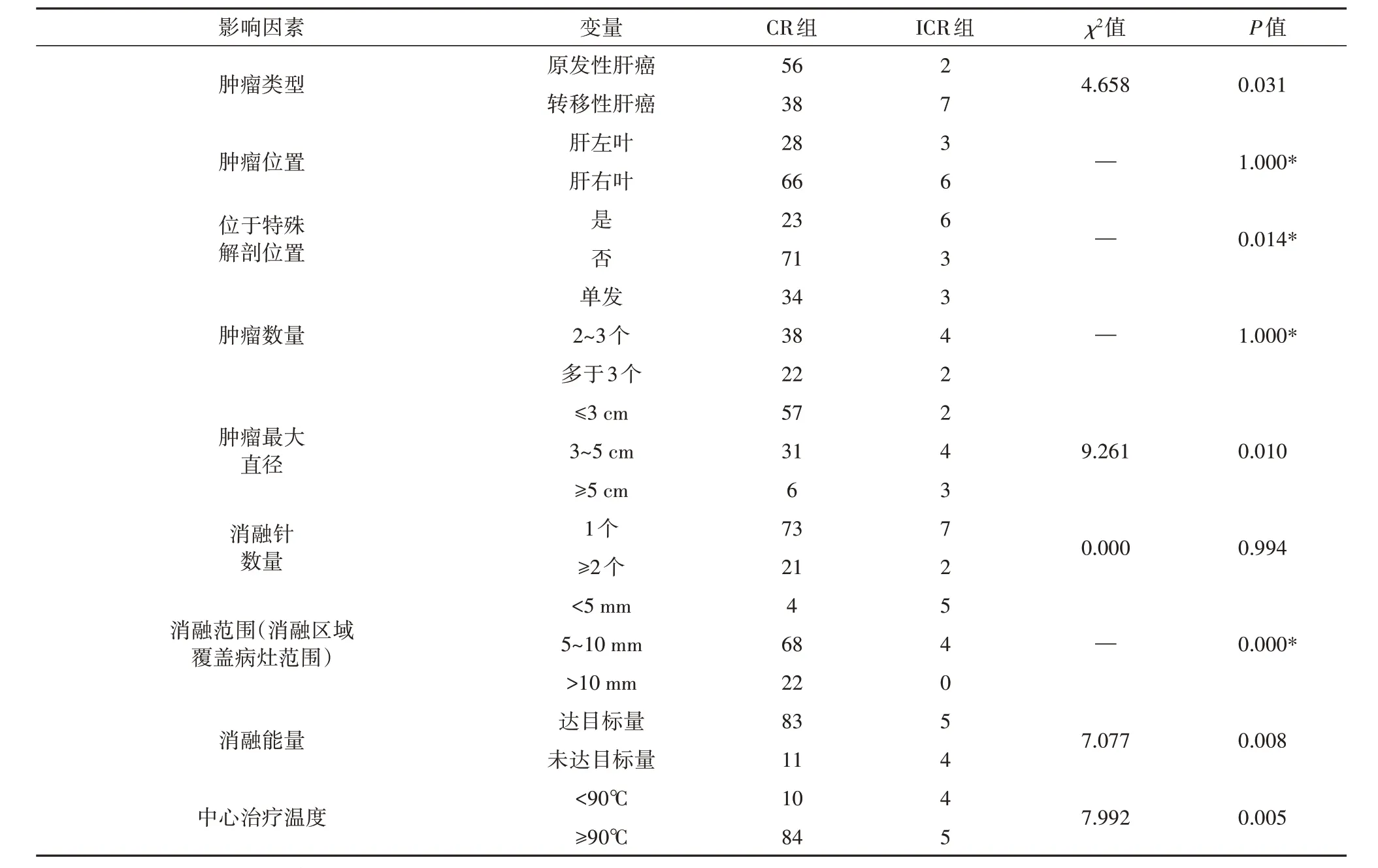
表1 PRFA术后肿瘤CR率的单因素分析Tab.1 Single factor analysis of tumor CR rate after PRFA
本研究通过对肝癌患者PRFA 术后肿瘤消融情况的CR 组和ICR 组进行比较发现:肿瘤类型、肿瘤是否位于特殊解剖位置、肿瘤最大直径、消融范围、消融能量、中心治疗温度与肝癌的CR 率明显相关,差异具有统计学意义。进一步的logistic 多因素分析显示,肿瘤类型、肿瘤是否位于特殊解剖位置、肿瘤最大直径、消融范围、消融能量和中心治疗温度是PRFA 术后肝癌CR 率的独立影响因素。不同的肿瘤类型会引起术后CR 率的差异。术后CEUS 结果显示,原发性肝癌的CR 率高达96.55%,明显高于转移性肝癌。这主要是由于原发性肝癌多有包膜,且常伴有肝硬化,因此PRFA 治疗时易产生“烤箱效应”,提高治疗效果。而转移性肝癌无包膜且边界不清,因此PRFA 疗效较差。但即使是同种肝癌,CR 率又会由于肿瘤是否位于特殊解剖位置以及肿瘤大小的差异而有明显不同。一些研究[10-11]认为,肿瘤位置与PRFA 术后疗效密切相关,尤其是邻近大血管及重要器官等特殊解剖位置。位于特殊解剖位置的肿瘤会增加PRFA 手术的困难程度并可能增加发生术后并发症的风险,本研究CEUS 的结果也显示这些位置的肿瘤CR 率明显低于位于普通肝实质内的肿瘤。而就肿瘤大小而言,目前已有相应的临床规范分别对不同大小的肝癌进行治疗手段的推荐。对于直径<3 cm 的小肝癌,PRFA 疗效确切,是临床的一线治疗手段[12]。而直径>3 cm 甚至>5 cm 的肿瘤,由于消融范围的限制并且肿瘤内血流会带走部分热量,使得局部温度不能达到目标温度,从而不能被完全消融[13-14]。

表2 PRFA术后肿瘤CR率的logistic多因素分析Tab.2 Multiple logistic analysis of tumor CR rate after PRFA
PRFA 的术中评估是影响肝癌完全消融率的重要因素。为了确保肝癌病灶周边的肿瘤细胞也能被完全清除,临床要求消融范围需要覆盖肿瘤及其周边5~10 mm 的非瘤肝组织。而Ke 等[15]的研究提出,对于直径3~5 cm 的肝癌,射频消融范围覆盖肿瘤边界>10 mm可有效减少局部肿瘤进展率,术中精准评估消融范围对于指导治疗,提高肿瘤完全消融率具有重要临床意义。本研究使用的射频消融系统为功率控制模式,即通过检测电回路的阻抗变化来判断何时结束消融过程。如果功率输出过快,电极针周围组织过早发生脱水炭化,能量输出便会受到限制,无法达到消融能量的目标值。此时即便阻抗上升,但消融病灶的范围却很小,很难达到完全消融病灶的目的。PRFA 的作用机制是通过电极针周围离子的震荡产热而使肿瘤组织发生热凝固性坏死,毫无疑问温度是肿瘤消融率的重要影响因素。但由于肝脏的血液循环状态、肿瘤的组织特性、肿瘤与周围血管的位置关系等,均能影响散热能力,使得消融中心区与边缘存在一定的温度差。因此,为了确保消融区全体的温度均能有效灭活肿瘤组织,中心治疗温度应至少维持90 ℃左右。
本研究仍有一定的不足:一是本研究使用的射频消融系统是功率控制模式,无法避免升温速度的快慢对于消融效果的影响;二是没有对肿瘤的不同回声及血供方面因素进行分析;三是没有对不同原发灶来源的转移性肝癌进行细致分析。进一步的研究希望可以探究以上因素在影响PRFA 术后疗效方面的差异。
综上所述,肿瘤类型、肿瘤是否位于特殊解剖位置、肿瘤最大直径、消融范围、消融能量和中心治疗温度是肝癌经皮射频消融治疗后的完全消融率的影响因素。临床PRFA 术前评估在选择与制定消融方案时需要考虑这些因素,为术中操作提供更可靠的依据,并配合术中评估,进一步提高肝癌经皮射频消融术后CR率。
