电催化氮气还原合成氨催化材料研究进展
2020-06-22郑沐云万宇驰吕瑞涛
郑沐云,万宇驰,吕瑞涛
(清华大学材料学院,先进材料教育部重点实验室,北京100084)
引 言
氨与人类的生产生活联系密切,在纤维、塑料、染料、化肥、药品等生产过程中有重要而广泛的应用。此外,氨的燃烧产物为氮气和水,本就广泛存在于日常环境中,因此也可以作为清洁能源载体使用。氨的产量和用量十分巨大,2018 年全球共生产约1.7 亿吨氨[1],随着工农业需求的发展还会继续增加。目前,工业合成氨主要采用Haber-Bosch 法,需要 高 温 高 压 条 件(300~500℃,20.265~30.3975 MPa),每年由此带来的能源消耗约占全球能源消耗总量的1.4%[2]。同时,Haber-Bosch 法的原料中需要用到自然界中并不存在的纯氢,其主要是通过化石能源(如天然气)分解制取,这一过程消耗的天然气约占全球天然气消耗总量的3%~5%[3],并伴随着大量CO2副产物的生成,将进一步加剧全球的温室效应[4]。在这一背景下,发展可再生能源驱动的光催化和电催化氮气还原反应(nitrogen reduction reaction, NRR)合成氨工艺成为当前研究的重点之一。
目前光催化和电催化NRR 主要利用水系电解液在温和条件下进行催化N2还原反应合成NH3,原料来源丰富,反应条件温和,使用的能量可以来自太阳能、风能等清洁可持续能源,具有重要的应用前景。但目前光催化NRR 产氨速率还较低[0.1~20 μg NH3·h-1·(mg cat.)-1[5-6]],同时还存在光生电子-空穴对易复合以及太阳能利用率低等挑战性问题[7]。此外,测试过程中大多需要引入牺牲剂,而牺牲剂会与NH3络合影响NH3的定量检测[8]。相比来说,电催化NRR 反应过程易于通过控制反应电位或电流密度等参数调控,反应体系也较光催化更简单。此外,可以通过晶格缺陷调控和表界面设计等策略来调控催化剂的性能。但目前电催化NRR 仍然存在反应速率低、法拉第效率低、稳定性不够高、测试过程干扰较多、测试标准不统一等挑战,需要进一步深入研究。本文将介绍电催化NRR 合成NH3的反应机理、常用研究方法和最新研究进展,并对该领域的发展面临的挑战和机遇进行展望。
1 电催化还原氮气合成氨的反应机理
电催化NRR合成氨的化学反应方程式如下

这一电化学过程在标准条件(25℃、100 kPa)下的标准电极电位为0.092 V[vs 标准氢电极(standard hydrogen electrode,SHE)]。实际反应条件下相对于可逆氢电极(reversible hydrogen electrode,RHE)的反应电位可由能斯特方程计算如下[9]
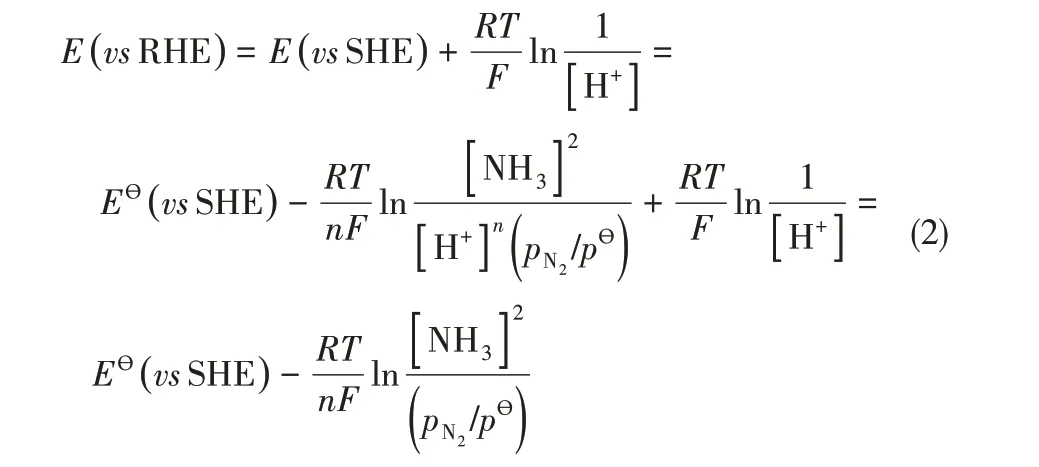
式中,R 为摩尔气体常数,8.314 J·mol-1·K-1;T为反应温度,298.15 K(25℃);n 为NRR 反应中转移电子数(n= 6);pӨ为标准压力100 kPa。假设反应在标准条件(25℃、100 kPa)下进行,反应中N2气压等于标准压力,溶液中NH3浓度为0.1 mg·L-1,可计算得到反应电位为0.23 V(vs RHE)。理论上电催化NRR反应电位相对于RHE 为正,但实际反应中由于需要活化反应物、存在电能损耗等原因,反应电位低于理论电位,即存在过电位。结合现有文献报道,NRR 电催化剂的工作电位一般在-0.1~-0.5 V(vs RHE)之间。
这一过程的实现首先需要氮气分子吸附于催化剂表面,然后通过电解的过程,使氮气分子中的氮氮三键(N N)发生断裂,并使氢原子与氮原子结合,最终生成NH3。电催化NRR合成氨的反应途径主要有三种:解离过程、缔合远端反应过程、缔合交替反应过程,三种反应过程的反应步骤如表1[7]所示。
解离过程中,N2分子吸附后与催化材料表面两个活性位点结合,其N N 键完全断裂,之后两个活化的氮原子分别加氢生成NH3分子;缔合过程中,氮气分子吸附后与催化材料表面一个活性位点结合,N N不完全断裂,其中远端反应过程是指远离催化材料表面活性位点的氮原子先加氢生成一个NH3分子逸出,剩下的氮原子再加氢生成一个NH3分子;交替反应过程是指两个氮原子交替加氢生成两个NH3分子。由此可见,催化材料吸附N2分子和N N 的断裂是电催化NRR 的重要步骤,因此在设计反应所用的电催化材料时应予以重点考虑。
当使用水系电解质进行电催化NRR 合成氨时,由于过程处于还原电位,在催化材料表面往往还存在着竞争反应——析氢反应(hydrogen evolution reaction,HER)

表1 电催化氮气还原反应三种过程的反应步骤[7]Table 1 Steps of three pathways of electrocatalytic nitrogen reduction reaction[7]
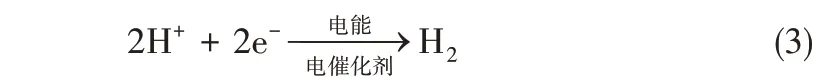
HER 会成为电催化NRR 合成氨的竞争反应[10],使得NRR 反应的法拉第效率降低。因此,电催化剂的选择性也是重要的材料设计指标。
2 电催化还原氮气合成氨的研究方法
2.1 电化学实验装置
电化学实验装置一般由以下部分组成:电解槽、电解质、工作电极、对电极、参比电极、气路管道和电化学工作站。
2.1.1 电解槽 如图1[11]所示,根据电极和电解质的种类及分布差异,电解槽可以分为背对背型、聚合物电解质膜型、H型和单槽型。其中,单槽型和H型电解槽在最近的研究中被广泛应用。单槽型电解槽装置简单,无须加入Nafion膜,减少了实验中的干扰因素,但可能存在NH3产物被氧化的问题;H 型电解槽引入Nafion 膜可有效地防止NH3分子氧化,但会存在Nafion膜的干扰问题,两者各有利弊,可根据研究需要进行选择。
2.1.2 电解质 电解质一般可分为固态电解质、液态电解质和聚合物电解质。在常用的单槽型和H型电解槽中,一般使用液态电解质。液态电解质又可以进一步分为无机电解液和有机电解液。其中,无机电解液由于其成本低廉且配制简便而广泛应用,按照酸碱性可分为:酸性电解液(如稀盐酸、稀硫酸等)、中性电解液(如硫酸锂、硫酸钠、高氯酸锂等)和碱性电解液(如氢氧化钾、氢氧化钠等)。在电催化反应中,电解质是反应进行的重要媒介,其固有性质以及与催化材料的相互作用会影响反应过程,进而影响反应的产氨速率和法拉第效率。电解质的酸碱度对NRR 反应速率和法拉第效率有复杂的影响。对于Pd 等质子(H+)吸附能力强的材料,高H+浓度会大量占用活性位点,抑制N2吸附,降低NRR的选择性,应采用pH 相对较高的中性或者碱性电解液;对于Au 等质子(H+)吸附能力弱的材料,提供N2吸附的位点较多,高H+浓度会促进*N2的加氢过程,提高NRR 性能,应采用酸性电解液[12]。Chen等[13]制备了具有多孔纳米结构的Rh 颗粒作为NRR电催化剂,在-0.2 V(vs RHE)的反应电位下分别于0.1 mol·L-1KOH、0.1 mol·L-1Na2SO4、0.1 mol·L-1HCl三种pH 不同的电解液中进行测试,对应获得了35.58、7.60、16.65 μg NH3·h-1·(mg cat.)-1的产氨速率,和0.52%、7.16%、0.20%的法拉第效率。其中碱性条件下反应速率最高,中性条件下法拉第效率最高,这可归因于碱性条件和中性条件下对HER 竞争反应的抑制作用。电解质中离子的选择也对反应速率和法拉第效率有影响。Hao 等[14]制备了负载于炭黑上的Bi 纳米晶体,在酸性K2SO4溶液中以-0.60 V(vs RHE)的反应电位,获得了高达66%的法拉第效率和5.2×10-2mmol·cm-2·h-1的产氨速率。密度泛函理论(density functional theory, DFT)计算表明,主族金属Bi 表面吸附氮分子并加氢的自由能低于常见的贵金属NRR 催化材料Au,表明Bi 的反应活性更高。同时,当Bi表面吸附了K+离子后这一过程的自由能会进一步降低,表明K+离子可以促进Bi表面的NRR 反应[14]。因此,可通过实验探索对电解质的pH和阳离子种类进行优化,以获得更高的产氨速率和法拉第效率。

图1 电催化氮气还原反应(NRR)装置的四种类型[11]Fig.1 Four different cell configurations for electrocatalytic NRR[11]
2.1.3 工作电极、对电极和参比电极 工作电极是负载催化材料并发生氮气还原反应的电极,施加还原电位。根据电催化材料的状态,以泡沫镍、泡沫铜、碳布等材料作为生长基底的自支撑催化材料可直接作为工作电极,而粉末状催化剂则通常需要涂布或膜压在碳布、碳纸等集流体上构成工作电极。为了获得较高的单位质量催化剂对应的产氨速率,需要有效地暴露催化剂活性位点。目前,工作电极负载的催化剂量还不高(0.1~1 mg·cm-2),使得产氨速率较低,距离实际应用还有很大差距。对电极是发生析氧反应的电极,多采用石墨棒电极或铂片。参比电极为电化学测试提供用于参考的标准电位,一般有Ag/AgCl电极、甘汞电极、可逆氢电极等。
2.2 电化学性能测试
2.2.1 线性扫描伏安法测试 线性扫描伏安法(linear sweep voltammetry,LSV)是通过随时间线性改变电极所加电压获得相应的反应电流的测试方法。通过这一方法,在通入N2和Ar 时分别测试,可以判断NRR 反应是否发生,以及反应进行所需的反应电位区间。如图2[15]所示,相同反应电位下,N2条件下反应的电流密度大于Ar条件下反应的电流密度,说明N2通入后发生了新的反应(即NRR 反应),对应的电位区间即为NRR发生的电位区间。
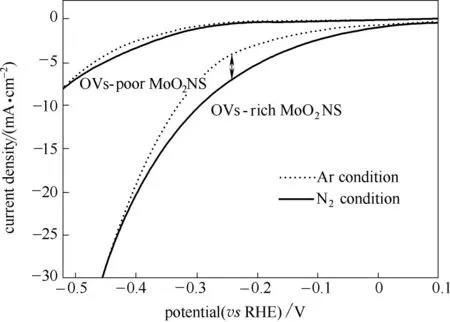
图2 线性扫描伏安(LSV)曲线[15]Fig.2 Linear sweep voltammetry(LSV)curve[15]
2.2.2 计时电流法测试 计时电流法测试指固定反应电位进行一段时间反应,在反应期间记录电流密度随时间的变化。在测试过程中,电解装置内发生NRR 反应,结束后可以收集反应装置内的电解液,对电解液中的氨含量进行测量,同时可以获得电流密度随反应时间的变化,测试催化材料随反应时间的稳定性变化,也可依据电流密度随时间变化曲线计算反应总电量等物理量,进而计算法拉第效率。
2.2.3 测试电解液中氨含量 电解液中的氨含量可采用比色法、同位素标记法和离子色谱法进行检测。比色法主要有Nessler试剂(碘化汞钾)比色法和靛酚蓝比色法。由于Nessler 试剂含有重金属Hg,可能有环境污染,目前的研究中多采用靛酚蓝比色法检测电解液中的氨含量,原理为生成的氨在电解液中以NH4+形式存在,与亚硝基铁氰化钠、次氯酸钠和水杨酸反应,生成靛酚蓝,其特征光吸收峰为655 nm,此处测得的吸光度与生成的靛酚蓝浓度线性相关,即与电解液中NH4+浓度正相关,可据此得到工作曲线计算氨的产量[16]。同位素标记法则是采用15N2作为原料气,通过核磁共振(nuclear magnetic resonance,NMR)技术对产物中的15N 含量进行检测,检测结果即为电催化过程中N2还原所得NH3的含量。这种方法检测精度高,产物来源确定,最为可靠[17],但是15N2气体成本极高,限制了该方法的应用。离子色谱法利用离子交换树脂可以高选择性检测电解液中的NH4+含量[18],检测速度较比色法更快,步骤简单,减少了人工操作引起的误差,目前在线离子色谱检测也已应用,可以进行动态监测,但是设备价格昂贵限制了该方法的应用。
2.3 测试体系中的杂质影响
在电催化还原氮气合成氨的实验研究中,由于电解液中生成的氨产物一般处于10-6量级,环境和试剂中的杂质干扰将非常显著地影响测试结果。Andersen 等[17]研究指出实验环境中存在的微量氨、测试人员呼吸产生的氨、Nafion 膜以及实验所使用的氮气内含有的可以在还原电位下转化为氨的氮氧化物等干扰源,都可能影响最终的测试结果。同时,Li等[19]采用比色法进行了电解液的检验,发现实验所使用的不同品牌的试剂配制的电解液中,都难以避免含有一定量的NO-3、NO-2等杂质离子,这些杂质在还原电位下也可以转化为氨[19]。因此,在进行电催化NRR 实验时,应该进行一系列处理来排除可能影响测试结果的干扰因素,如通过煅烧去除药品中可能含有的硝酸盐和亚硝酸盐[19]、保证实验装置的气密性使电解液尽量少接触空气、对Nafion 隔膜进行预处理等[17]。同时,也应在实验设计时,加入更多的对照实验,如:(1)通Ar条件下的电解实验,即不供给原料气N2,以验证是否仅以N2作为原料气时才可以发生反应;(2)通N2条件下的开路实验,即不施加电压,以验证是否仅在提供电能时才可以发生反应,即该反应为电化学反应;(3)通N2条件下不负载催化材料的电解实验,即不加入NRR 催化材料,以验证是否仅催化材料存在时才可以发生反应,即该反应为NRR 催化反应;(4)15N2同位素标记法检验,用以验证N2条件下发生反应后检测到的NH3的来源是N2的还原,而非来源于其他可能的含氮杂质。
2.4 测试温度的影响
温度是影响化学反应的动力学过程的重要因素,进而会对产氨速率造成影响。根据Arrhenius公式

式中,k为反应速率;A为Arrhenius常数;Ea为活化能;R 为摩尔气体常数;T 为反应温度。结合现有研究工作,可以发现测试温度越高,产氨速率越快,这可能是由于温度升高促进了反应过程中的传质过程。Yang 等[20]使用Mo 掺杂的W18O49纳米线作为电催化NRR 的催化剂,测试了不同温度下的产氨速率和法拉第效率。如图3[20]所示,发现产氨速率随温度升高而增加,由(3±3)℃下接近3.5 μg NH3·h-1·(mg cat.)-1提升至在(45±3)℃下接近6.5 μg NH3·h-1·(mg cat.)-1。

图3 测试温度对Mo-W18O49的产氨速率和法拉第效率的影响[20]Fig.3 Effect of testing temperatures on NH3 yield rates and FE of Mo-W18O49[20](bars for NH3 yield rates and dots for FE)
3 用于电催化NRR 合成氨的材料及设计策略
电催化NRR 合成氨这一领域的研究开始较早,目前已经有很多催化材料体系成功用于电催化NRR 合成氨。贵金属基催化材料是早期研究的主要研究对象。2000 年,Kordali 等[21]使用贵金属钌(Ru)作为固态聚合物电解质电解池的阴极,利用氮气和水电催化合成氨,在90℃以-1.02 V(vs Ag/AgCl)为反应电位获得了1.30 μg·h-1·cm-2的产氨速率和0.24%的法拉第效率。此后,研究者继续研究了Ru[22-23]、Rh[13,24]、Pd[25-26]、Au[27-32]、Pt[33]等众多贵金属基催化材料,验证了贵金属基催化材料可以催化NRR。
然而,贵金属基催化材料存量稀少、价格昂贵,难以大规模应用,因此不含贵金属的催化材料开发受到高度重视,目前过渡金属基催化材料(如Ti[28,34-41]、V[42-44]、Cr[45-47]、Mn[41,48-49]、Fe[49-54]、Co[49,55-57]、Ni[49,53,57-59]、Nb[60]、Mo[15,52,61-69]、W[20,70-72]等)都有相关研究报道。由于过渡金属元素中具有未占据d轨道可以接受N2分子的孤对电子,同时这些元素的d 轨道电子也可以与N2的分子轨道相互作用,有利于N2的吸附和活化,部分催化材料的产氨速率与效率甚至超过了贵金属基催化材料[59]。Chu 等[61]通过实验结合理论计算表明,MoS2具有负的N2吸附能,可自发吸附N2。进一步将MoS2与C3N4复合后,由于电荷转移,边缘Mo位点电子密度升高,可以转移到*N2H 的2π*反键轨道,以利于稳定*N2H这一中间产物,促进N2的活化加氢过程,最终在-0.3 V(vs RHE)的反应电位下获得了18.5 μg NH3·h-1·(mg cat.)-1的产氨速率和17.8%的法拉第效率。研究发现,多数过渡金属基催化材料同时也具有较好的HER 催化活性,该竞争反应的存在会降低NRR 的反应速率和法拉第效率。Bi[14,73]和Sn[74-75]等主族金属,其HER 催化活性相对于过渡金属材料较低,应用于电催化还原氮气合成氨领域可以有效提高NRR 的选择性,有望获得较高的法拉第效率[73]。此外,硼材料(如硼纳米片)[76-77]、碳材料(如氮掺杂多孔碳)[78-79]和导电聚合物(如聚苯胺)[80]等其他材料作为催化剂,也可以催化N2还原。不 同 NRR 电 催 化 材 料 的 性 能 总 结见表2。
除产氨速率和法拉第效率以外,催化剂的工作稳定性也是一个重要指标,包括长时间稳定性和循环稳定性。目前长时间电化学测试中,稳定性较好的催化剂可以稳定工作十几小时甚至几十小时;循环稳定性测试中,循环性能较好的催化剂也能进行多次循环测试而产氨速率不发生明显衰减。Wu等[57]制备的NiCoS/C 催化剂稳定工作时间为12 h,5次循环后仍能保持稳定的产氨速率;Yang 等[20]制备的Mo-W18O49催化剂稳定工作时间为84 h,3次N2/Ar循环后仍能保持稳定的产氨速率。但是,目前的催化剂稳定性还与实际生产的要求有较大差距。催化剂稳定性可能与催化材料本身的理化性质、电解质、循环次数等因素相关。如何在保证高的产氨速率和法拉第效率的同时,提高催化材料的工作稳定性是电催化NRR研究的重点。
目前,常用的NRR 电催化材料设计方法包括仿生位点设计、晶格缺陷调控、表界面设计等,如图4所示。接下来将结合Bi、Sn、Mo 等具体的NRR 催化材料体系对上述设计方法进行介绍。
图4 NRR电催化材料设计策略Fig.4 Design strategies of NRR electrocatalysts
3.1 仿生位点设计
仿生位点设计是一种常见的材料设计策略,特别是当适合的材料体系和反应机理尚不明确时,应用仿生策略可以快速有效地设计相关材料并进行相关研究。Mo 作为生物固氮酶中活性位点的重要组成元素,在催化领域具有广泛的应用,因而受到广泛关注[62]。Qin 等[63]利用固氮酶中Fe-Mo 的协同作用,采用水热-热解的方法制备了含有Mo-Fe 活性位点的钼铁碳化物Mo3Fe3C 催化材料,模拟了固氮酶的活性位点,获得了27%的法拉第效率和1.23 μg NH3·h-1·(mg cat.)-1的产氨速率。计算表明,相较于Mo2C,Fe 的引入建立了Mo-Fe协同作用,降低了吸附的N2分子加氢的反应能垒,更好地促进了反应的进行,从而提升了NRR 催化性能。

表2 不同NRR电催化材料的性能Table 2 Catalytic performance of different NRR electrocatalysts
3.2 晶格缺陷调控
晶格缺陷(如掺杂原子、晶格空位)构筑是一种重要的材料性能调控策略。通过原子置换掺杂可以改变材料的晶格结构和电子结构,从而对包括电学性能、吸附性能和催化性能在内的多种性能进行调控。Zhang 等[62]通过水热法制备了Co 掺杂的MoS2,这种材料富含缺陷,有助于N2吸附和活化。DFT 计算结果表明Co 的掺杂降低了反应能垒,有利于NRR 进行。电化学测试表明,该材料在0.3 V 过电位下获得了10 μg NH3·h-1·(mg cat.)-1的产氨速率和超过10%的法拉第效率。
与掺杂类似,晶格空位的存在也可以调控材料的电子结构,从而调控材料的吸附性能和催化性能。在NRR 催化材料中引入阴离子空位缺陷(如氧空位)是一种常见的调控手段:Zhang 等[15]通过化学气相沉积法制备了含氧空位的MoO2纳米片,在-0.15 V(vs RHE)的反应电位下获得了12.20 μg NH3·h-1·(mg cat.)-1的产氨速率和8.2%的法拉第效率。结合材料的表征实验可发现,氧空位的存在可增加材料中载流子浓度以增强本征电导率,有利于电子转移;同时氧空位可以提高材料对N2的吸附活化。理论计算也表明,氧空位有助于稳定反应的中间产物,这些有助于NRR 进行。引入阳离子空位也是一类重要的调控手段:Yang 等[64]采用SiO2模板法制备了含Mo 空位的MoN 材料。HF 刻蚀SiO2时,由于Mo—O—Si键的存在,一部分Mo原子也被刻蚀形成阳离子空位缺陷。NRR 测试表明,该材料在-0.2 V(vs RHE)的反应电位下可获得76.9 μg NH3·h-1·(mg cat.)-1的产氨速率和6.9%的法拉第效率。计算表明,这种缺陷促进了N N 的解离,降低了反应能垒,促进NRR反应。
3.3 表界面设计
材料的表面和界面富含非平衡化学位点,具有特殊的吸附性能和电学性能,可以影响反应物的吸附、反应中间产物的稳定性以及反应产物的脱附,通过表界面设计可以使催化材料获得或提高催化活性。Chu 等[61]设计了MoS2/g-C3N4的复合材料,其界面具有电子相互作用,改变了Mo 活性位点的电子状态,稳定了反应中间产物*N2H,获得了比MoS2更高的NRR催化性能。
对材料进行表面形貌调控(如合成棒状、花状、片状的材料),可以增加材料的比表面积,增加暴露的活性位点数目,调节表面活性位点的电子状态,从而调控材料的催化性能。Li等[73]通过水热法首先合成了具有花状微观结构的二维BiOI 纳米片,将其在电解环境下原位还原为二维Bi 纳米片,并保留了前体的微观结构。与Bi纳米颗粒相比,二维Bi纳米片边缘部位的活性位点暴露更多,同时层间Bi—Bi键长度减小,有利于促进Bi的p电子离域化,并增强其对N2的吸附和活化,从而在-0.8 V(vs RHE)的反应电位下实现了13.23 μg NH3·h-1·(mg cat.)-1的产氨速率和10.46%±1.45%的法拉第效率,其产氨速率是Bi 纳米颗粒的十倍。Li 等[74]通过水热法合成了SnS2纳米片,同样采用原位电还原方法,部分还原SnS2制备了Sn/SnS2作为NRR 催化材料,在-0.8 V(vs RHE)的反应电位下得到了23.8 μg NH3·h-1·(mg cat.)-1的产氨速率和4.3%的法拉第效率。
此外,对材料进行尺寸调控(如合成低维材料)也可以增加材料的比表面积,改变表界面性质。Chu 等[75]采用自蔓延燃烧法合成了负载于还原氧化石墨烯(RGO)上的SnO2量子点材料。这一催化材料在-0.5 V(vs RHE)的反应电位下获得了25.6 μg NH3·h-1·(mg cat.)-1的产氨速率和7.1%的法拉第效率。结合DFT 计算发现其NRR 高活性源于分布均匀的SnO2量子点比表面积高,提供大量N2吸附位点,以及表面缺陷丰富的RGO 基底可以提高电导率并降低吸附的N2分子加氢反应的能垒。
当调控催化材料尺寸小到呈原子级分散于基底材料上时,就是目前研究较多的单原子催化剂设计策略。与传统的材料相比,单原子催化剂与基底间界面相互作用不同,其电子结构和化学价态发生变化;同时,由于金属原子高度分散于基体材料上,所有金属原子都属于表面活性位点,提高活性位点利用率[65],一般可获得很好的NRR 催化性能。一系列计算工作表明,不同基底上锚定的Mo 原子都有一定的NRR 活性[65-67]。Hui 等[68]选用富电子的石墨炔(GDY)纳米片作为单原子催化材料的基底材料,采用浸渍法在GDY 表面负载Mo 前体,继而通过溶剂热还原方法,制备了分散于GDY 上的Mo 单原子催化材料Mo0/GDY,并对其进行电化学测试,获得了145.4 μg NH3·h-1·(mg cat.)-1的产氨速率和21%的法拉第效率。理论计算结果表明,Mo 原子与GDY 的界面电子相互作用影响了GDY 的电子分布和活性,有利于N2与Mo 结合从而促进吸附过程,同时Mo 与炔烃环的界面相互作用,使得电子容易转移,以实现N2的还原反应[68]。
4 总结与展望
综上可以看出,NRR 合成氨电催化材料体系日益丰富,催化性能也在逐步提高,但是目前的研究仍普遍存在反应速率和法拉第效率均较低的挑战,未来还需要在以下方向继续深入研究。
(1)规范实验操作,排除环境中的杂质干扰。目前NRR 的实验结果大多停留在10-6量级,极易受到外界杂质的干扰,保证实验操作的规范以及实验过程中杂质的去除,才能获得可靠的实验结果,获得真实的NRR 性能,更有针对性地开展进一步的研究。
(2)继续进行反应机理的探索和研究。目前,在NRR 研究领域缺乏系统性的对反应机理的认知和解释,大多数研究工作中提出的机理仍停留在特定的材料体系层面,用于解释所研究的材料体系的催化性能。这一定程度上限制了NRR 领域的发展和材料体系的精准研发。可以结合N2-TPD 测试探索催化剂对N2的吸附原理,结合原位红外测试、原位拉曼测试等原位表征技术探究反应过程的中间产物,结合理论计算研究NRR反应机理和步骤。
(3)开发新的电催化NRR 材料体系。结合仿生、计算、模拟等策略,也可以借鉴其他催化领域的材料体系开发思路,更加广泛地探索适合电催化NRR的全新材料体系。
(4)提升已有材料体系的催化活性。应用材料设计与调控策略来提高NRR 反应活性,比如利用掺杂、空位构建等晶格缺陷调控策略,以及利用形貌、尺寸调控等表界面设计来增加反应的活性位点,改善材料对N2分子的吸附性能,调节材料的电子结构促进N N 断裂,调控反应过程中间产物的吸脱附性能。此外,还可以通过使用离子液体降低H+浓度、采用HER 惰性的主族金属等材料、减少HER 活性位点暴露、增加H+吸附能垒等策略抑制HER以提高催化材料的NRR催化活性和选择性。
(5)提升已有材料体系的催化稳定性。一方面通过材料设计与调控,改善催化材料的物理化学性质,可以提高催化材料的稳定性;另一方面,探索催化剂活性位点在反应过程中的变化和失活机制,保持活性位点的长时间有效暴露,也可以提升NRR 电催化材料的工作稳定性。
(6)探索电解液对反应速率和法拉第效率的影响规律。NRR 反应体系中催化材料、反应物和电解质的相互作用对反应速率和法拉第效率也有影响,深入理解其作用机制将有助于NRR 催化活性进一步提高。
