水环境有机污染物微生物转化的代谢调控研究
2020-06-20吕颖
吕 颖
(北京市北运河管理处,北京 101101)
水环境有机污染物主要来源于人类活动,具体包括生活污水、畜禽养殖废水及各类工业废水[1]。污染水环境的主要物质有石油类、农药、表面活性剂以及酚类等化学物质,还有一些腐殖质、多糖类等非挥发性的有机物质,这些污染物在转化降解时会消耗水中的溶解氧,恶化水质,破坏生态平衡[2]。微生物转化过程是通过微生物细胞修复复杂的底物结构,即使用微生物代谢过程中产生的酶,催化底物反应[3]。代谢调控可以打破微生物细胞内的自动调节机制,使其朝着人们所期望的方向发展。研究水环境有机污染物微生物转化的代谢调控,可以更好地监测水环境中的污染物的变化,改善水质[4]。
1 实验材料和方法
1.1 实验有机物及微生物
实验采用居民居住区周围的河流水源,在水源周围设立3个不同的水样采集点(A、B、C点),采集点A、B、C具体位置见图1。
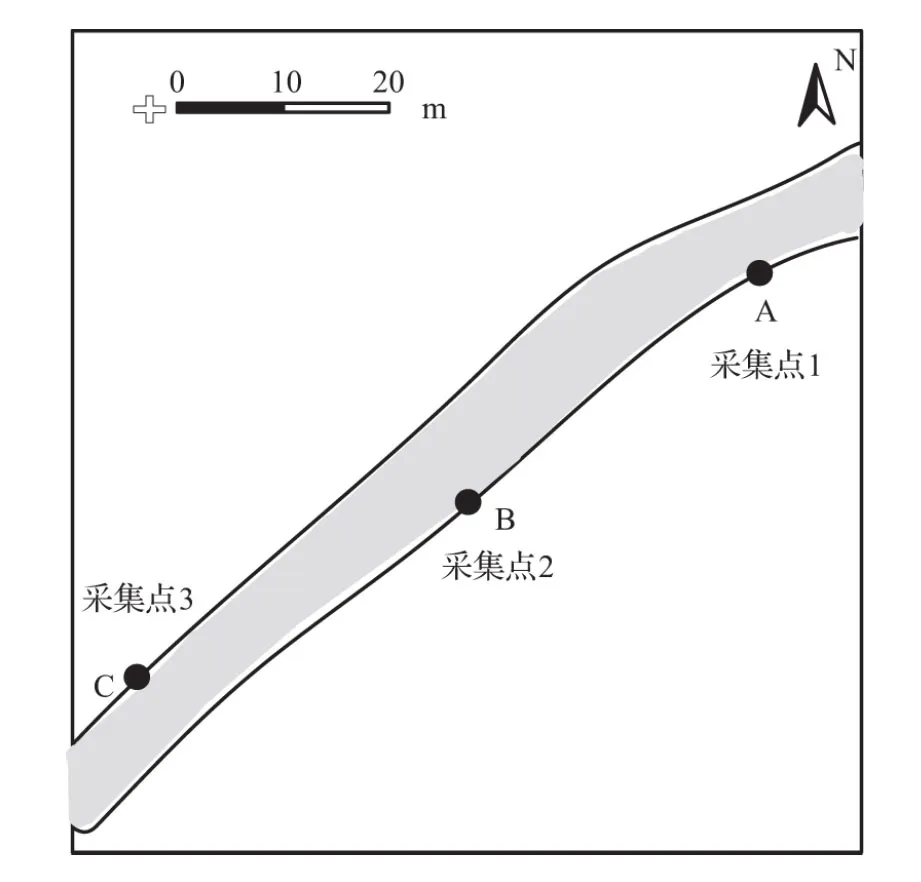
图1 水样采集点位置
有关研究表明:真菌分裂、生长、孢子萌发都与碳浓度大小有关,在真菌中起着调节传输物质的作用,还会调节氨基酸的传输,不同的微生物体内都有特异代谢方式[5]。实验使用长孢葡萄穗酶,将菌株接种于种子培养液中,培养3天后获得微生物子液,再将甘油与生理盐水调和为4∶6的比例混合均匀,将此时的混合液与微生物子液按照1∶1的比例混合于冻藏管,放在-80℃冷冻室中保存。新鲜的微生物子液放置在斜面培养基上培养3天,获得孢子,然后将获得的孢子置于冷冻真空干燥的环境中保存[6]。
1.2 培养基
使用直径90mm、高15mm、容量13mL×3格的一次性微生物培养皿,为方便对比,培养基配置3种培养基溶液:斜面培养基(PSA培养基)、种子培养基(GSB培养基)以及原始发酵培养基(改良查氏培养基)。
斜面培养基:将土豆去皮,切成薄片取30g,加入70g蒸馏水,煮至土豆松软,使用四层纱布将土豆变为泥状,制成浓度为25g/L的土豆溶液。加入蔗糖15g/L,琼脂20g/L,然后将整个培养基的水分补水至100mL,然后放入微波炉中加热直至琼脂全部溶解的状态,斜面培养基中的溶液制作完毕,将溶液分装到试管中[7]。
种子培养基的具体配置成分见表1。混合表1中的各成分,使用6号成分的盐酸将培养基溶液的pH值调节至6。
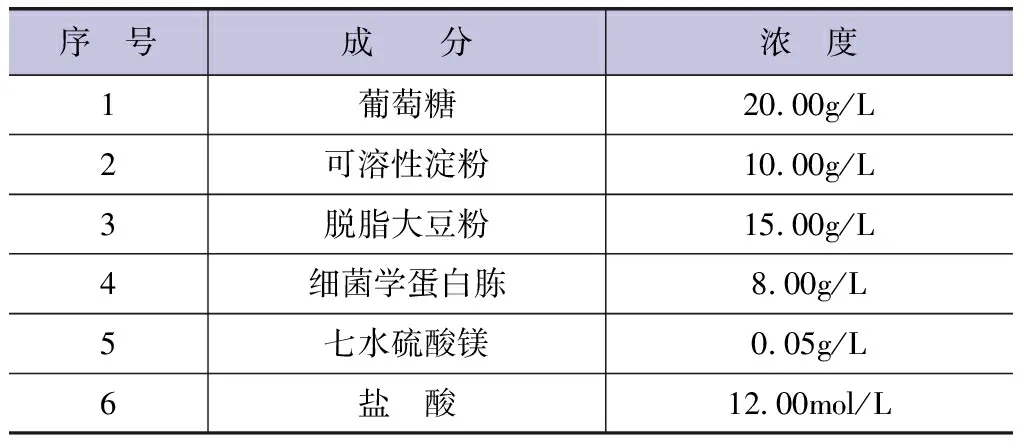
表1 种子培养基配置成分浓度
原始发酵培养基的具体配置见表2。混合表2中的各成分,使用11号浓度的盐酸将培养皿溶液的pH值调节至6。
制备好以上3种培养基,全部置于121℃条件下灭菌15min。
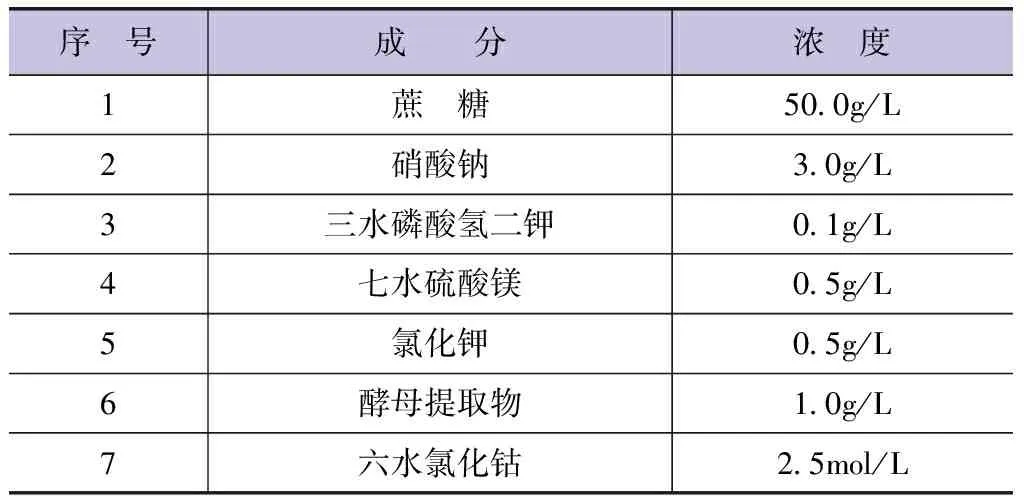
表2 原始发酵培养基配置各成分浓度
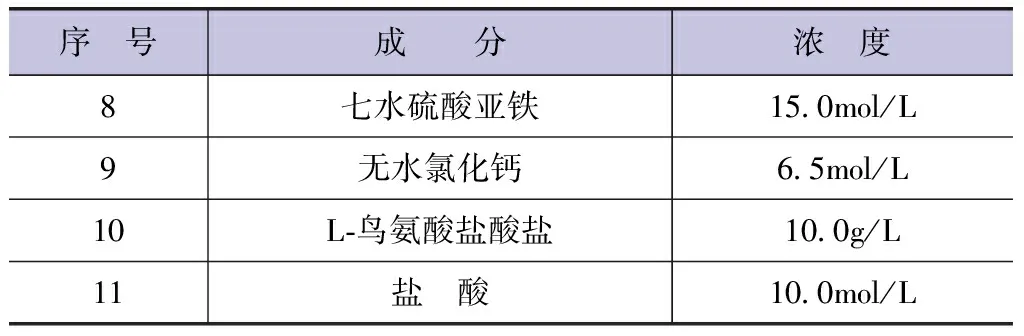
续表
1.3 原始培养条件
斜面培养条件:将冻库管中的菌液均匀涂布于斜面培养基中,放置霉菌培养箱中,保持培养箱的温度为25℃,培养6天。
种子培养条件:使用接种环在菌种斜面上刮取拇指大小的菌体,接种到种子培养基的500mL锥形瓶中,将锥形瓶放置在25℃、180r/min摇床中培养6天。
发酵培养条件:取2mL种子培养基中的液体,接种到200mL发酵培养基中,将其置于25℃、180r/min摇床中培养6天[8]。
1.4 实验试剂及仪器
实验试剂包括琼脂、蔗糖、磷酸氢二钾、硫酸镁、无水硫化钙、氯化钙、氯化钠、氯化钴、盐酸、葡萄糖、氯化钾、硫酸亚铁、可溶性淀粉、脱脂大豆粉、细菌学蛋白胨、酵母提取物;实际代谢调控时的仪器使用霉菌培养箱[9]。
1.5 调控方法
调控前先将接种方式更改为直接接种孢子的方式,依据转化时间,更换培养条件:将300万个孢子接种于100mL种子培养基的500mL锥形瓶中,接种量为5%,培养26~28h。培养温度均为25℃,转速为180r/min。菌体在培养基内要维持生长需要的足够的碳,摇动发酵液后,此时微生物代谢会进入TCA循环,产生大量的能量供给微生物的生命活动[10]。改变常见碳源的浓度梯度,或改变常见碳源的成分,将碳浓度设定为表3中数值。
使用表3中调控的碳源浓度,设定3种不同梯度碳源浓度,发酵期为6天,使用150mL的锥形瓶,装取75mL混有3种不同浓度的碳源的培养液[11]。计算菌体湿重公式为
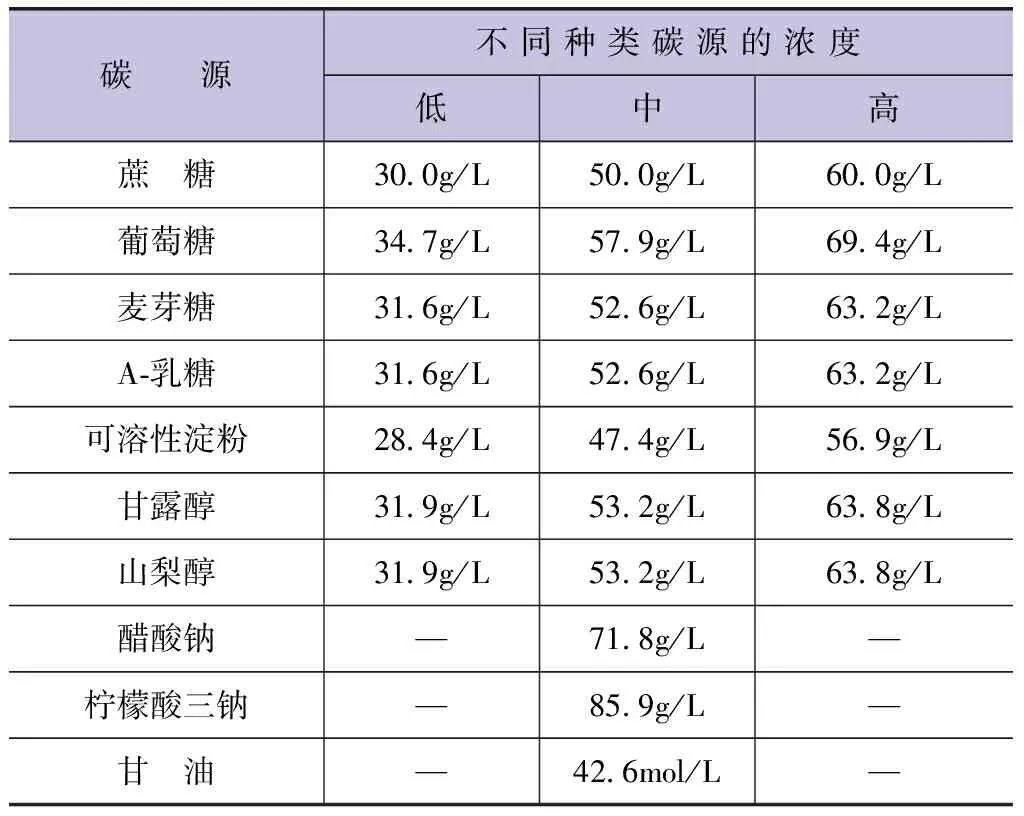
(1)
式中:W为菌体湿重;CS为培养基面积;FS为视野面积;Fn为每片计数过的视野数;V为1L水经沉淀浓缩后的体积;v为计数框体积;Pn为每片通过计算实际数出的菌类个数[12]。
菌体干重的计算公式为
(2)
式中:M为菌体干重;x,y为培养基观测位置;t为实验时间;C为(x,y)处t时刻碳浓度;n为pH值大小;Dx为横向弥散系数;Dy为纵向弥散系数[13]。
1.5.1 低碳源
将发酵液摇晃均匀后,取10mL置于布氏漏斗中,同时加入100mL去离子水冲洗,真空抽滤,水分抽滤干后将滤纸置于65℃烘箱中11h,烘干,然后置于干燥器中恒重24h,称重,计算菌体干重。
1.5.2 中碳源
取发酵液750μL于2mL的离心管中,加入750μL发酵液与甲醛1∶1萃取后的溶液,混合均匀后,使用超声波超声提取5min,使用1mL注射器吸取溶液上部分清液,然后使用尺寸为0.45μm的滤头过滤,用高效液相色谱测定菌体的干湿重。
1.5.3 高碳源
高碳源调控方法使用HPLC检测,设定检测条件为Kromasil-C18液相色谱柱,柱温40℃,检测波长为260mm,流速为1mL/min,进样量为20μL,流动相为0.1%三氟乙酸和乙腈线性梯度洗脱。设置洗脱梯度为:0.01~30.00min,45%B相;30.00~35.00min,85%B相[14]。配置不同浓度的标准溶液(10mg/L、25mg/L、55mg/L、95mg/L、125mg/L、225mg/L、325mg/L、425mg/L、525mg/L),计算得到相峰积分,然后计算各个相峰面积,得到菌体干湿重大小。使用峰面积对碳浓度做标准曲线(回归系数R2=0.99),标准曲线的公式为
y=16.591x+8.9933
(3)
式中:其中回归系数为R2=0.9998;x为时间,min[15]。
2 调控结果
2.1 低浓度调控结果
不同菌种类型会产生不同的代谢产物,而同一种菌种在产生代谢产物时,对应最佳菌体的重量也不同,调控微生物转化时,控制3种不同浓度的碳源,统计调控6天培养基,得到的低碳浓度的菌体干湿重变化见图2。
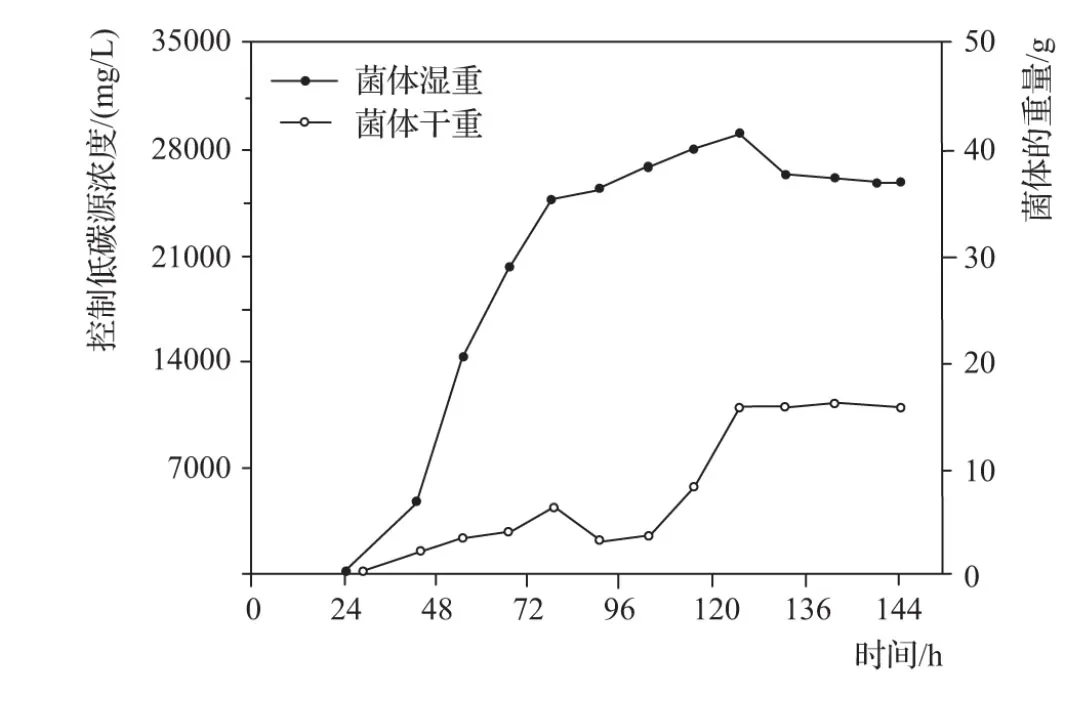
图2 低浓度碳源菌体干湿重变化
由图2可知:控制低碳源浓度为0~35000mg/L时,随着时间的增长,菌体湿重稳步增长,在约126h时,湿重开始减小,最终维持在38~40g之间。菌体在78h时,干重开始下降,但在90h时,又恢复稳固上升的趋势。
2.2 中浓度调控结果
维持中浓度碳源在7000~42000mg/L,随着水分的蒸发,前几个小时菌体生长旺盛,菌液黏稠。将通气调至最高,补加水增强控制菌的摄氧率,增强有机污染物微生物转化代谢过程。中浓度碳源菌体干湿重变化见图3。
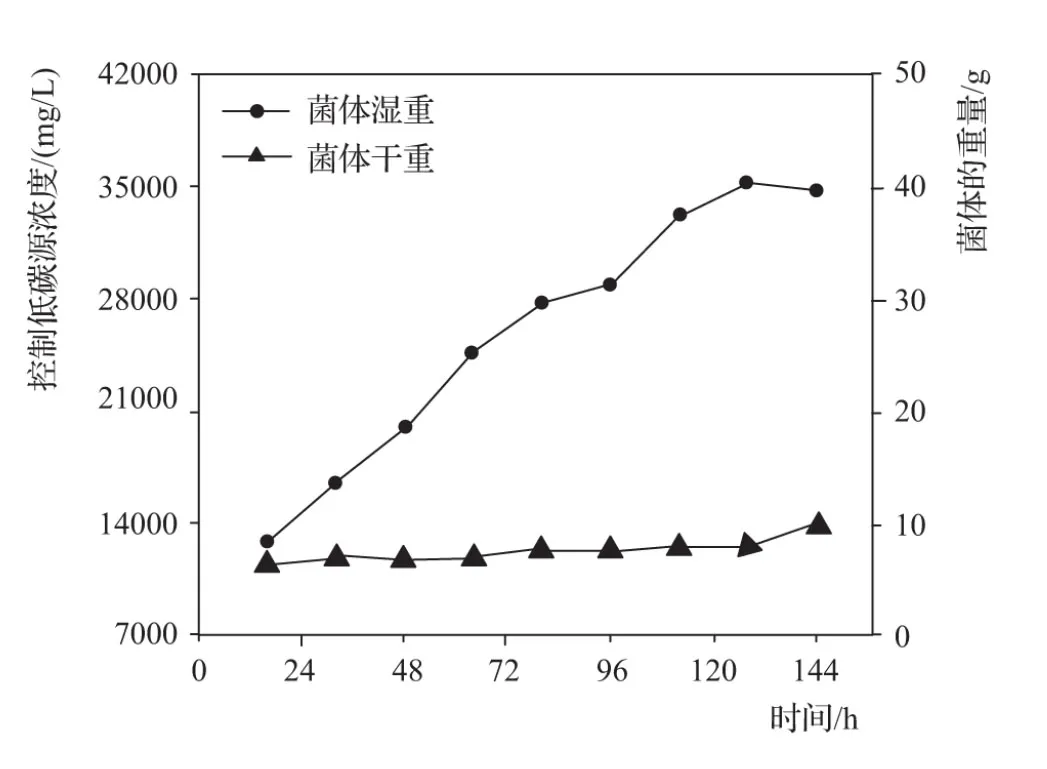
图3 中浓度碳源菌体干湿重变化
由图3可知:维持中浓度碳源,在96h时,菌体湿重大小发生小转折,但依旧保持上升趋势;而此时的菌体干重并没有发生明显变化,最终维持在10g左右。
2.3 高浓度调控结果
增加碳源种类,将碳源浓度保持在21000~56000mg/L的高浓度区间内,菌体在此浓度下,自体产生自行代谢,并产生大量的前体,此时的菌体干湿重量变化见图4。
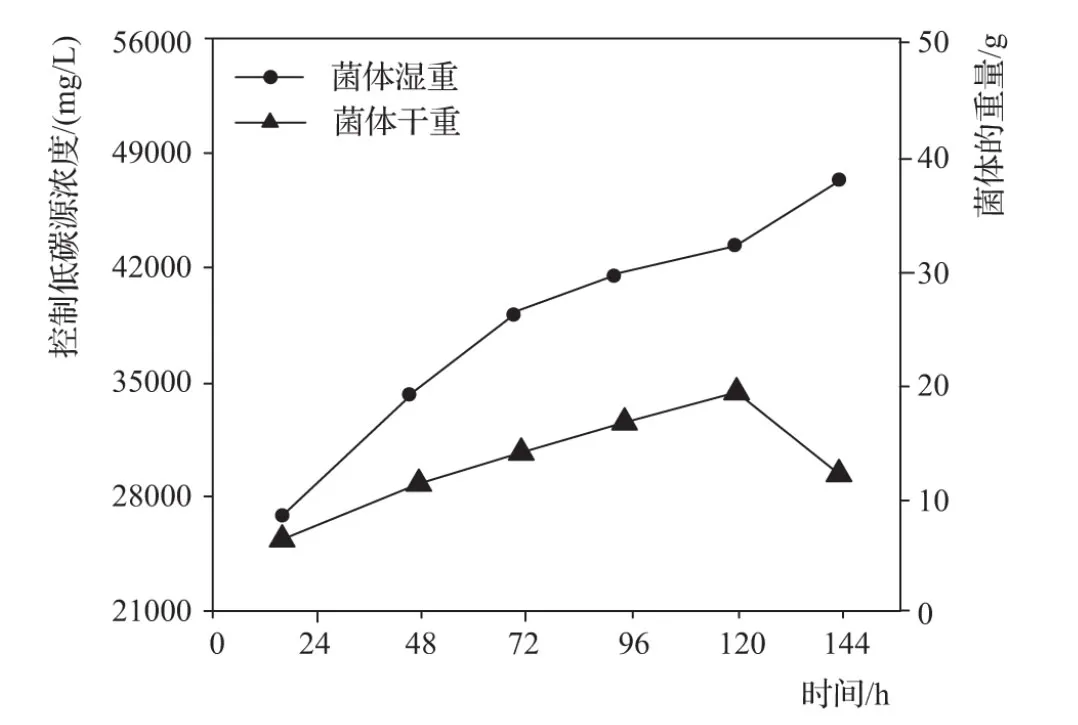
图4 高浓度碳源菌体干湿重变化
由图4可知:维持高浓度碳源,菌体在20h时,湿重逐渐增加,大小增长到40g。而干重保持增长,到120h时,干重大小变为20g,之后干重减小,实验完毕后,菌体干重维持在10g左右。
3 结 论
3.1 保持低碳浓度环境
在培养基发酵后期,菌体生长缓慢,残糖量较低。维持正常代谢过程时需要足够的碳骨架,碳骨架会产生代谢过程的关键中间体FGFC3,但在低碳浓度环境下的合成能力较低,所以代谢过程在72h时,FGFC3开始积累,才可以维持正常的代谢过程,调控方式基本奏效。在124h之后,由于残糖量过低,培养基发酵液环境内的pH值迅速升高,导致代谢所需的FGFC3无法正常产生,破坏了发酵体系。此时的菌体湿重、干重波动较大,调控效果最明显。
3.2 保持中浓度碳环境
在20h时,逐渐产生FGFC3,没有出现二次积累,并随着时间的持续积累呈现出一种小幅度的波动变化。中碳浓度的调控环境,可以提供足够的碳骨架,帮助产生更多的FGFC3。但剩下的中浓度碳源会在一段时间内,打破代谢平衡。随着时间的增加,代谢会产生一种由正常代谢到打破正常代谢,最终又恢复正常代谢的循环过程,导致图2中湿重不断增加、干重基本保持不变的情况。调控效果不明显,基本不影响水环境有机污染物微生物的转化。
3.3 调节到高浓度碳环境
代谢过程中的酶会将鸟氨酸转化为瓜氨酸,瓜氨酸参与到代谢过程中反应,转换形成精氨琥珀酸,然后在酶的催化下,裂解水解后形成尿素,加快了代谢过程。所以在72h之后,残糖量低,高浓度的碳源会合成更多的FGFC3,剩余的碳源会因为浓度过高,经干燥后增加了菌体的干重。在120h时,经过干燥后的碳会变成区别于菌体的黑色固体,去除残余的黑色碳,得到菌体干重大小变化。因此,高浓度调控环境,代谢调控效果一般。
4 结 语
在当今蓬勃发展的社会,疏忽对环境的保护,会造成环境的污染。研究水环境有机污染物微生物转化的代谢调控,可以更科学地治理被有机污染物污染的水环境,更加全面地研究水环境内存在的有机污染物,有助于水环境的治理,使经济发展与环境发展相协调,实现可持续发展。
