如意珍宝丸对偏头痛大鼠下行痛觉调节通道的影响
2020-06-19李伊然顿珠罗亚敏
李伊然 顿珠 罗亚敏

摘要 目的:研究藏藥如意珍宝丸对硝酸甘油致偏头痛模型大鼠下行痛觉调制通道中心区域中脑导水管内神经生长因子(Nerve Growth Factor,NGF)、酪氨酸激酶A(Tyrosine Kinase A,TrkA)、瞬时感受器电位香草酸受体1(Transient Receptor Potential Vanilloid Receptor 1,TRPV1)的表达影响,探究该药干预神经源炎性痛敏性偏头痛的作用机制。方法:以颈部皮下注射硝酸甘油方法复制大鼠偏头痛模型,以如意珍宝丸为药物实验组,琥珀酸舒马普坦为阳性对照组,采用ELISA和Real-Time PCR法检测外周血清及中脑组织NGF、TrkA、TRPV1蛋白及基因表达水平,观察藏药如意珍宝丸对硝酸甘油致偏头痛模型大鼠下行痛觉调制系统的影响。结果:与空白组比较,模型组血清NGF、TrkA、TRPV1蛋白表达显著上升(P<0.05);中脑NGF、TrkA、TRPV1基因表达差异性升高(P<0.05)。与模型组比较,如意珍宝丸预防组可降低NGF、TRPV1蛋白表达(P<0.05);如意珍宝丸观察组能使NGF、TrkA蛋白表达和NGF、TrkA、TRPV1 mRNA表达均降低(P<0.05或P<0.01)。结论:NGF、TrkA共同参与了下行疼痛调控中TRPV1介导的偏头痛发生;藏药如意珍宝丸可降低NGF、TrkA对TRPV1的上调作用,起到抑制神经源炎性痛敏性偏头痛的作用。
关键词 如意珍宝丸;偏头痛;中脑导水管周围灰质;神经生长因子;酪氨酸激酶A;瞬时感受器电位香草酸受体1
Abstract Objective:To study the effect of Tibetan medicine Ruyi Zhenbao Pill(RZP) on the expressions of nerve growth factor(NGF),tyrosine kinase A(TrkA),transient receptor potential vanilloid receptor 1(TRPV1) in the periaqueductal gray(PAG),which is the central structure of the descending pain modulatory system of nitroglycerin-induced migraine model rats,and to investigate its mechanism for intervening neurogenic inflammatory pain-sensitive migraine.Methods:The model of migraine was induced by subcutaneous injecting nitroglycerin (NTG) in the neck,the RZP was used as drug experimental groups,and sumatriptan succinate was the positive control group.The expression levels of NGF,TrkA and TRPV1 protein and mRNA in peripheral serum and midbrain were detected by ELISA and Real-Time PCR respectively.The effect of Tibetan medicine Ruyi Zhenbao Pill on the descending pain modulatory system of migraine in rats with migraine was observed.Results:Compared with the blank group,the serum NGF,TrkA,TRPV1 protein expression in the model group increased significantly (P<0.05),Midbrain NGF,TrkA,TRPV1 gene expression difference increased (P<0.05).Compared with the model group,the level of NGF and TRPV1 protein descended in RZP prevention group (P<0.05).The expression of NGF and TrkA protein and the expression of NGF,TrkA and TRPV1 mRNA were all down-regulated in the RZP treatment group (P<0.05 or P<0.01).Conclusion:NGF and TrkA are involved in the occurrence of TRPV1-mediated migraine in the descending pain modulatory system.Tibetan medicine Ruyi Zhenbao Pill can inhibit neurogenic inflammatory pain-sensitive migraine by reducing the upregulation effect of NGF,TrkA and TRPV1.
Keywords Ruyi Zhenbao Pill; Migraine; Periaqueductal gray; Nerve growth factor; Tyrosine kinase A; Transient receptor potential vanilloid receptor 1
偏头痛(Migraine)是一种机制复杂、发病率高、具有反复发作特点的神经系统疾病,现代临床应用的各型药物禁忌证多、不良反应大,如曲坦类作为抗偏头痛的一线药,会导致心律失常、心肌梗死及卒中等后遗症,而长期使用这些药物还会形成药物性头痛[1]。据文献证明藏药如意珍宝丸是治疗白脉病,即现代医学神经系统疾病的经典名方,对偏头痛、三叉神经痛等神经性病变疗效显著[2-5],且安全性高[6]。本课题组前期实验研究亦表明藏药如意珍宝丸可缓解硝酸甘油所致偏头痛模型大鼠脑电图的异常变化,有明显镇痛效果[7-8],但其对偏头痛的作用机制仍不甚清晰。
外源伤害性刺激激活三叉神经-血管系统(Trigeminal Vascular System,TGVS)后,其所产生的一系列连锁效应导致的神经源性炎性反应和敏化现象成为现今偏头痛探索的主流方向[9]。而存在于末梢神经伤害感受器上的瞬时感受器电位香草酸受体1(Transient Receptor Potential Vanilloid Receptor 1,TRPV1)在偏头痛发生中的敏化影响逐渐成为研究热点[10-11]。中脑导水管周围灰质(Periaqueductal Gray,PAG)中存在大量痛敏性相关神经肽,被认为是人类偏头痛疼痛的来源中枢[12],其参与下行调节体系的伤害性感觉传入,亦能通过上行投射纤维与丘脑发生联系[13],是下行痛觉调制系统的核心结构。TRPV1在下行痛觉调制中的重要角色已被证实[14],并有多项研究表明PAG内的TRPV1在伤害性反应的调控中起到关键作用[15-17],阻断TRPV1通路的敏化可能是抑制偏头痛发生的重要节点。神经生长因子(Nerve Growth Factor,NGF)作为TRPV1通路的上游调节因子,可通过与酪氨酸激酶(Tyrosine Kinase A,TrkA)受体结合后诱导TRPV1敏化,参与疼痛的产生[18],而抑制NGF可缓解头痛症状[19]。因此PAG中是否存在NGF表达,能否通过降低NGF表达水平来实现阻断TRPV1敏化,进而抑制偏头痛的发生则成为重要的研究方向。本实验将在这一方向指导下,深入研究如意珍宝丸对神经源炎性痛敏性偏头痛的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性SD大鼠90只,体质量250~300 g,购于北京维通利华实验动物技术有限公司(合格证号SCXK(京)2016-0006)。所有动物饲养于北京中医药大学实验动物中心,环境温度21~22 ℃,相对湿度60%~70%,24 h昼夜循环光照,所有动物可自由饮水饮食。
1.1.2 药物 藏药如意珍宝丸(青海金诃藏药药业股份有限公司,国药准字Z63020064);琥珀酸舒马普坦片(天津华津制药有限公司,生产批号:7L6928T);硝酸甘油注射液(北京益民药业有限公司,生产批号:20170628);真空采血管(北京华夏蓝筹生物科技有限公司,货号:SL-2C-02)。
1.1.3 试剂与仪器 M-MLV Reverse Transcriptase试剂(Invitrogen公司,美国,批号:AM2044);Fast SYBR Green Master Mix Bulk Pack(Invitrogen公司,美国,批号:4385614);实时荧光定量PCR仪(ABI公司,美国,7500Fast型);大鼠神经生长因子(NGF)酶联免疫试剂盒(上海酶联有限公司,批号:M1202835);酪氨酸激酶A(TrkA)酶联免疫试剂盒(上海酶联有限公司,批号:M100321198);转化受体电位阳离子通道亚家族V成员1(TRPV1)酶联免疫试剂盒(上海酶联有限公司,批号:M10087444)。
1.2 方法
1.2.1 分组与模型制备 90只大鼠按随机法分为空白组、模型组、阳性药组、藏药如意珍宝丸(预防组、治疗1组和治疗2组),每组15只。其中空白组、模型组、藏药如意珍宝丸治疗1组和治疗2组用等体积的蒸馏水灌胃,据体表计算法测算给药剂量[8],阳性药组用琥珀酸舒马曲坦片9.72 mg/(kg·d)灌胃,预防组用如意珍宝丸0.5 g/(kg·d)灌胃,连续7 d,末次给药1 h后,除空白组外,其余各组颈部皮下注射硝酸甘油10 mg/kg,制备实验偏头痛模型,若30 min后出现双耳发红、前肢频繁挠头、咬尾、往返运动、爬笼次数增多等行为学改变视为造模成功,空白组大鼠以等体积生理盐水颈部皮下注射[8]。
1.2.2 干预方法 治疗1组及2组造模1 h后,即予藏药如意珍宝丸0.5 g/kg灌胃。治疗1组与先前组别取材,治疗2组再相同剂量给药1 d,灌胃1 h后取材。取材时腹腔注射10%水合氯醛0.40 mL/100 g剂量麻醉大鼠,腹主动脉取血5 mL,注入真空采血管中摇匀,4 ℃,3 000 r/min,离心10 min,离心半径7.6 cm,分离血清,-80 ℃保存,用于ELISA检测。腹腔注射10%水合氯醛0.40 mL/100 g剂量麻醉,断头,在冰上迅速取中脑组织,称重后,置于-80 ℃保存,用于RT-PCR测定。
1.2.3 检测指标与方法
1.2.3.1 ELISA法检测外周血清NGF、TrkA、TRPV1蛋白表达 依照大鼠NGF/TRKA/TRPV1酶联免疫试剂盒说明书操作,对组织进行裂解、加样、加酶、显色等步骤,在450 nm波长下测定OD值,并进行数据处理。
1.2.3.2 Real-time PCR检测中脑组织NGF、TrkA、TRPV1基因表达 将样品在低溫下加入Trizol试剂充分研磨,提取组织总RNA,在260 nm下的吸光度进行RNA定量。按M-MLV Reverse Transcriptase试剂盒说明书操作将RNA逆转录为cDNA,采用荧光定量PCR法检测中脑NGF、TrkA、TRPV1的mRNA表达。94 ℃预变性,2 min,之后35个循环:94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s;再72 ℃延伸10 min。反应体系为25 μL,内参基因为大鼠三磷酸甘油醛脱氢酶(GAPDH),引物均由鼎国昌盛生物技术有限责任公司合成。GAPDH上游引物:5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物:5′-TTTGAGGGTGCAGCGAACTT-3′,扩增长度252 bp;NGF上游引物:5′-CAAGGGCAAGGAGGTGAC-3′,下游引物:5′-TGAGTCGTGGTGCAGTATGA-3′,扩增长度159 bp;TrkA上游引物:5′-ACCATGCTACAGCACCAACA-3′,下游引物:5′-GCAGTTTTGCATCAGGTCCG-3′,扩增长度139 bp;TRPV1上游引物:5′-GTGGAACCCTTGAACCGACT-3′,下游引物:5′-AACTCTTGAGGGATGGTCGC-3′,扩增长度274 bp。结果相对定量计算采取2-CT法。
1.3 统计学方法 采用SPSS 20.0统计软件对数据进行分析。数据以均数±标准差(±s)表示,采用单因素方差分析法对各组数据进行比较,两两比较采用LSD检验,不服从正态分布或方差不齐采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
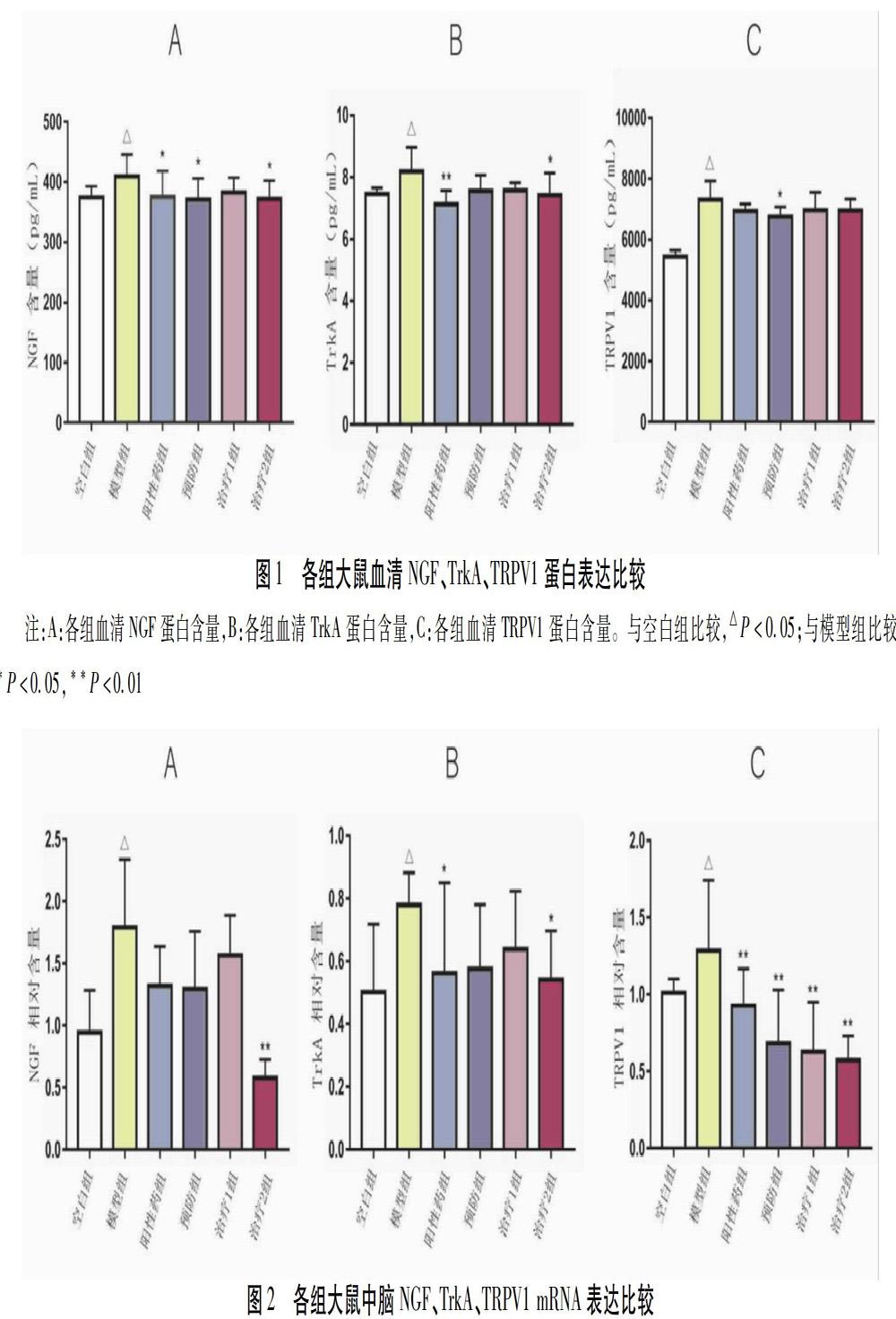
2.1 各组大鼠外周血清NGF、TrkA、TRPV1蛋白表达比较 与空白组比较,模型组大鼠血清NGF、TrkA、TRPV1蛋白表达上调(P<0.05),表示造模成功。与模型组比较,药物干预的4组中3项指标都呈下调趋势,其中阳性药组NGF、TrkA蛋白表达下降较显著(P<0.05,P<0.01),如意珍宝丸预防组NGF、TRPV1蛋白表达下降(P<0.05),TrkA水平也呈较明显下调(P=0.66),如意珍宝丸治疗2组NGF、TrkA蛋白含量与模型组差异有统计学意义(P=0.025,P=0.020)。见图1。
2.2 各组大鼠中脑NGF、TrkA、TRPV1 mRNA表达比较 与空白组比较,模型组大鼠中脑NGF、TrkA、TRPV1 mRNA表達上调(P<0.05),表示造模成功。与模型组比较,给予干预的几组中3项指标均下降,阳性药组TrkA mRNA表达量差异有统计学意义(P<0.05),如意珍宝丸治疗2组NGF、TrkA mRNA含量明显降低(P<0.05),阳性药组、如意珍宝丸预防组、治疗1组及治疗2组TRPV1 mRNA表达水平与模型组比较差异均有统计学意义(P<0.01)。如意珍宝丸预防组NGF、TrkA mRNA水平较模型组也有较为明显的下降(P=0.70,P=0.50),与阳性药组(P=0.84,P=0.41)接近。见图2。
2.3 小结 由ELISA和Real-time PCR检测结果可见,大鼠硝酸甘油偏头痛模型组NGF、TrkA和TRPV1蛋白和基因表达含量均升高,说明硝酸甘油导致神经源炎性痛敏性偏头痛可形成NGF、TrkA、TRPV1的高表达特点。藏药如意珍宝丸干预可使大鼠血清和中脑NGF、TrkA和TRPV1蛋白及基因表达下调,阻断NGF/TrkA-TRPV1通路,在NGF致痛途径上发挥抑制作用。见图3。
硝酸甘油可激活一氧化氮合酶(iNOS),促使一氧化氮(Nitric Oxide,NO)生成,NO通过血脑屏障激活神经元导致中枢敏化,释放降钙素基因相关肽(Calcitonin Gene-related Peptide,CGRP)、P物质(Substance P,SP)等神经肽,而CGRP可诱导iNOS表达增加,形成持续痛觉的闭合回路;NO亦可致硬脑膜炎性反应,使NGF释放增加。NGF致痛途:与TrkA结合,通过PLC模型和PI3K模型激活TRPV1通道后,TRPV1敏化释放CGRP、SP,引发脑膜血管扩张形成头痛,同时CGRP、SP又刺激TRPV1敏感活性,降低疼痛阈值;NGF还可直接上调CGRP、SP及激活5-羟色胺(5-HT)、前列腺素(PGE2)、组胺来诱导疼痛。藏药如意珍宝丸抑制神经源炎性痛敏性偏头痛通过1)直接抑制TRPV1,阻断痛敏性神经肽的产生;2)调降NGF、TrkA含量,阻断敏化TRPV1的通路,降低NGF对CGRP、PEG2等致敏因子的促进作用。
3 讨论
神经生长因子作为典型的神经营养因子,广泛分布于大脑皮质、海马区、基底前脑Meynert核和纹状体等胆碱能神经元丰富区域[20],除营养神经、促进交感神经元再生长作用外,也参与了疼痛的产生过程。硝酸甘油生成的NO能造成硬脑膜炎性反应,有研究显示NGF在炎性反应中释放增多[21],伤害性刺激如热痛觉亦可致NGF升高[22],而NGF导致偏头痛发作的因素主要是其过表达能导致伤害感觉神经元的SP、CGRP上调,以敏化神经元[21],亦可激活炎性反应因子如5-HT、PGE2、组胺等,诱导疼痛发生[23]。NGF介导离子通道的致痛机制是通过与其高亲和力受体酪氨酸激酶A(TrkA)结合,激活伤害感受器而引起疼痛。NGF作为TRPV1通路的上游调控因子,可导致TRPV1敏化的途径有二:其一通过NGF和TrkA受体结合,可激活痛觉神经元磷脂酶C(PLC),水解成PIP2,致使TRPV1阈值降低[23];其二借助NGF与TrkA受体结合,在磷脂酰肌醇3-激酶(PI3K)介导下,刺激TRPV1向质膜转运,造成胞膜电流通道数量增多[24]。且NGF的痛敏诱导作用具有TRPV1依赖性,在TRPV1基因敲除小鼠中并不存在[25]。TRPV1作为主要的痛觉敏化感受器之一,被激活后可使SP、CGRP等神经肽类释放,导致神经源性炎性反应产生,而某些炎性反应因子又可活化TRPV1通道,促使外周敏化程度增加,形成相互作用的炎性闭合连锁反应,使疼痛易感性增强[26]。Gouin.O等[27]研究发现炎性反应可使TRPV1水平明显升高,炎性反应缓解后其表达降低。本实验Elisa结果显示,与空白组比较,偏头痛模型组各指标表达上调,NGF、TrkA含量升高与TRPV1变化一致,表明TRPV1敏化源于NGF和TrkA的增加和结合,高NGF含量导致了偏头痛的发生,与相关研究证实一致[28]。与模型组比较,各药物干预组NGF、TrkA、TRPV1含量都下降,其中阳性药物琥珀酸舒马普坦组和如意珍宝丸治疗2组对NGF和TrkA含量表达的降低作用显著,而如意珍宝丸预防组血清TRPV1含量最低,NGF和TrkA水平也下调明显,说明抑制NGF与TrkA的增加激活可阻止TRPV1通道开放,进而缓解疼痛,并代替发挥了受损神经元保护作用,且推测如意珍宝丸的预防作用可能也与抑制TRPV1通道的开放有关。
中脑导水管周围灰质(PAG)包含一系列炎性反应因子、神经肽类、神经递质等,是重要的痛觉整合中枢,其神经递质的水平变化,会导致PAG结构功能障碍,影响其对偏头痛中枢疼痛的调控,某种程度上可能导致对偏头痛发作的“放行”[29]。本实验RT-PCR结果显示,与空白组比较,模型组中脑组织NGF、TrkA、TRPV1 mRNA含量都明显升高,表明PAG中存在此类神经肽,中脑NGF、TrkA的变化是介导TRPV1促使偏头痛发生的因素。与模型组比较,各药物组3个指标都呈降低趋势,如意珍宝丸治疗2组NGF、TrkA下降明显,而阳性药组、如意珍宝丸预防组、治疗1组和治疗2组TRPV1含量和模型组差异有统计学意义。中脑组织中几种神经肽的表达特征与外周血清结果基本一致,提示硝酸甘油诱发偏头痛模型组PAG区的炎性反应,易化神经系统TRPV1的激活是PAG区NGF结合TrkA受体上调介导大鼠偏头痛样症状发作的机制之一。结果也表明如意珍宝丸可作用于PAG区,通过NGF/TrkA—TRPV1通路发挥中枢镇痛的效用。其中如意珍宝丸预防组对3项指标的蛋白和基因表达都显示出良好稳定的调控作用,证明该药对偏头痛的发生能够起到显著的预防效果。
偏头痛的主要病机为风邪上扰、经络不通,而藏药如意珍宝丸的重要成分包含诃子、红花、珍珠母、沉香、木香、丁香等,具有行气止痛、祛风通络的作用[30]。现代药理研究也揭示了其中某些药物在头痛治疗上的药效机制,如Uzar.E等[31]研究证明诃子提取物可以影响神经组织BNDF和SOD的含量,发挥神经保护作用;李秋宇[32]、宋丽娟[33]发现红花黄色素A能下调炎性反应细胞因TNF-α,IL-1β水平,降低NO含量,产生抗炎效果;木香有效成分可减少NO产生、抑制TNF-α活性;沉香正丁醇部位有明确镇痛活性等[34]。本团队前期实验通过热板法和扭体法证实了如意珍宝丸有良好的镇痛抗炎效果,推测其或通过以上药物成分对神经源炎性偏头痛发挥抑制作用。但具体作用靶点不甚明晰,是否与其他通路相关还需进一步研究。
综上所述,NGF、TrkA、TRPV1存在于PAG中,其含量的升高可致硝酸甘油偏头痛模型大鼠頭痛的发生。藏药如意珍宝丸可显著降低下行痛觉调制系统NGF、TrkA、TRPV1含量,抑制上游NGF、TrkA受体,阻断NGF/TrkA—TRPV1通路,对治疗神经源炎性痛敏性偏头痛有显著疗效和预防作用。
参考文献
[1]聂玲辉,伍志勇.偏头痛发病机制及治疗的研究进展[J].中国民间疗法,2018,26(14):106-108.
[2]武鹏,罗远带,甄丽芳,等.如意珍宝丸药理及临床研究进展[J].中国民族民间医药,2016,25(7):31-32,34.
[3]王海苹.藏药如意珍宝丸临床应用现状[J].中国民族医药杂志,2014,20(1):46-49.
[4]蔡卓.藏药如意珍宝丸治疗三叉神经痛56例[J].中国民族医药杂志,2001,7(1):32.
[5]多杰,胡清文.如意珍宝丸治疗白脉病(神经性疼痛)219例临床观察[J].内蒙古中医药,2009,28(19):17-18.
[6]赵彦.藏药如意珍宝丸治疗带状疱疹后遗神经痛43例观察[J].中国民族医药杂志,2016,22(2):5-6.
[7]陈东,陈爱芳,张金荣,等.活络效灵汤联合瓜蒌薤白半夏汤对痰阻血瘀型冠状动脉粥样硬化性心脏病患者血栓风险相关指标的影响[J].中国医药,2018,13(6):818-821.
[8]宋慧荣,罗亚敏,任小巧,等.藏药如意珍宝丸镇痛抗炎作用的实验研究[J].高原科学研究,2018,2(2):87-92.
[9]Chiara Demartini,Cristina Tassorelli,Anna Maria Zanaboni,et al.The role of the transient receptor potential ankyrin type-1(TRPA1)channel in migraine pain:evaluation in an animal model[J].The Journal of Headache and Pain,2017,18(1):1-9.
[10]朱倩林,于布为.TRPV1在疼痛治疗中的作用及研究进展[J].国际麻醉学与复苏杂志,2010,31(2):159-162.
[11]刘欣.偏头痛大鼠硬脑膜及三叉神经节上TRPV1的表达变化[D].南京:南京医科大学,2012.
[12]易桂标,杨丽.中脑导水管周围灰质在偏头痛的作用[J].中国医药指南,2013,11(19):481-483.
[13]刘若卓,于生元.中脑导水管周围灰质在大鼠血管源性头痛模型中的作用[J].中华神经医学杂志,2005,4(7):672-676.
[14]Enza Palazzo,Francesco Rossi,Sabatino Maione.Role of TRPV1 receptors in descending modulation of pain[J].Molecular and Cellular Endocrinology,2008,286(1):s79-s83.
[15]Diego Cardozo Mascarenhas,Karina Santos Gomes,Ricardo Luiz Nunes-de-Souza.Role of TRPV1 channels of the dorsal periaqueductal gray in the modulation of nociception and open elevated plus maze-induced antinociception in mice[J].Behavioural Brain Research,2015,292:547-554.
[16]A.F.Almeida-Santos,F.A.Moreira,F.S.Guimares,et al.Role of TRPV1 receptors on panic-like behaviors mediated by the dorsolateral periaqueductal gray in rats[J].Pharmacology,Biochemistry and Behavior,2013,105:166-172.
[17]Aguiar Daniele C,Almeida-Santos Ana F,Moreira Fabricio A,et al.Involvement of TRPV1 channels in the periaqueductal grey on the modulation of innate fear responses[J].Acta neuropsychiatrica,2015,27(2):97-105.
[18]Ieda Masaki,Kanazawa Hideaki,Ieda Yasuyo,et al.Nerve growth factor is critical for cardiac sensory innervation and rescues neuropathy in diabetic hearts[J].Circulation(Baltimore),2006,114(22):2351-2363.
[19]熊文萍.TRPV1受体与偏头痛关系的实验研究[D].济南:山东大学,2011.
[20]李媛,邵金贵.神经生长因子与脑的研究进展[J].医学综述,2008,14(22):3394-3396.
[21]Mantyh P W,Koltzenburg M,Mendell L M,et al.Antagonism of nerve growth factor-TrkA signaling and the relief of pain[J].Anesthesiology,2011,115(1):189-204.
[22]Nishigami T,Osako Y,Ikeuchi M,et al.Development of heat hyperalgesia and changes of TRPV1 and NGF expression in rat dorsal root ganglion following joint immobilization[J].Physiol Res,2013,62(2):215-219.
[23]罗妮,郑卫红.神经生长因子致痛机制的研究进展[J].广东医学,2014,35(11):1784-1786.
[24]Alexander T.Stein.Carmen A.Ufret-Vincenty,Li Hua,et al.Phosphoinositide 3-Kinase Binds to TRPV1 and Mediates NGF-stimulated TRPV1 Traffi cking to the Plasma Membrane[J].The Journal of General Physiology,2006,128(5):509-522.
[25]Chuang H H,Prescott E D,Kong H,Shields S,et al.Bradykinin and nerve growth factor release the capsaicin receptor from PtdIns(4,5)P2-mediated inhibition[J].Nature,2001,411(6840):957-962.
[26]Jannis E.Meents,Lars Neeb,Uwe Reuter.TRPV1 in migraine pathophysiology[J].Trends in Molecular Medicine,2010,16(4):153-159.
[27]Gouin O,L′Herondelle K,Lebonvallet N,et al.TRPV1 and TRPA1 in cutaneous neurogenic and chronic inflammation:pro-inflammatory response induced by their activation and their sensitization[J].Protein & cell,2017,8(9):644-661.
[28]馬振晓.吗啡预处理调控NGF诱导的神经细胞TRPV1通道敏化的作用及信号机制[D].合肥:安徽医科大学,2018.
[29]易桂标,杨丽,郝仁方,等.青藤碱对偏头痛模型大鼠中脑导水管周围灰质区NF-κB和COX-2表达的影响[J].中成药,2015,37(3):678-681.
[30]罗亚敏,任小巧,等.藏药如意珍宝丸20年研究进展[J].中国民族医药杂志,2017,23(7):69-72.
[31]Uzar Ertugrul,Alp Harun,Cevik Mehmet Ugur,et al.Ellagic acid attenuates oxidative stress on brain and sciatic nerve and improves histopathology of brain in streptozotocin-induced diabetic rats[J].Neurological Sciences,2012,33(3):567-574.
[32]李秋宇.红花黄色素A对脓毒症大鼠血清细胞因子的调控和凝血机能的影响[D].昆明:云南中医学院,2015.
[33]宋丽娟,王青,姜维佳,等.红花黄色素对实验性自身免疫性脑脊髓炎小鼠脾细胞的作用[J].中华中医药杂志,2018,33(10):4389-4394.
[34]魏华,彭勇,马国需,等.木香有效成分及药理作用研究进展[J].中草药,2012,43(3):613-620.
