培养基和植物生长调节剂对油木奈种胚培育效应
2020-06-19陈洁刘瑾航李永裕吴少华廖汝玉
陈洁 刘瑾航 李永裕 吴少华 廖汝玉


摘要:[目的]筛选适宜不同状态油榇种胚的胚培育条件,提高种胚萌发率。[方法]以福建特色果树油榇为试验材料,分析油榇种胚状态、培养基种类以及植物生长调节剂对油榇种胚萌发的影响,筛选出合适的培养基及植物生长调节剂组合进行胚培育,提高种胚的萌发率。[结果]在不添加植物生长调节剂的条件下,接种于WPM培养基的半败育种胚最高的萌发率为40.00%;在添加植物生长调节剂的条件下,接种于WPM培养基添加2.0mg·L-16-BA+0.1mg·L-1IBA(6号)的半败育种胚都有着最高的萌发率,为46.67%。完整种胚的最高萌发率为100.00%,分别为不添加任何植物生长调节剂的WPM培养基、MS培养基或添加1.0mg·L-16-BA+0.1mg·L-1NAA(2号)、2.0mg·L-16-BA+0.2mg·L-1NAA(3号)、2.0mg·L-16-BA+0.1mg·L-1IBA(6号)的WPM培养基。
[结论]最适宜油榇种胚萌发的是WPM培养基+2.0mg·L-16-BA+0.1mg·L-1IBA,且完整胚的萌发率都要高于半败育的萌发率。不添加植物生长调节剂的WPM培养基和MS培养基也都具有较好的萌发效果。
关键词:油榇,种胚,植物生长调节剂,培养基,离体培养
中图分类号:S662.3文献标志码:A 文章编号:1008-0384(2020)03-0303-06
0 引言
(研究意义)油木奈是福建特色名果,在福建古田、浦城等地大量种植。油榇除鲜食外,还可制棕干、罐头、蜜饯等,发展前景广阔。核果类果树的早熟品种常因果实发育期短,胚发育不成熟,很难获得成熟的种胚。不成熟种胚不利于通过常规层积播种成苗,是核果类早熟新品种选育的主要障碍因子。油榇种胚在果实发育过程中败育现象明显,影响油木奈产业的发展。胚培育技术是克服油榇种胚败育的关键技术,通过培养基和植物生长调节剂处理挽救即将败育或已经发生败育的种胚,提高品种的萌芽率和成苗率。胚培育不受季节等限制,能在短时间内产生大量的具有优良遗传性状的苗木,满足市场的各种需求,也可进一步为组织培养、细胞培养及遗传转化提供原始材料。此外,胚培育可以克服杂交育种中杂种胚发育不良的问题,缩短育种年限,为关于油木奈的科学研究快速发展提供帮助。(前人研究进展)前人研究发现桃属、李属等核果类果树使用较多的为SH、MS、1/2MS和White培养基。在无植物生长调节剂的WPM和MS培养基上,油榇成熟胚能萌发形成一定数量的小苗。剥去种皮的成熟胚萌芽率高于带种皮的成熟胚,光照有利于成熟胚的萌发和发育。核果类果实胚培需要经历一段时间的低温。朱学文等研究发现WPM培养基中附加5、8、10mg·L-1的6-BA均能有效打破种子的休眠,不需低温贮藏。此外,胚挽救应该选择在胚发育程度较高,即将开始败育的时期,有利于提高胚培成功翠,桃和杏胚培养成功的例证较多。(本研究切入点)目前,油木奈主要通过种胚培养诱导出胚性愈伤组织,并建立继代保持体系来进行油榇种胚的离体培养,但较少研究油榇种胚萌发直接成苗的种胚离体培养,以及不同培养基和植物生长调节剂组合对油木奈种胚萌发的影响。油木奈种胚在发育过程中,中途败育是普遍现象,而对油木奈种胚培育技术缺乏相关研究。在近年的杂交育种实践中,克服种胚败育的影响已成为棕李育种成败的关键。(拟解决的关键问题)本研究以油木奈种胚为试验材料,筛选不同状态油榇种胚合适的培养基及植物生长调节剂组合,提高种胚的萌发率。以期建立胚培育技术体系,为杂交育种服务。
1 材料与方法
1.1材料与仪器
1.1.1试验材料 油木奈果实取自福建省宁德市古田县湖滨镇常坝村。
1.1.2仪器与试剂 WPM(Lloyd&McCown WoodyPlant Basal Medium with Vitamin)培养基(为PhytoTechnology公司的产品)、MS(Murashig and SkoogMedium)培养基、SH(Schenk&HildebrandtMedium)培养基。氯化汞、吐温60、乙醇、蔗糖均为分析纯。6-苄氨基腺嘌呤(6-BA)、吲哚丁酸(IBA)、萘乙酸(NAA)均为上海源叶生物科技有限公司产品,琼脂粉为北京康倍斯(chembase)科技有限公司产品。
恒温培养室(铁架台和控温控光控湿设施)、超净工作台、接种器械灭菌器、镊子、解剖刀、高压灭菌锅、人工气候箱、日本岛津电子分析天平、梅特勒-托利多pH计、电磁炉、培养瓶、玻璃棒、接种盘等。
1.2 试验方法
1.2.1 采样与种胚处理 采样日期为2018年6月6日,采样地点位于福建省宁德市古田县湖滨镇常坝村试验基地。在基地内选取3个试验小区,每个小区选定3颗树龄相同、树势基本一致的试验树作为试验样品采集的对象。在每株油木奈果树的东南西北4个方向,高度基本一致的树冠外围各摘取一定数量、大小均匀一致的油榇。采样在气候良好的上午采摘,采摘后立即送往实验室进行清洗,用枝剪剪开果肉,剪破果核取出种胚。记录下种胚(胚乳)发育状态,以胚乳大小界定种胚的败育情况:胚乳大小>3/4正常胚乳为完整种胚;胚乳大小1/2至3/4正常胚乳,为半败育种胚;胚乳<1/2正常胚乳为败育胚。
1.2.2培养基的配制灭菌 分别配制MS培養基、WPM培养基、SH培养基等3种不同类型的培养基,3种培养基添加不同植物生长调节剂,分别为6-BA(0.0、1.0、2.0mg·L-1)、IBA(0.0、0.1、0.2mg·L-1)、NAA(0.0、0.1、0.2mg·L-1),正交试验设计,每种培养基共有9组植物生长调节剂组合(表1)。每种培养基分别加入的蔗糖皆为30g·L-1,加入琼脂量分别为10g·L-1、9g·L-1、7g·L-1,pH皆调为6.0.
培养基加入蔗糖配制后,调节溶液pH至6.0,再将溶液倒人锅内,加人称量好的琼脂粉,进行加热煮沸至琼脂完全溶解后,关闭加热的电磁炉,将溶液分装入培养瓶中,并用标签纸在瓶盖上做好标记,记录配制日期,配制瓶数等信息。将分装好的培养瓶、无菌水、滤纸、用棉布包好的接种盘等放人高压灭菌锅内在121℃下高压灭菌20min.高压过后取出培养基等物品置于常温下,2~3d后观察培养基的污染情况并及时剔除受污染的培养基。植物生长调节剂组合编号为1-9.
1.2.3 油捺种胚消毒方法 将油木奈种胚、无菌水、接种盘、滤纸、废液瓶、镊子、解剖刀、配制好的培养基等物品放人超净工作台紫外消毒杀菌20min,将超净工作台紫外灯消毒过的种胚经无菌水冲洗1-2次,加入75%酒精消毒30s,无菌水冲洗2~3次,加入0.1%的升汞水和2~3滴吐温60消毒8min,消毒过程中不停摇晃装有种胚的玻璃瓶,使消毒药剂与种胚充分接触,减少污染的发生,继续用无菌水冲洗3~4次种胚。
1.2.4接种及低溫培养 将消毒好的完整种胚和半败育种胚分别接种人培养瓶中,完整种胚接种5瓶,半败育种胚接种7瓶,每瓶培养基接种2粒种胚,共重复3次。接种后放人4-8℃的冷库进行低温培养,110d后统计萌发率并转入恒温培养室后继续进行培养。恒温培养室温度为25℃,光照强度1500~2000Lx,湿度70%~80%,光暗周期为12-12h.
1.3 数据统计与分析
数据处理由Excel和SPSS 22.0软件完成。
2 结果与分析
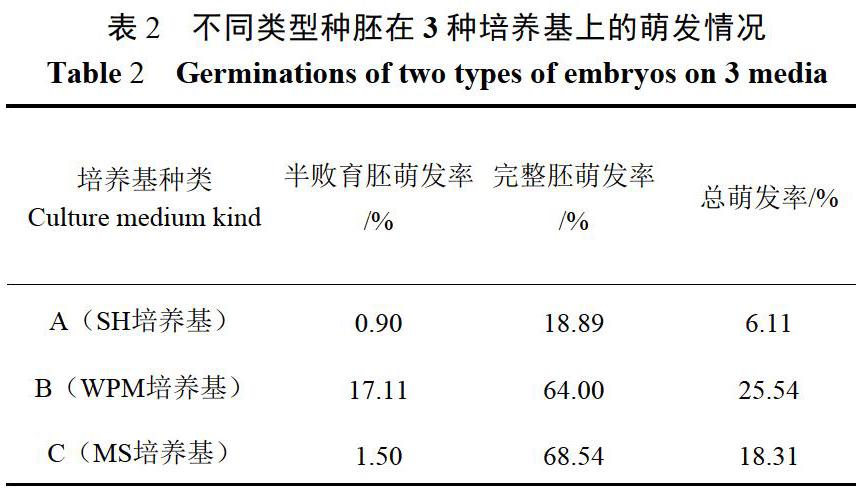
2.1 不同种胚和培养基类型的胚培萌发率
油榇种胚接种在培养基置于低温培养110d后,调查油榇种胚的萌发情况(表2)。半败育胚的萌发率最高为17.11%(WPM培养基),最低为0.90%(SH培养基);完整胚的萌发率最高为68.54%(MS培养基),最低为18.89%(SH培养基)。半败育胚的最高萌发串低于完整胚的最低萌发率(17.11%<18.89%)。完整胚的萌发率都高于半败育种胚的萌发率,这可能是由于饱满完整的种胚中含有更多的营养物质和合适比例的植物生长调节剂促进了种胚的萌发,完整种胚比半败育种胚有更大的萌发潜力。最适合半败育胚萌发的培养基是WPM培养基,最适合完整胚萌发的是MS培养基。
2.2 植物生长调节剂处理下SH培养基中油木奈种胚的萌发情况
9组植物生长调节剂组合条件下,种胚的萌发率各有差异,见表3.1号组合为对照(CK),不添加任何植物生长调节剂。3号(2.0mg·L-16-BA+0.2mg·L-1NAA)植物生长调节剂加入SH培养基后半败育种胚的萌发率为3.33%,其他植物生长调节剂组合半败育种胚的萌发率都为0.00%。SH培养基中完整种胚的萌发率由高到低分别为6号(61.90%)、8号(50.00%)、4号(30.95%)、5号(14.29%)、7号(9.52%)、9号和2号(7.14%),其它植物生长调节剂组合完整种胚的萌发率都为0.SH培养基半败育种胚的萌发率比较低,添加植物生长调节剂完整种胚的萌发率最高也只有61.90%,这可能说明SH培养基并不适合油木奈半败育种胚的萌发。
2.3 植物生长调节剂处理下WPM培养基中油木奈种胚的萌发情况
如表4,WPM培养基中6号植物生长调节剂组合(2.0mg·L-16-BA+0.1mg·L-1IBA)和未添加任何植物生长调节剂的对照组的半败育胚的萌发率较高,半败育胚萌发率分别为46.67%、40.00%。WPM培养基中完整胚萌发率为100%的植物生长调节剂组合分别为2号(1.0mg·L-16-BA+0.1mg·L-1NAA)、3号(2.0mg·L-16-BA+0.2mg·L-1NAA)、6号(2.0mg·L-16-BA+0.1mg·L-1IBA)和未添加任何植物生长调节剂的对照组。除了这4组植物生长调节剂组合,WPM培养基中完整种胚萌发率较高的还有7号(76.19%)、8号(61.91%)、5号(50.00%)。综合来看,WPM培养基中,适合油榇种胚萌发的组合为添加2.0mg·L-16-BA+0.1mg·L-1IBA的6号植物生长调节剂组合、添加2.0mg·L-16-BA+0.2mg·L-1NAA的3号和未添加任何植物生长调节剂组合的对照组。
2.4 植物生长调节剂处理下MS培养基中油榇种胚的萌发情况
如表5,MS培养基中半败育种胚的萌发率最高为6号(2.0mg·L-16-BA+0.1mg·L-1IBA)的植物生长调节剂组合,萌发率为6.67%,3号和9号植物生长调节剂组合萌发率为3.33%,其他植物生長调节剂组合的半败育胚的萌发率都为0.完整种胚的萌发率由高到低分别为1号(90.48%)=3号(90.48%)>9号(80.95%)>6号(71.43%)>7号(57.14%)=8号(57.14%)>5号(50.00%)>2号(0.00%)=3号(0.00%)。MS培养基中,不添加植物生长调节剂的对照组和添加4号、9号或6号植物生长调节剂组合接种的完整胚有比较好的萌发效果。
2.5 添加植物生长调节剂处理油木奈种胚的萌发情况
汇总3种培养基都添加同一种植物生长调节剂组合的数据,见表6,添加了6号(2.0mg·L-16-BA+0.1mg·L-1IBA)的植物生长调节剂组合对半败育种胚和完整种胚都有最高的促进萌发效果,未添加植物生长调节剂的对照组半败育种胚和完整种胚也有仅次于6号植物生长调节剂组合的效果。添加4号(0.1mg·L-1IBA+0.1mg·L-1NAA)植物生长调节剂组合有仅次于l号对照组的萌发效果。不管油木奈种胚的状态如何,在对照组1号,6号(2.0mg·L-16-BA+0.1mg·L-1IBA)和4号(0.1mg·L-1IBA+0.2mg·L-1NAA)的组合下,种胚的萌发率是最高的。在种胚半败育的状态下,6号植物生长调节剂以及对照组l号,种胚的萌发率差异不显著,但都高于4号植物生长调节剂的萌发率。在种胚完整饱满的胚情况下,6号植物生长调节剂的萌发率却大于1号和4号植物生长调节剂的萌发率。综合来看,在实验操作最方便和费用经济上可以选择不添加植物生长调节剂的培养基,若添加植物生长调节剂,则可选择6号或4号植物生长调节剂的组合。
3 讨论
油榇种胚严重败育对油木奈的繁殖造成一定的影响,挽救即将败育的种胚成为必要。在不添加植物生长调节剂的情况下,接种于SH培养基的完整种胚和半败育种胚萌发率均为0.00%;接种于MS培养基的半败育种胚和完整种胚的萌发率分别为0.00%和90.48%;接种于WPM培养基的半败育种胚和完整种胚的萌发率分别为40.00%和100.00%。接种于WPM培养基油榇种胚的萌发效果要好于MS培养基和SH培养基,这与万春雁等的研究结果大致相同。这可能是WPM培养基为木本植物的培养基,比较适宜木本植物油榇的种胚的萌发。接种于SH培养基的半败育种胚的萌发率都比较低,SH培养基可能不适合油木奈半败育种胚的萌发。在不添加植物生长调节剂刺激的条件下,种胚的生长只有靠着培养基的营养和自身的营养储备供给自身的萌发。在添加植物生长调节剂的条件下,完整胚的萌发率也基本保持着高于半败育种胚萌发率的情况,这可能是因为完整的种胚中含有更适宜种胚生长的内源激素以及更多贮存的营养物质。
影响胚培育效果的因素很多,本试验还有很多因素未能研究,例如胚龄、低温培养天数、低温培养温度、除本试验所研究的3种培养基和植物生长调节剂以外的其他培养基及植物生长调节剂组合的效果等。有研究表明胚龄越大,胚培成功率越高。本试验只选用了一个时期的不同种胚类型进行胚培育,油榇种胚随着果实的发育,胚败育逐渐增多,所以选择合适的时间进行胚培育非常重要。不同胚龄的不同种胚类型的适宜培养基及植物生长调节剂组合有待进一步研究。有人提出水解乳蛋白、酵母抽提液、活性炭对胚培育也有一定的影响。试验过程中会发现较少量种胚褐化,这可能是因为种子中由于较高含量的酚类物质,容易在胚培过程中褐化。有研究发现加入适量活性炭可以缓解种胚褐化的情况。核果类果树幼胚培育难度大,将延缓胚败育与胚挽救相结合,提高胚挽救的效率。
幼胚的胚培育是解决杂交胚败育的有效途径。胚培育既可以挽救油木奈种胚易败育的特点,也可以挽救早熟品种因发育期短造成的种胚败育或杂交育种不亲和,为培育新品种打下基础。油木奈种胚易败育,易产生空腔都是制约油木奈长远发展的因素。油棕种胚的败育也受内源激素的调控,添加合适的外源激素进行胚培育,有利于打破种子的休眠,促进种胚萌发。种胚败育在许多植物中普遍存在并一直是研究的热点,但种胚败育机制尚不明确。除了对种胚败育进行生理生化的研究,也需进一步加强对油木奈种胚败育分子机理的研究,并对控制种胚败育基因进行研究分析。此外,生产上也需加强对油榇种胚败育的控制性措施与试验研究。
4 结论
接种于WPM培养基添加2.0mg·L-16-BA+0.1mg·L-1IBA(6號)的半败育种胚都有着最高的萌发率,所以最适宜半败育种胚萌发的培养基为添加2.0mg·L-16-BA+0.1mg·L-1IBA的WPM培养基。适合完整胚萌发的培养基为不添加任何植物生长调节剂的WPM培养基,或添加1.0mg·L-16-BA+0.1mg·L-1NAA(2号)、2.0mg-L‘6-BA+0.2mg·L-1NAA(3号)、2.0mg·L-16-BA+0.1mg·L-1IBA(6号)的WPM培养基。综合来看,最适合油木奈种胚萌发的是添加2.0mg·L-16-BA+0.1mg·L-1IBA(6号)的WPM培养基。
