禽肉中利巴韦林残留量的不确定度评定
2020-06-19孙丽香
孙丽香
(厦门泓益检测有限公司,福建 厦门 361100)
利巴韦林是嘌呤核苷类似物,是广谱类强效抗病毒药物,对DNA病毒和RNA病毒均有抑制复制的作用[1],临床上主要用于病毒感染、单纯疱疹、麻疹、腮腺炎、水痘、带状疱疹等疾病的治疗。同时曾广泛应用于畜牧业和水产养殖业,用于预防和治疗禽畜类的病毒性疾病[2]。但是利巴韦林具有一定的毒副作用,长期违规使用可使病毒产生耐药,诱导耐药病毒的出现,影响人类病毒疾病的防治。并且利巴韦林具有遗传毒性、生殖毒性和致癌性等,可引起人体变态反应和造血系统功能障碍[3]。美国食品药物管理局(Food and Drug Administation,FDA)早于2005年就禁止将人类抗病毒药物用于畜禽类[4];而我国农业部公告第560号中也明确规定抗病毒类药物为禁用兽药[5]。但是仍有部分兽药企业违规生产,养殖业过量添加,从而导致利巴韦林药物在动源性食品中残留,危害人类健康[6]。如2012年“速成鸡”事件,养殖企业非法使用利巴韦林等违禁药物带来的食品安全问题,引起人们的普遍关注[7]。
目前国内外,检测利巴韦林的方法主要有免疫放射法[8],气相色谱-质谱法[9]、液相色谱法[10-14]、液相色谱-质谱法[15-20]等。关于发布的利巴韦林残留量的测定方法只有两个标准:SN/T 4519-2016 和DB32/T 1165-2007。本文分析了用液相色谱-串联质谱方法测定禽肉中利巴韦林测量结果的不确定度来源,对其进行分析和评定,从而给出利巴韦林测量结果的不确定度,以评估液相色谱-串联质谱方法测定利巴韦林方法的可靠性及测定结果的可信度。
1 实 验
1.1 材料与试剂
甲醇(色谱纯),美国天地;乙腈(色谱纯),美国天地;乙酸铵(优级纯),上海安谱;甲酸(优级纯),上海安谱;三氯乙酸(分析纯),国药集团;氨水(分析纯),国药集团;PBA苯硼酸固相萃取小柱(100 mg/3 mL),上海安谱;酸性磷酸酯酶,上海安谱;利巴韦林标准品(纯度97.5%),上海安谱;利巴韦林-13C5标准品(纯度98%),TRC;实验室超纯水。
1.2 仪器与设备
液相色谱三重四极杆串联质谱仪(配有电喷雾离子源),赛默飞世尔科技公司;涡旋混匀器,上海精科实业有限公司;高速冷冻离心机,上海菲恰尔分析仪器有限公司;pH计,赛多利斯;固相萃取装置、上海安谱氮吹仪,上海安谱;MS204S 电子天平,梅特勒托利多; XS105 电子天平,梅特勒托利多。
1.3 方 法
1.3.1 实验方法
1.3.1.1 标曲的配制
准确称量利巴韦林和利巴韦林-13C5标准品(精确至0.01 mg)配制成浓度分别为1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL的工作液,内标利巴韦林-13C5浓度为10.0 ng/mL的标准工作液。
1.3.1.2 样品的制备
称取鸡肉样品5 g(精确至0.01 g)于50 mL具塞离心管中,加入1 μg/mL利巴韦林-13C5内标工作液50 μL,再加入12 mL三氯乙酸溶液和2.5 mL乙腈,超声10 min,离心后提取上清液。再加入10 mL三氯乙酸溶液重复提取一次,离心后合并上清液定容至25 mL。准确移取5 mL上清液,加入1.0 mL乙酸铵溶液和100 μL酸性磷酸脂酶于37 ℃恒温干燥箱中酶解2 h。取出后冷却至室温,用氨水调pH值至8.5±0.1,混匀离心,取上清液经PBA固相萃取柱中净化,在45 ℃氮气吹干,最后用1 mL乙腈-水溶液(体积比90:10)溶解残渣,过0.22 μm滤膜,供液质联用仪测定。
1.3.1.3 色谱条件
色谱柱:Agilent ZORBAX SB-Aq柱(3.0×100 mm,1.8 μm)或相当者;
流动相:A:0.2%甲酸水溶液(3.18);B:乙腈(3.1),洗脱程序见表1。

表1 液相色谱梯度洗脱程序Table 1 Liquid chromatography gradient elution procedure
流速:0.3 mL/min;柱温:40 ℃;进样量:10 μL。
1.3.2 质谱条件
ESI正离子模式;多反应检测(SRM);毛细管电压:3800 kV;离子传输管温度:300 ℃。

表2 利巴韦林保留时间、定性定量离子对及碰撞能量Table 2 Retention time, qualitative and quantitative ion pairs and collision energy of the Ribavirin
2 数学模型建立
样品中利巴韦林含量计算公式如下:
式中:X——样品中利巴韦林含量,μg/kg
A——样品中利巴韦林的峰面积
c——标准溶液中利巴韦林的浓度,ng/mL
ci——样品中内标物利巴韦林-13C5的浓度,ng/mL
Asi——标准溶液中利巴韦林-13C5的峰面积
csi——标准溶液中内标物利巴韦林-13C5的浓度,ng/mL
Ai———样品中内标物利巴韦林-13C5的峰面积
As———标准溶液中利巴韦林的峰面积
V———样品的最终定容体积,mL
m———最终样品测定液中代表的试样质量,g
df———稀释倍数
采用内标法实验,可将上述公式简化为:
3 分析不确定度来源
通过测试方法及数学模型,其不确定度的主要来源有:配制标准曲线过程产生的不确定度μrel(C),样品称量产生的不确定度μrel(m),校准曲线拟合过程产生的不确定度μrel(X0),前处理过程中定容体积产生的不确定度μrel(V),液相色谱串联质谱仪定量校准引入的不确定度μrel(Y),重复实验性产生的不确定度μrel(frep)。各参数间影响相互独立,因此其相对合成标准不确定度μrel(X)为:
4 不确定度各分量的计算
4.1 试样测试过程中由重复性引入的不确定度
在鸡肉样品中加标,按同一前处理条件重复测定6次,测定结果见表3。
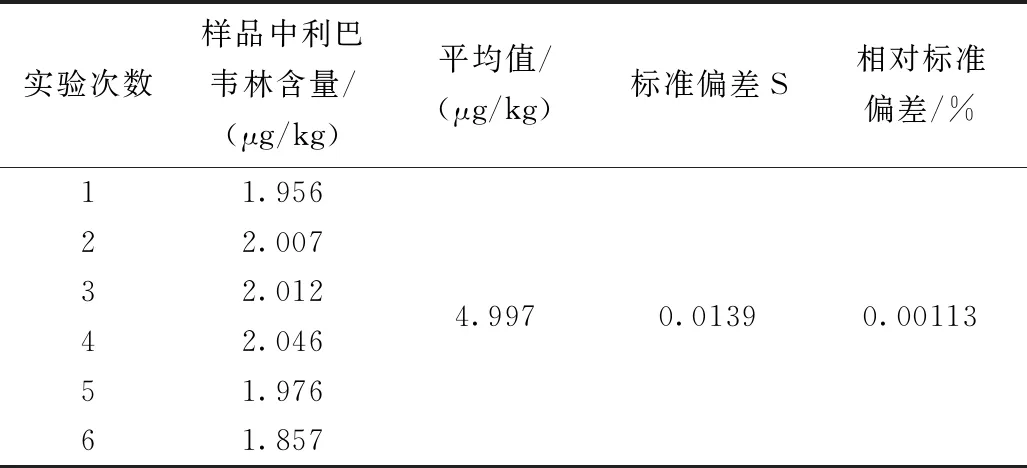
表3 样品中利巴韦林测定结果Table 3 Results of determination of ribavirin in samples
因此,由测量重复性引入的相对标准不确定度为:
4.2 试样称量时产生的不确定度
准确称量鸡肉样品5.00 g(精确至0.01 g),按均匀分布考虑,则称量试样产生的相对标准不确定度为:
4.3 前处理过程中定容体积引入的不确定度

4.4 液相色谱串联质谱仪定量校准引入的不确定度
根据液相色谱串联质谱仪的校准报告给出的扩展不确定度μrel=7%,K=2,因此,其产生的相对标准不确定度为:
μrel(Y)=0.07/2=0.035
4.5 标准曲线配制过程产生的不确定度
4.5.1 配制标准储备液产生的相对标准不确定度
(1)利巴韦林和利巴韦林-13C5标准品证书给出纯度分别为99.9%和98.9%,由标准品纯度引入的不确定度为:
(2)称取标准品利巴韦林和利巴韦林-13C5均是10.00 mg,天平允许的最大误差为±0.01 mg,取矩形分布,相对标准不确定度为:
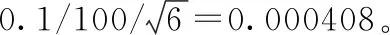
(4)合成的标准储备液配制的相对标准不确定度为:
=0.00649
4.5.2 配制标准中间稀释液所产生的相对标准不确定度

=0.00476
4.5.3 由标准中间液稀释配制标准工作液所产生的相对标准不确定度
配制标准工作液的过程中主要是由移液器和玻璃量器带入的不确定度,假设移液枪和容量瓶分别符合均匀分布和三角分布,则10、20、50、100、200 μL移液枪和10 mL A级容量瓶所产生的不确定度如表4所示。

表4 标准工作液所产生的不确定度Table 4 The uncertainty of the produces standard working solution preparation
由于配制利巴韦林标准溶液使用 10 mL容量瓶在配制过程中使用了5次,10、20、50、100、200 μL移液枪在各使用了1次,并且配制利巴韦林-13C5溶液使用100 μL移液枪使用了5次,因此配制工作液产生的合成相对标准不确定度为:
=0.0620
利巴韦林标准曲线配制过程所产生的相对标准不确定度为:
4.6 利巴韦林标准曲线拟合过程产生的不确定度
本实验中,分别配制了利巴韦林1.0、2.0、5.0、10.0、20.0 ng/mL的标准曲线,其中内标物利巴韦林-13C5浓度均为10 ng/mL,用最小二乘法拟合,可得标曲的曲线方程为Y=aC+b,见表5。

表5 利巴韦林的测定结果及拟合方程Table 5 Ribavirin determination results and fitting equations
其中,a=0.1025,b=0.0026,R2=0.999。
并且对于同一试样,平行测定6次,其试样的平均浓度为4.997 μg/mL(转化为5.00 μg/kg),则校准曲线拟合引入的相对标准不确定度μrel(C0)可由以下公式计算得到:
式中:a——拟合曲线斜率
p——样液测定的次数
m——利巴韦林标准溶液浓度测定的次数
n——利巴韦林标准溶液浓度点数
SY——拟合曲线标准偏差
Sc——拟合曲线各浓度的离均差平方和
Yij——各浓度点的响应值
Yi——由拟合曲线计算所得的响应值
Ci——标准曲线中利巴韦林各点浓度值
C0——样液中利巴韦林的平均浓度

由以上公式计算的结果见表6。

表6 最小二乘法拟合标准曲线产生的相对标准不确定度μrel(C0)Table 6 The unicertaintyμrel(C0) of least square curve fitting
5 样品合成标准不确定度、扩展不确定度
样品中利巴韦林的经各个不确定分度合成,即可得到其相对不确定:
=0.0749
合成标准不确定度:μ(X)=μrel(X)×X=0.0749×4.997 μg/kg=0.374 μg/kg,取包含因子k=2,置信概率95%,则扩展不确定度为:U(X)=2×0.374 μg/kg=0.748 μg/kg。
6 结 论
本实验采用液相色谱串联质谱法测定鸡肉样品中的利巴韦林,得出当k=2(置信度是95%)时,利巴韦林的不确定度可表示为(5.00±0.748)μg/kg,k=2。根据各个不确定的数值大小,可知此方法的主要不确定来源于液相色谱串联质谱仪,标准溶液的配制及校准曲线的拟合。因此,在做该项目的测试工作中,可以从以下几个方面降低其不确定度:(1)仪器需定期维护保养及校准;(2)标准品溶液的配制过程,操作要规范,或者尽可能采用精度更高的分度吸量管来配制溶液的标准曲线;(3)提高样品的均匀性及增加样品的测定次数。
