沉淀-光还原法制备Ag@AgCl/TiO2及其光催化性能*
2020-06-19于思嘉白绎炆刘公召
杨 航,于思嘉,白绎炆,刘公召,徐 舸
(沈阳工业大学理学院,辽宁 沈阳 110870)
近年来,环境污染和能源短缺问题日趋严重。光催化技术能够直接利用太阳光对污染物进行降解,利用清洁可再生的太阳能解决环境污染问题,对可持续发展具有重要意义[1-2]。在众多的半导体光催化材料中,二氧化钛因其无毒、成本低、化学稳定性好而备受广大研究者的青睐[3]。然而,二氧化钛的禁带宽度(3.2 eV)较大,只能吸收紫外光,而在太阳光中仅含5%的紫外光,极大地限制了其对太阳能的利用率。此外,在二氧化钛中光激发产生的光生电子和空穴极易复合是影响其光催化性能的关键因素[4]。需对二氧化钛进行改性以提升其光催化效率,主要方法有贵金属沉积、半导体复合、金属离子的掺杂和非金属掺杂[5-6]。
近几年,Ag@AgX(Cl,Br和I)作为活性组分用于改性半导体光催化剂引起了人们的广泛关注。贵金属Ag能在可见光的作用下产生表面等离子体共振效应,从而扩大对可见光的吸收范围[7]。Ag@AgX与半导体材料的复合可以形成异质结结构,有利于提高光生电子和空穴的分离效率[8]。基于Ag@AgX改性的等离子体光催化剂的研究较多,如Ag@AgCl/Bi2WO6[9],Ag@AgCl/K2Ti4O9[10],Ag@AgCl/ZnO[11]。而直接改性TiO2则不常见,Gan等[12]采用原位离子交换的方法,在TiO2纳米片表面沉积Ag@AgCl纳米粒子,制备了Ag@AgCl/TiO2复合光催化剂,光催化降解甲基橙的一级动力学研究表明,Ag@AgCl/TiO2的降解速率约是TiO2纳米片的2.3倍。
本文通过采用沉淀-光还原的方法将Ag@AgCl负载于二氧化钛表面,成功制备得到Ag@AgCl/TiO2复合光催化剂。通过在可见光的照射下降解罗丹明B(RhB)以研究Ag@AgCl/TiO2样品的光催化性能。
1 实 验
1.1 实验药品
二氧化钛(分析纯),天津市瑞金特化学品有限公司;硝酸银(分析纯),天津市大茂化学仪器供应站;氨水(分析纯,25%)、浓盐酸(分析纯),国药集团化学试剂有限公司;乙二胺四乙酸(分析纯,33%)、无水乙醇(分析纯),天津市富宇化工有限公司。
1.2 系列光催化剂的制备
(1)将0.6 g TiO2加入40 mL去离子水中超声振动30 min。随后,将0.8 g AgNO3溶解于4.6 mL NH3.H2O溶液后,将其缓慢地滴加至TiO2-H2O混合液中并搅拌10 min制得混合液T1。随后,将3 mL浓盐酸加入60 mL去离子水中制得HCl溶液,在搅拌下将所制HCl溶液缓慢滴加到混合液T1中制得混合液T2。在室温下搅拌24 h后,加入少量EDTA,然后调节pH,最后,溶液在强烈搅拌下使用氙气灯照射90 min并控温25 ℃。抽滤,采用去离子水和乙醇洗涤去除杂质后,在60 ℃下真空干燥6 h获得产物Ag@AgCl/TiO2。
(2)按上述实验步骤,除去添加HCl溶液过程即可获得产物Ag/TiO2,将混合液T2室温搅拌24 h后直接抽滤,采用去离子水和乙醇洗涤去除杂质,最后在60 ℃下真空干燥6 h获得产物AgCl/TiO2。对比分析Ag/TiO2、AgCl/TiO2和Ag@AgCl/TiO2复合材料的光催化降解性能。
1.3 光催化剂的表征
采用MiniFlex 600型X射线衍射仪(XRD)分析材料的晶体结构。使用SU8010N型扫描电子显微镜(SEM)观察材料的表面形貌。使用ESCALAB 250Xi型X射线光电子能谱(XPS)分析测定样品的元素价态等。使用TU-1950型紫外可见分光光度计(UV-Vis DRS)分析光催化剂的光吸收特性。使用上海棱光技术有限公司的F97XP型荧光分光光度计(PL)表征光催化剂的光致发光强度。
1.4 光催化活性实验
以罗丹明B为模拟污染物进行光催化实验,称取0.05 g制备的光催化剂倒入光催化反应瓶中,再向反应瓶中加入100 mL浓度为10 mg/L的罗丹明B溶液。在黑暗条件下将混合液磁力搅拌30 min,使催化剂与罗丹明B之间建立起吸附-脱附平衡,取样一次,记为0 min时的试样,然后将混合液放在氙灯模拟灯光下进行光催化降解实验,开启氙灯,开始进行光催化反应,反应器通入循环水以保证温度在25 ℃,并开始计时,每隔相同时间取样一次,将所取样品液离心后取其上清液,在染料最大波长下,用紫外可见分光光度计测其吸光度。
2 结果与讨论
2.1 光催化剂的表征
2.1.1 XRD表征
图1为所用原料TiO2及所制备产物的XRD图。由图1可看到,2θ值为25.4°,37.9°,48.1°,53.8°和62.7°处显示的衍射峰对应于锐钛矿型TiO2的(101),(004),(200),(105)和(204)晶面(JCPDS NO.21-1272)[3]。AgCl/TiO2样品的2θ值为27.8°、32.2°、46.2°、54.8°、57.5°、67.4°和76.6°处具有明显的衍射峰,对应于AgCl的(111)、(200),(220)、(311)、(222)、(400)和(420)立方相晶面(JCPDS NO.31-1238)[13]。而对于Ag/TiO2样品,在2θ值为44.3°和77.7°处微弱的峰以及38.1°和64.4°处的衍射峰则分别对应于立方相金属Ag的(200),(311),(111),(220)晶面(JCPDS NO.65-2871)[14]。在Ag@AgCl/TiO2样品的图谱中,没有发现明显的金属Ag的衍射峰,但XPS分析表明了样品中Ag的存在,说明光还原制得的Ag含量较少且分散度较大,在XRD图谱中只能看到微弱的峰值。在Ag@AgCl/TiO2的XRD曲线中,TiO2的吸收峰位置未发生变化,表明Ag@AgCl是负载在TiO2表面而未破坏其晶体结构。

图1 TiO2,Ag/TiO2,AgCl/TiO2和Ag@AgCl/TiO2的 XRD谱图Fig.1 XRD patterns of TiO2, Ag/TiO2, AgCl/TiO2 and Ag@AgCl/TiO2
2.1.2 SEM表征
图2为TiO2,Ag/TiO2,AgCl/TiO2和Ag@AgCl/TiO2的SEM图。图2(a)显示了纯TiO2的SEM图,图中TiO2呈不规则的块状。图2(b)显示了Ag/TiO2的SEM图,可明显看到有大量的Ag颗粒分布在块状TiO2表面,且Ag颗粒的粒径约为40~60 nm。图2(c)则显示了AgCl/TiO2的SEM图,从中可看到AgCl的不规则球形颗粒分散在块状TiO2表面,其粒径大约为100~150 nm。图2(d)所显示的是Ag@AgCl/TiO2的SEM图,其中存在粒径约为60 nm的颗粒,通过与图2(c)进行对比可发现,该颗粒可以是金属Ag颗粒,由此可知Ag@AgCl颗粒均匀沉积在TiO2表面。

图2 样品的SEM图Fig.2 SEM images of samples
2.1.3 XPS表征
图3是样品Ag@AgCl/TiO2的XPS图谱,其中图3(a)是Ag@AgCl/TiO2样品的XPS总图,表明样品中存在Ti、O、Ag、Cl元素。图3(b)显示的是TiO2中Ti元素的图谱,Ti 2p光谱在458.3 eV和464.9 eV处检测到两个明显的峰,归因于Ti4+的Ti 2p3/2和Ti 2p1/2自旋轨道分裂光子[15]。图3(c)显示了样品的O1s峰的结合能位于约529.9 eV处,归因于TiO2中的Ti-O[12]。在图3(d)中,Ag 3d光谱由大约位于373.4和367.2 eV处的两个峰组成,分别对应于Ag 3d3/2和Ag 3d5/2,另外,Ag 3d3/2和Ag 3d5/2的峰可进一步分别分成在373.2、374.1 eV和367.2、368.1 eV处的不同的峰,其中,在374.1eV和368.1eV处的峰对应于金属银的Ag 3d3/2和Ag 3d5/2[16],证实了金属Ag的存在,而AgCl中Ag+的Ag 3d3/2和Ag 3d5/2的峰则位于373.2eV和367.2 eV结合能处[17];由图3e显示可知,在约198 eV和199.8 eV处的两个峰分别对应于AgCl的Cl 2p3/2和Cl 2p1/2[18]。因此,XPS结合XRD、SEM证明,Ag和AgCl成功负载于TiO2表面。

图3 Ag@AgCl/TiO2光催化剂的XPS图Fig.3 XPS spectra of Ag@AgCl/TiO2 composite
2.2 催化剂的光催化性能
2.2.1 几种光催化剂的紫外-可见漫反射光谱
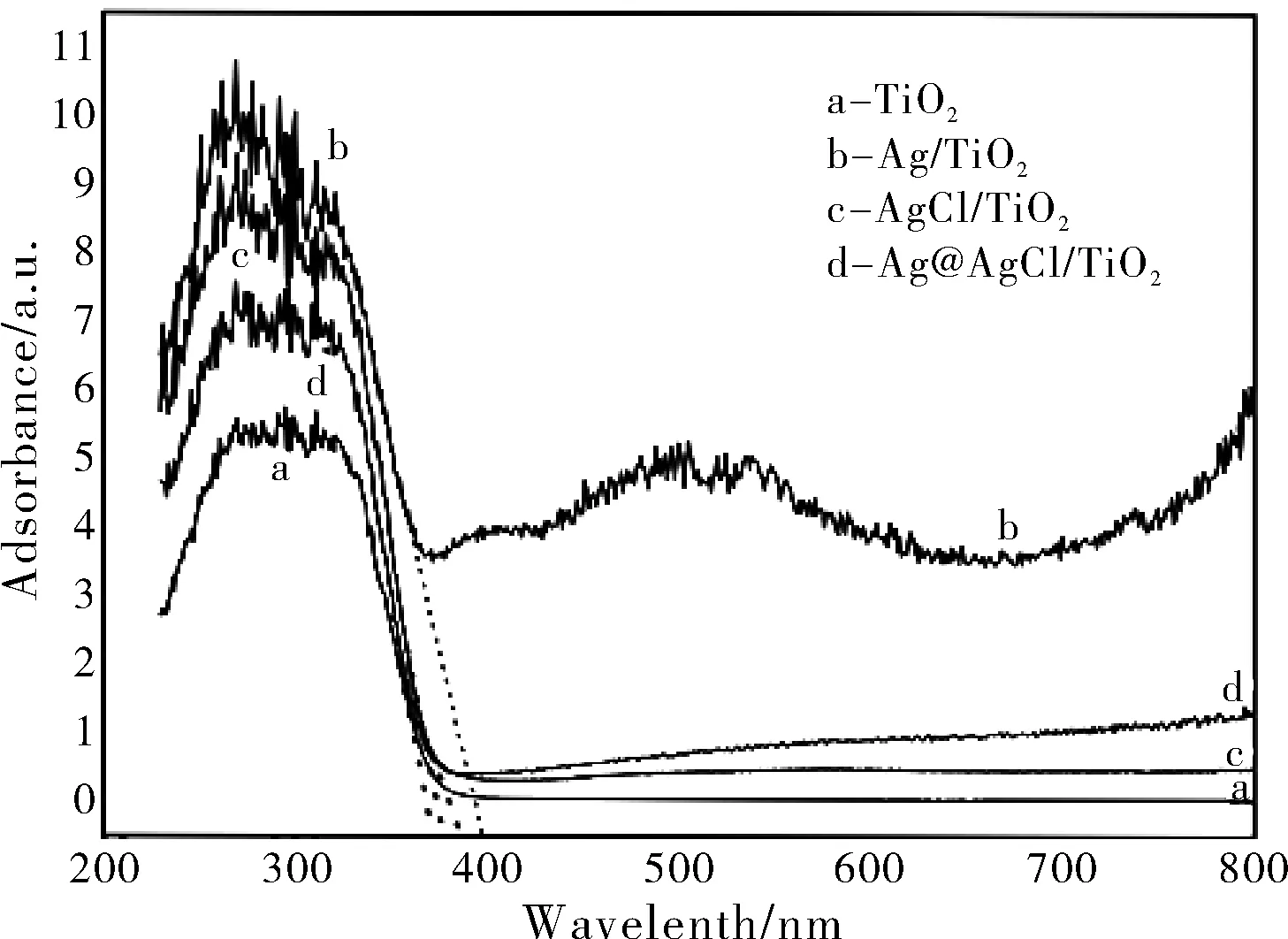
图4 TiO2,Ag/TiO2,AgCl/TiO2和Ag@AgCl/TiO2的 紫外可见漫反射光谱Fig.4 Uv-Vis diffuse reflectance spectra of TiO2, Ag/TiO2, AgCl/TiO2 and Ag@AgCl/TiO2
由图4可见,TiO2的光吸收能力最差,而Ag/TiO2的光吸收边最大且在可见光区的吸收强度最强,对可见光具有较强的吸收能力,归因于贵金属Ag的表面等离子体共振效应。相比于TiO2,AgCl/TiO2对光的吸收能力相对较强是因为AgCl与TiO2的复合对于提升光吸收范围有一定的作用。与Ag/TiO2相比,Ag@AgCl/TiO2的光吸收边及对可见光的吸收强度较低,主要因为如前所述,其光还原制得的金属Ag含量较少,因此对可见光的吸收能力不如Ag/TiO2;与AgCl/TiO2相比,虽然Ag@AgCl/TiO2对紫外光的吸收略低,但其光吸收边以及对可见光的吸收强度都相对较强。对于TiO2而言,Ag@AgCl体系显著提高了其对可见光的吸收能力。
2.2.2 样品的光致发光光谱

图5 TiO2,Ag/TiO2,AgCl/TiO2和Ag@AgCl/TiO2的 光致发光光谱Fig.5 Photoluminescence spectra (PL) of the TiO2, Ag/TiO2, AgCl/TiO2 and Ag@AgCl/TiO2
图5显示的是所制样品在320 nm激发波长下的光致发光光谱。由电子和空穴复合所得到的离子光谱,可以体现光生载流子的迁移情况[10]。如图4所示,在300~350 nm的范围内,曲线TiO2,AgCl/TiO2,Ag/TiO2和Ag@AgCl/TiO2的光致发光强度依次降低,表明光生电子和空穴的复合强度逐渐降低,提高了分离效率且Ag@AgCl/TiO2的效果最好。Ag@AgCl改性TiO2后,该三元体系之间能够形成异质结,使光生电子-空穴彼此迁移,难以复合,因此PL强度显著降低,有效的提高了光生载流子的分离及光催化活性。
2.2.3 样品在可见光照射下降解RhB的光催化活性

图6 样品的光催化性能Fig.6 Photocatalytic performance of the samples
由图6可知在30 min内,TiO2,Ag/TiO2,AgCl/TiO2和Ag@AgCl/TiO2的降解率分别为10.3%,23.2%,96.9%和99.5%。与TiO2和Ag/TiO2相比,Ag@AgCl/TiO2的光催化性能显著提高。相较于AgCl/TiO2,Ag@AgCl/TiO2的光催化性能只是略有提升,并不明显,主要因为所制得的金属Ag含量较少,没有充分发挥Ag@AgCl体系对TiO2进行修饰改性的作用。尽管如此,相比之下,Ag@AgCl/TiO2的降解效率仍然是最高的。可能因为一方面,金属Ag的表面等离子体共振效应提高了其对可见光的吸收范围;另一方面,Ag@AgCl体系与TiO2的结合增加了活性位点,并使得两者之间的界面形成异质结结构,有利于光生电子-空穴的分离。
2.2.4 光催化剂的稳定性
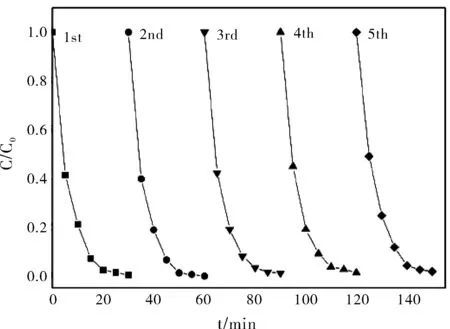
图7 Ag@AgCl/TiO2光催化剂催化降解RhB的循环实验Fig.7 Cycling runs for the photocatalytic degradation of the RhB in the presence of Ag@AgCl/TiO2 photocatalyst
催化剂的稳定性也是评价其光催化性能的重要标准。为了研究新制备的催化剂在光催化过程中的稳定性,将Ag@AgCl/TiO2进行连续5次重复降解RhB的实验。如图7所示,经过5次循环实验后,Ag@AgCl/TiO2催化剂的光催化效率无明显变化,因此可认为,Ag@AgCl/TiO2催化剂具有良好的稳定性。
3 结 论
本文采用沉淀-光还原法制备了Ag@AgCl/TiO2等离子体光催化剂,光催化实验表明30 min内,Ag@AgCl/TiO2对RhB的降解率为99.5%。其性能的提高主要归因于金属Ag的等离子体共振效应—增强了对可见光的吸收以及该三元体系之间的协同作用—促进光生电子和空穴的分离。通过循环实验表明Ag@AgCl/TiO2光催化剂具有良好的稳定性。
