最大程度保留黄酮成分的藜麦糖化工艺优化
2020-06-19刘鹤祥王如福
刘鹤祥,乔 羽,王如福
(山西农业大学食品科学与工程学院,山西太谷 030801)
藜麦(ChenopodiumquinoaWilld)被联合国粮农组织(FAO)推荐为最适合人类食用的全营养食品,研究表明藜麦单体植物即可满足人体的基本营养需求[1-2]。藜麦具有远超于其他谷物的营养价值,其蛋白质平均含量高达16.5%,其中主要有白蛋白(35%)和球蛋白(37%),淀粉含量约占藜麦籽实总重的55%~69%,且富含植物中普遍缺乏的赖氨酸、钙、镁、磷、钾、铁、锌、硒、锰、铜等[3-5]。众多研究[6-8]表明,藜麦的抗氧化性、降血糖功能、抗癌活性、降血脂及抗炎活性主要来源于藜麦中的黄酮类物质、植物多酚、蜕皮激素及藜麦皂苷等功能物质,故藜麦对人体代谢、肠胃功能、心脑血管均有明显益处[9-12]。
目前国内外的研究主要集中在藜麦的种植技术[13]、品质改良[14]、营养开发及功能成分提取[15-17]等方面。对于营养丰富的藜麦,已经不仅限于对其单独某种营养成分的提取,研究者更倾向于开发藜麦加工食品,其中藜麦发酵产品的研究也在日益增加,陈树俊等[18]利用植物乳杆菌及干酪乳杆菌发酵藜麦芽制成藜麦芽乳,卞猛[19]则研究了藜麦啤酒的酿造工艺等。藜麦中含有较多的活性功能成分,如果能在发酵产品中最大程度地保留这些物质,将更有利于实现最终产品的功能化。
糖化过程是调配型和发酵型藜麦产品制备过程中的重要环节,也是容易使功能成分损失的环节,糖化的目的是将藜麦等谷物淀粉转换成可供微生物发酵代谢的糖化醪[20],目前的研究主要集中在提高糖化醪中的还原糖含量,使糖化醪具有良好的发酵性能,如孙蕾等[21]对小米饮料的糖化工艺及产品稳定性进行优化提高了糖化醪的含糖量,郭克娜等[22]优化薏米酒发酵前的糖化过程得到还原糖含量达6.87 g/100 mL的糖化醪,李贞景等[23]同样以葡萄糖当量值作为评价标准进行了藜麦糖化工艺的优化。众多研究都通过提高还原糖含量来提升糖化醪的发酵性能,但是糖化醪还原糖含量只要大于8.0 g/100 mL时即能满足大多数发酵产品前期对糖含量的要求;而像藜麦、小米、薏米等一些功能性谷物在产品开发的过程中,有必要将其功能成分也作为评价标准。对功能性谷物发酵行业来说,保留更多有益成分的糖化工艺优化研究对产品质量的提升有重要意义。
本实验以藜麦为原料,以还原糖含量及总黄酮含量作为评价指标制备藜麦糖化醪。采用单因素试验、Plackett-Burman试验和响应面法优化藜麦的糖化工艺,旨在为研发藜麦发酵食品提供新的前期加工思路,同时进一步提高藜麦发酵产品的质量,实现最终产品的功能化。
1 材料与方法
1.1 材料与仪器
白色藜麦(总黄酮含量为240 mg/100 g) 山西静山乐水农业开发有限公司;α-淀粉酶(40000 U/g)、糖化酶(100000 U/g)、芦丁标准品(纯度≥98%) 北京索莱宝科技有限公司。
THZ-82恒温振荡水浴锅 常州润华电器有限公司;BS210S电子天平 德国赛多利斯集团;722可见分光光度计 上海舜宇恒平科学仪器有限公司;79-1磁力加热搅拌器 常州润华电器有限公司;STARTER3100数显pH仪 上海奥豪斯仪器有限公司。
1.2 实验方法
1.2.1 藜麦糖化工艺流程 藜麦种子→挑选→清洗→浸泡发芽→水浴锅蒸煮糊化→加入α-淀粉酶→加热灭酶→加入糖化酶→加热灭酶→藜麦糖化醪
挑选颗粒饱满、无霉变的藜麦100 g,置于500 mL锥形瓶中,加入藜麦重量150%的水浸泡12 h使籽实萌芽,萌芽使藜麦种子的脂肪和淀粉含量降低,黄酮含量及蛋白质含量升高,有利于提高藜麦糖化醪的功能性,并且浸泡后的藜麦种子更容易糊化;将发芽后的藜麦置于恒温水浴锅中加适量的水进行糊化;升温过程中加入α-淀粉酶,达到作用时间后升温至100 ℃保持30 s灭酶;降温时加入糖化酶,达到作用时间后升温至100 ℃保持30 s灭酶,冷却得到藜麦糖化醪。
1.2.2 藜麦糖化单因素试验 以总黄酮含量及还原糖含量为指标,固定因素水平为糊化温度80 ℃,糊化时间30 min,α-淀粉酶添加量为800 U/g,液化温度为70 ℃,液化时间为20 min,糖化酶添加量为3000 U/g,糖化温度为60 ℃,糖化时间为40 min。设置单因素试验:加水量(300%、400%、500%、600%、700%)、糊化温度(60、70、80、90、100 ℃)、糊化时间(20、30、40、50、60 min)、α-淀粉酶添加量(0、400、800、1200、1600 U/g)、液化温度(60、70、80、90、100 ℃)、液化时间(10、20、30、40、50 min)、糖化酶添加量(1000、2000、3000、4000、5000 U/g)糖化温度(55、60、65、70、75 ℃)、糖化时间(30、40、50、60、70 min)9个因素对糖化终点还原糖及总黄酮含量的影响。
1.2.3 Plackett-Burman联用Box-Behnken响应面法优化藜麦糖化工艺 基于单因素试验的结果,通过Plackett-Burman试验分别从9个影响因素中筛选出对藜麦糖化醪还原糖含量及总黄酮含量影响的4个显著因素分别为X1、X2、X3、X4,然后以藜麦糖化醪的总黄酮含量及还原糖含量的综合评分为指标,采用中心组合Box-Behnken Design(BBD)设计试验进行响应面优化藜麦的糖化工艺。根据PB试验分别以藜麦糖化醪的还原糖含量及总黄酮含量为评价指标进行响应面中心组合试验,响应面试验设计见表1。

表1 响应面试验因素及水平Table 1 Experimental factors and levelsused inresponse surface methodology
1.2.4 总黄酮含量的测定 依据GB/T 19777-2013分光光度比色法测定,再利用标准曲线计算。
以芦丁为标准物,NaNO2-Al(NO3)3比色法建立标准曲线回归方程:y=0.4668x+0.0074,R2=0.9985。其中,y为吸光值,x为芦丁质量。
式中:X表示样品中总黄酮(以芦丁计)的含量,mg/100 mL;m1表示用回归方程计算试液中总黄酮(以芦丁计)的质量,mg;m表示样品的质量,g。
1.2.5 还原糖含量测定 葡萄糖标准曲线法:分别取葡萄糖标准液(1 mg/mL)0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于25 mL试管中,分别准确加入DNS试剂1.5 mL,用蒸馏水补至2 mL,沸水浴加热5 min,流水冷却,定容,超声3 min,在510 nm波长下测定吸光度[24]。葡萄糖的标准曲线回归方程为:y=1.5429x-0.0214,R2=0.9984。
1.2.6 双响应值响应面分析 SPSS 17.0软件分析结果如表2所示,皮尔逊系数(pearson correlations)r<0时表示两个变量为负相关,当|r|≥0.8时表示两变量高度相关,0.8≥|r|≥0.5时表示两变量中度相关,|r|≤0.5时表示两变量低度相关,试验中r=-0.651表示两变量还原糖含量及总黄酮含量中度线性负相关,无法对两个响应值进行线性拟合,故本试验先对两个负相关的响应值按照预定的评分标准进行综合评分,评分标准见表3,根据综合评分的结果进行响应面分析。

表2 还原糖含量及总黄酮含量的相关性分析Table 2 Relative analysis of reducing sugarcontent and total flavonoids content

表3 评分标准Table 3 Scoring rules
1.3 数据处理
本试验中每个处理均重复3次。数据显示为平均值±标准偏差,结果采用Excel、Origin 2018软件进行单因素试验数据分析和图表绘制,采用SPSS17.0软件对试验数据进行差异显著性分析,采用Design-Expert 8.0软件进行Plackett-Burman试验及响应面试验的统计分析,差异显著性水平设为P<0.05。
2 结果与讨论
2.1 藜麦糖化单因素试验结果
2.1.1 加水量、糊化温度及糊化时间对藜麦糖化醪总黄酮及还原糖含量的影响 由图1a可知,在加水量300%~700%的范围内,随着水量的增加,总黄酮含量起初增长速率较快,之后缓慢增长,其原因是藜麦淀粉中80%以上是支链淀粉[25],支链淀粉的溶胀度高,吸水性强[26],加水量低时,大部分的水被淀粉分子吸收结合,醪液粘稠,黄酮物质溶出少;加水量增大,黄酮等物质快速逸出,在达到最大持水量后黄酮含量的增长速度趋于平缓;加水量过多会使糖化醪中的还原糖浓度较低,不利于进一步发酵。在加水量为500%时,糖化醪的还原糖含量足够供给微生物代谢发酵,总黄酮含量也处于较高水平,可以保证藜麦发酵产品的产量及质量。

图1 加水量、糊化温度及糊化时间对藜麦糖化醪总黄酮及还原糖含量的影响Fig.1 Effects of amount of water addition,gelatinizationtemperature and gelatinization time on total flavonoidsand reducing sugar content in quinoa mash
由图1b可知,藜麦糖化醪的总黄酮含量在60~80 ℃之间随着温度的升高而有所提高,但当温度高于80 ℃,其含量逐渐下降。在60 ℃时藜麦黄酮含量处于较低水平,可能是黄酮在芦丁降解酶的作用下发生部分分解[27-28];同时,温度较低会使藜麦颗粒吸水溶胀但不破裂,还原糖含量也处于较低水平。随着温度的升高,芦丁降解酶基本失活,藜麦熟化后颗粒涨破,分子运动加快,总黄酮含量表现为缓慢增加的趋势,但在糊化温度高于80 ℃时,黄酮含量有所下降,90 ℃时下降趋势明显,原因可能是黄酮在较高温度下发生的氧化作用所致,同时多数维生素会被破坏[29]。还原糖含量则在60~90 ℃之间快速增加,藜麦的易熟化与其支链淀粉含量高有关,研究表明藜麦在70 ℃条件下即可开始糊化[30];但是在温度高于90 ℃的条件下糊化时,藜麦籽实外围的淀粉先被糊化后体积膨胀,一定程度上抑制了内部淀粉继续糊化,表现为还原糖含量增长较缓,故本实验在考虑保留更多功能成分、减少能耗的条件下选择糊化温度为80 ℃进行下一步试验。
由图1c可知,随着糊化时间的延长,藜麦总黄酮含量缓慢降低,可能与较长时间的水解与氧化有关。还原糖含量先在30~40 min之间快速增加,40 min之后缓慢增加,可能的原因是淀粉的转化率有限,在一定时间内淀粉分解成糖的速率较快,随着时间的增加转化率会有所降低[31];综合考虑,选择糊化时间为40 min继续下一步试验。
2.1.2 液化酶添加量、液化温度及时间对总黄酮及还原糖含量的影响 由图2a可知随着α-淀粉酶添加量的增大,藜麦糖化醪的还原糖含量明显升高,但是总黄酮含量却显著降低,可能是α-淀粉酶对黄酮类有一定的降解作用,Schneider等[32]和Braune等[33]发现人体肠道内的α-D-葡糖苷酶及β-D-葡糖苷酶酶对黄酮类化合物有降解作用,而α-淀粉酶对黄酮的破坏作用应与之相关。从单因素试验的结果来看,还原糖含量与α-淀粉酶的添加量有较大相关性,当α-淀粉酶添加量为800 U/g时,糖化醪中还原糖含量为11.6 g/100 mL,能够满足发酵所需的含糖要求;且总黄酮含量为147.6 mg/100 mL,仍处于较高水平,故本实验选择淀粉酶添加量为800 U/g做进一步试验。
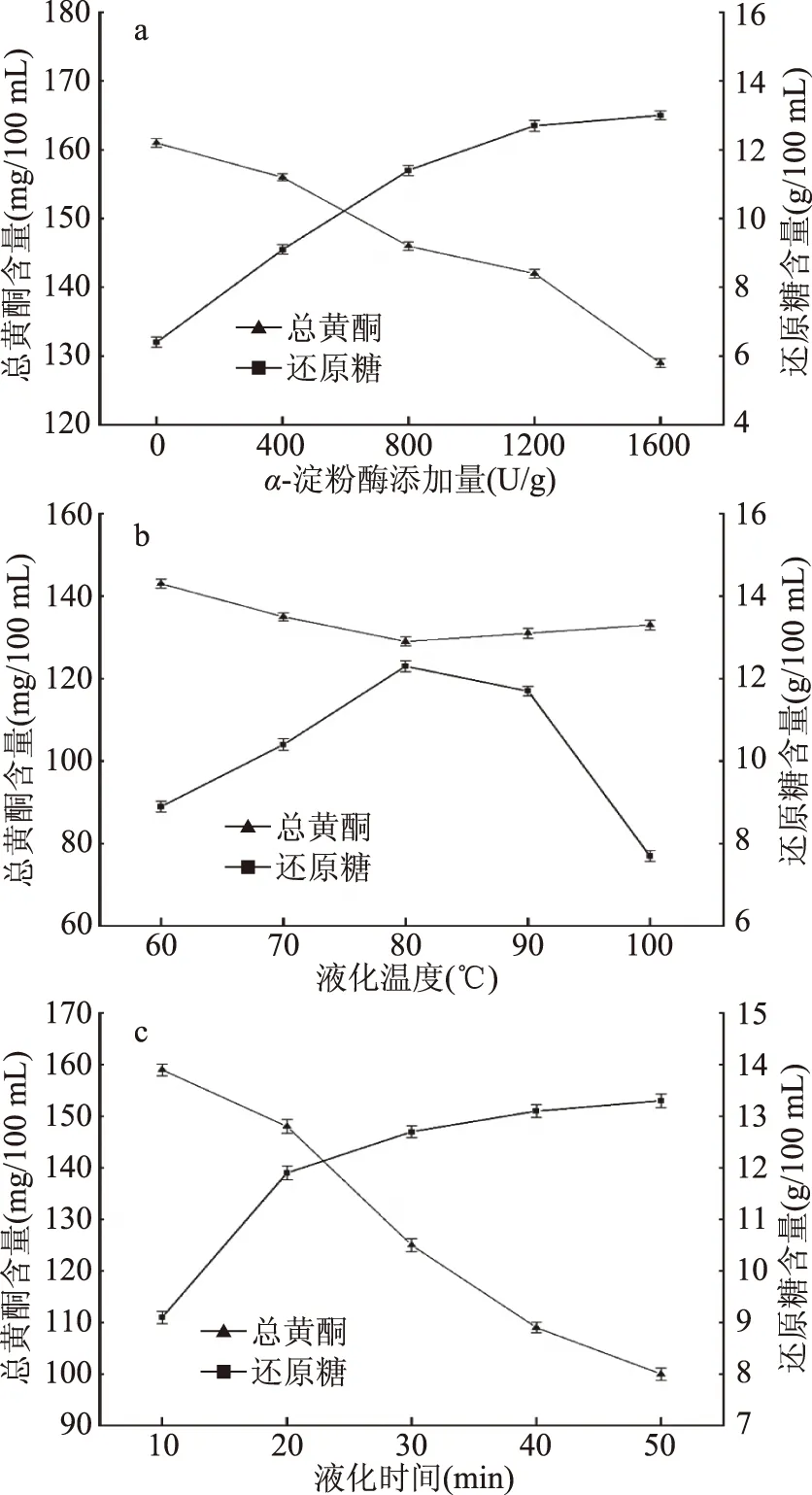
图2 α-淀粉酶添加量、液化温度及液化时间对藜麦糖化醪总黄酮及还原糖含量的影响Fig.2 Amount of α-amylase addition,liquefactiontemperature and liquefaction time on totalflavonoids and reducing sugar content in quinoa mash
由图2b可知α-淀粉酶对温度较为敏感,其最适温度为80~90 ℃,低于最适温度α-淀粉酶的活力低,而温度过高又会使其部分失活;还原糖含量受到α-淀粉酶活力的影响,在80 ℃时有峰值出现;而黄酮类在液化温度的变化过程中,受到α-淀粉酶活力及温度的共同影响,当温度处于80 ℃时,总黄酮含量处于低谷;温度大于80 ℃时,由于高温使α-淀粉酶失活,总黄酮含量有所回升,但是在高温度下总黄酮亦会氧化分解。但是由图2b可知,总黄酮含量的整体波动较小,故本实验选择液化温度为80 ℃进行下一步试验。
由图2c可知,液化时间对总黄酮含量的影响很大,作用机理可能是在适宜的温度下α-淀粉酶对黄酮较长时间的酶解使之遭到破坏,而且随着作用时间的延长破坏程度增大;还原糖含量则随着液化时间的延长持续增加,但还原糖含量的增加不足以弥补总黄酮量的损失,故液化时间不宜过长。本实验选择液化时间为20 min进行下一步试验。
2.1.3 糖化酶添加量、糖化温度及时间对藜麦糖化醪总黄酮及还原糖含量的影响 由图3a可知,在糖化酶添加量为1000~4000 U/g的范围内,随着糖化酶添加量的增加,还原糖含量快速增加;之后缓慢增加,原因是糖化酶能很快水解藜麦直链淀粉的α-1,4糖苷键,使得还原糖含量快速升高,但是糖化酶对支链淀粉的分解速度较慢[34],表现为糖化醪的还原糖含量增加趋于平缓;而总黄酮的下降趋势可能是因为糖化酶将藜麦总黄酮中的少部分类黄酮水解为异黄酮糖苷[35],异黄酮糖苷亦能发挥生理功能[36]。但是糖化酶对藜麦黄酮是否具有其他的破坏作用还不能确定,因此,综合考虑选择糖化酶的添加量为4000 U/g进行下一步试验。

图3 糖化酶添加量、糖化温度及糖化时间对藜麦糖化醪总黄酮及还原糖含量的影响Fig.3 Amount of glucoamylase addition,saccharificationtemperature and saccharification time on totalflavonoids and reducing sugar content in quinoa mash
由图3b可知,糖化酶的最适温度为65 ℃,在该点还原糖含量接近峰值,在选择糖化温度时,考虑到糖化温度对于总黄酮含量的影响较小,总体波动不超过10 mg/100 mL,故选择糖化温度为65 ℃继续下一步试验。
由图3c可知随着糖化时间的延长,还原糖含量先快速增加后趋于平缓,而总黄酮含量则持续降低,原因与α-淀粉酶处理的原因类似,与糖化酶的活力及氧化作用有关。在糖化时间为50 min时,藜麦糖化醪还原糖含量接近最大值,同时总黄酮含量还处于较高水平。故选择糖化时间为50 min进行下一步试验。
2.2 Plackett-Burman试验确定关键影响因素
2.2.1 Plackett-Burman试验结果 在单因素试验的基础上,进行Plackett-Burman试验,试验设计及响应值见表4。
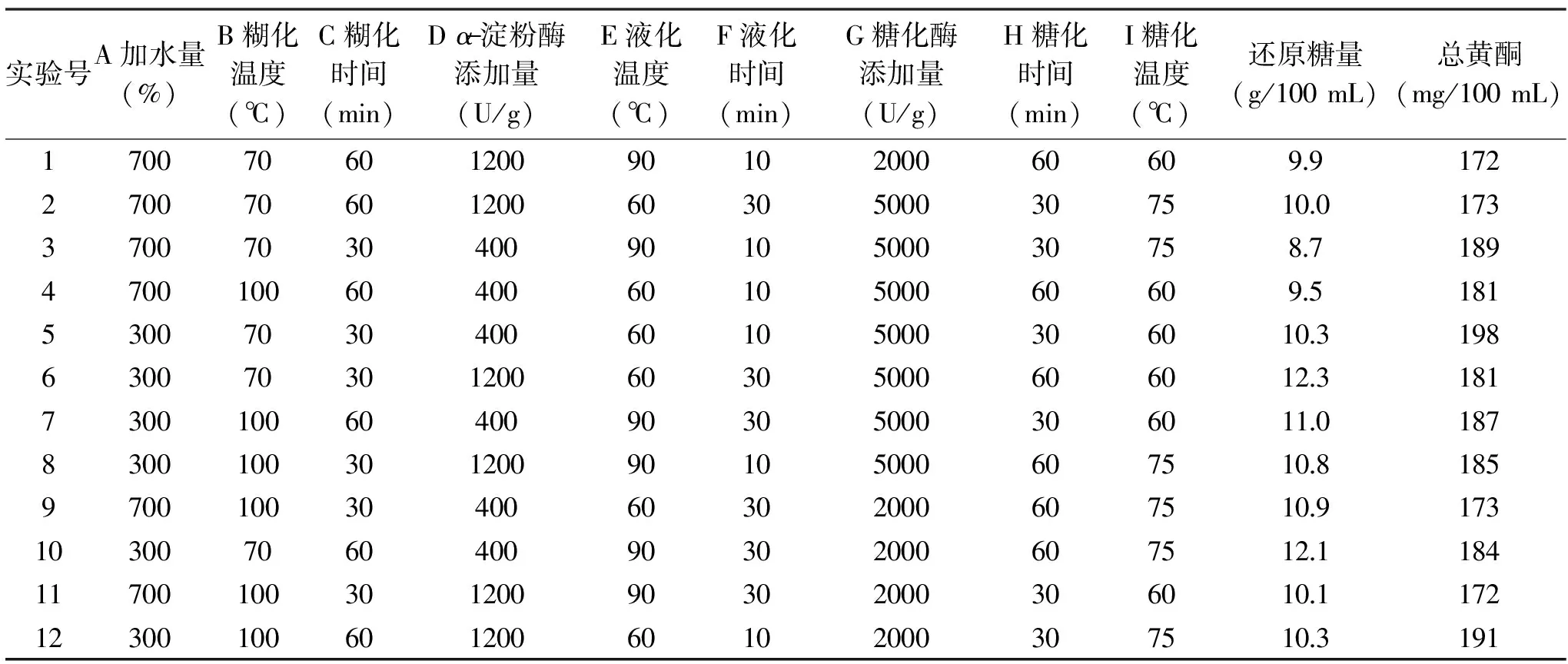
表4 Plackett-Burman试验方案及结果Table 4 Experimental design and results of Plackett-Burman
由表4可知,分别以还原糖量、总黄酮为响应值建立回归模型显著。回归方程为:总黄酮含量=182.25-5.42A-0.58B-1.42C-2.58D-0.92E-3.42F+0.75G+0.083H-2.75I;还原糖含量=10.53-0.749A-0.075B+8.33C+0.13D-0.075E+0.48F-0.13G-0.042H+0.34I;两个模型的决定系数R2分别为0.9941和0.9981,表明回归有效,试验设计可靠。由表5可知,加水量对还原糖及总黄酮含量影响极显著;液化时间、糖化时间对还原糖含量影响极显著,对总黄酮含量影响显著;α-淀粉酶添加量则对总黄酮含量有显著影响;故Plackett-Burman试验筛选出的主要影响因素为加水量(X1)、α-淀粉酶添加量(X2)、液化时间(X3)和糖化时间(X4)。
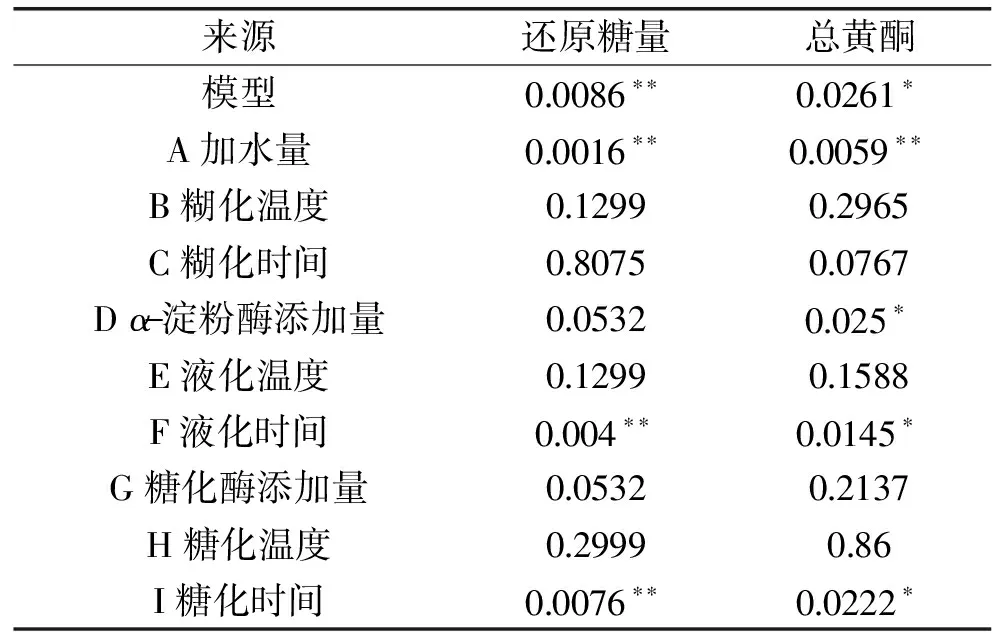
表5 Plackett-Burman试验各因数水平显著性分析Table 5 Significance analysis of different factorsin the Plackett-Burman experiment
2.2.2 Box-Behnken响应面试验结果 以加水量、α-淀粉酶添加量、液化时间和糖化时间为变量,藜麦糖化醪的总黄酮含量及还原糖含量的综合评分为指标。采用Box-Behnken响应曲面法(BBD)进行四因素三水平的组合试验,结果见表6。

表6 Box-Behnken试验设计方案及响应值Table 6 Experimental design and results of Box-Behnken



表7 回归系数及显著性分析Table 7 Regression coefficients and significance analysis
2.2.3 藜麦糖化工艺条件的确定 单因素试验的研究结果为糊化温度为80 ℃、糊化时间为40 min、液化温度为80 ℃、糖化酶添加量为4000 U/g、糖化温度为65 ℃,结合以藜麦糖化醪的综合评分为响应值的响应面优化结果:加水量496.73%、α-淀粉酶添加量800 U/g、液化时间17.72 min、糖化时间49.32 min,进行验证试验,在此条件下的验证结果为藜麦糖化醪的还原糖含量12.3 g/100 mL、总黄酮含量182 mg/100 mL,综合评分为88分。结合实际生产需要,将工艺调整为加水量500%、糊化温度80 ℃、液化酶添加量800 U/g、液化时间17 min、液化温度80 ℃、糖化酶添加量4000 U/g、糖化温度65 ℃、糖化时间50 min,此条件下得到的藜麦糖化醪还原糖含量为11.8 g/100 mL、总黄酮含量为185 mg/100 mL、综合评分为86.5分。

图4 各因素交互作用对藜麦糖化醪综合评分影响的响应面图Fig.4 Response surface graphs showing the interactive effect of different factorson comprehensive score of quinoa mash
3 结论
该试验在保证藜麦糖化醪具有良好发酵性能的前提下,尽可能多的保留了藜麦中的功能成分黄酮类物质。在单因素试验及Plackett-Burman试验的基础上,筛选出加水量、α-淀粉酶添加量、液化时间及糖化时间这4个显著影响因素,采用响应面分析法优化了藜麦糖化工艺,最优条件为加水量500%、糊化温度80 ℃、液化酶添加量800 U/g、液化时间17 min、液化温度80 ℃、糖化酶添加量4000 U/g、糖化温度65 ℃、糖化时间50 min。在此条件下,得到的藜麦糖化醪还原糖含量为11.8 g/100 mL、总黄酮含量为185 mg/100 mL、综合评分为86.5分。
将含有更多功能成分的藜麦糖化醪应用于发酵行业,可以提高产品的营养价值,实现藜麦资源的高值化利用,同时能为其他功能谷物发酵产品的糖化工艺提出参考意见,具有一定的理论意义及应用价值。
