破壁与去壁灵芝孢子粉的化学成分与抗氧化活性比较
2020-06-19王晓彤孙培龙
沐 华,蔡 铭,*,徐 靖,王晓彤,孙培龙,*
(1.浙江工业大学食品营养与安全研究所,浙江杭州 310006; 2.浙江寿仙谷医药股份有限公司,浙江金华 510530)
灵芝Ganodermalucidum(Leyss.ex Fr.)Karst.是一类具有坚硬子实体的木质降解菌,在中国、朝鲜半岛和日本等地作为一种重要的药用真菌已有悠久的历史,有“仙草”之称[1]。灵芝孢子粉是灵芝在其子实体发育成熟后,不断从菌管中弹射出孢子汇集而成。其含有丰富的生物活性成分,具有的多糖、三萜、氨基酸、核苷酸、微量元素等被研究者们认为具有很高的食药用价值[2-4]。灵芝孢子粉具有坚硬的孢子壁,主要由纤维素、几丁质等组成,因此孢子内的有效物质很难通过孢子壁溶出而被人类吸收利用[5]。
破壁技术能有效地将灵芝孢子壁打碎或去除,使孢子粉中的活性物质更易释放出来[6]。目前,国内外对灵芝孢子粉大多采用的破壁技术主要有生物法、物理法、化学法、机械法、综合法等,但因孢子壁依旧残留在其中,其活性成分含量占比并没有显著提升[7-8]。去壁技术作为一种新兴技术已被逐渐应用于灵芝孢子粉的相关产品,去壁灵芝孢子粉将超音速低温气流破壁技术和去壁提纯技术相结合,不仅仅解决了传统破壁技术存在的加工中高温氧化问题,更重要的是将占孢子粉重量2/3左右、无法被人体消化吸收的非药用部分孢子壁壳有效分离出来[9],使灵芝孢子粉中的有效活性物质含量大大提高。
本研究将对去壁与破壁灵芝孢子粉中的多糖、三萜等化学物质进行比较分析,明确去壁灵芝孢子粉的物质基础,为开展灵芝孢子粉相关功能活性的研究提供理论基础。
1 材料与方法
1.1 材料与仪器
去壁灵芝孢子粉、破壁灵芝孢子粉 浙江寿仙谷医药股份有限公司;三羟基氨基甲烷(TRIS)、2-(N-吗啉代)乙烷磺酸(MES)、热稳定α-淀粉酶液(2100 U/mL)、蛋白酶(50 U/mg)、抗坏血酸(≥99%)、3,5-二硝基水杨酸(≥98%) 国药集团化学试剂有限公司;熊果酸(≥98.5%)、1,2-二苦基-2-三硝基苯亚肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 阿拉丁试剂有限公司;灵芝酸A(≥98%)、灵芝酸B(≥98%)、灵芝酸D(≥98%) 上海源叶生物科技有限公司。
UV-2450紫外-可见分光光度计 日本岛津公司;CR21GII高速冷冻离心机、L8900氨基酸自动分析仪 日本Hitachi(日立)公司;QT-2漩涡振荡混合器 上海琪特仪器有限公司;SHB-II-A 循环水真空泵 上海淀久仪器有限公司;KQ-400E超声清洗仪 昆山市超声仪器有限公司;DK-S24型电热恒温水浴锅 上海精宏实验设备有限公司;烘箱、KSJ-15-12马弗 上海意丰电炉有限公司;SH22O电热消化炉 济南海能仪器股份有限公司;K9480自动凯氏定氮仪 济南海能仪器股份有限公司;HPLC液相色谱仪 美国Waters公司;IR IS Intrepid电感耦合全谱直读等离子发射光谱仪(ICP-AES) 美国热电公司。
1.2 实验方法
1.2.1 水分、灰分、蛋白质测定 水分测定:参照GB 5009.3-2016中直接干燥法进行水分测定[10];灰分测定:参照GB 5009.4-2016进行灰分测定[11];蛋白质含量测定:参照GB 5009.5-2016利用凯氏定氮法测定[12]。
1.2.2 膳食纤维测定 参照殷鹏飞等[13]的方法测定灵芝孢子粉中膳食纤维含量。将灵芝孢子粉在60 ℃下干燥5 h后精确称取3.0 g,按照1∶30 g/mL的料液比加入pH为8.0±0.1的2-(N-吗啉代)乙烷磺酸-三羟甲基氨基甲烷(MES-TRIS)缓冲溶液,搅拌混匀后,放入95 ℃的恒温水浴锅中,加入0.75 mL热稳定α-淀粉酶酶解100 min。温度计监测下,将样品冷却至60 ℃后加入10 mg中性蛋白酶酶解30 min,过滤,得到滤渣和滤液。所得滤液60 ℃真空浓缩至10 mL,加4倍体积的95%乙醇处理醇沉12 h后,4 ℃ 4800 r/min,离心15 min,得到沉淀。将沉淀用水洗涤、冷冻干燥、称重,即得水溶性膳食纤维(Soluble Dietary Fiber,SDF)。

式中:m为孢子粉样品质量(g);m1为冻干后样品质量(g)。
过滤所得滤渣,按照料液比1∶30 g/mL加入MES-TRIS缓冲溶液放入50 ℃恒温水浴锅,调节pH为10,时间为40 min,过滤,洗涤至中性,真空干燥,即得水不溶性膳食纤维(Insoluble Dietary Fiber,IDF)。

式中:m为孢子粉样品质量(g);m2为真空干燥后样品质量(g)。
1.2.3 总三萜测定 参照Chang等[14]的方法测定灵芝孢子粉中总三萜的含量,准确称取熊果酸标准品10 mg,用乙酸乙酯定容至100 mL。
标准曲线的绘制:分别吸取熊果酸标准溶液0.2、0.4、0.6、0.8、1.0、1.5 mL,置于10 mL比色管中,60 ℃氮气吹干。加入0.4 mL 5%香草醛冰醋酸溶液,混匀,加1.0 mL高氯酸,混匀。将混合液在60 ℃水浴中加热15 min后移入冰浴中,加入冰醋酸5 mL混匀后置于室温下。在15~30 min内于548 nm处测定,并分别记录各吸光度值,以熊果酸含量为横坐标,吸光度为纵坐标绘制标准曲线,其回归方程为:y=9.9169x-0.0312,R2=0.9978。
样品中总三萜的测定:准确称取去/破壁灵芝孢子粉样品0.5 g于离心管中,加入20 mL乙酸乙酯,超声提取30 min。分离上清液后再加入20 mL乙酸乙酯重复提取,合并上清液,冷却至室温后加乙酸乙酯定容至50 mL容量瓶中。取上清液0.3 mL置于10 mL比色管中,于60 ℃氮气吹干。同上法测定吸光度值并代入如下公式(3)进行计算。
式(3)
式中:m为试样孢子粉样品质量(g);A1为提取液吸光度值代入标准曲线方程后得到的三萜含量(mg);1000为换算系数。
1.2.4 总多糖测定 参照Vazirian等[15]方法,取干燥无水葡萄糖对照品适量,准确配制成浓度为0.12 mg/mL的对照品溶液。取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置10 mL具塞试管中,各加水至2.0 mL,迅速加入1 mg/mL硫酸蒽酮溶液6 mL,立即摇匀,放置15 min后,置冰浴中冷却15min后取出,用水为空白,在625 nm波长处测定吸光度,并绘制标准曲线,其回归方程为:y=0.4309x+0.1017,R2=0.9953。
灵芝孢子粉中总多糖的测定:精确称取孢子粉样品2 g,置圆底烧瓶中,加水60 mL静置1 h,加热回流4 h,通过滤纸趁热过滤,少量热水洗涤滤器和滤渣,置烧瓶中,加水60 mL,重复提取,合并滤液,减压浓缩至干,残渣用5 mL水溶解,缓慢加入乙醇75 mL,摇匀后4 ℃放置12 h,离心弃去上清液,沉淀物用水溶解定容至50 mL容量瓶中。测定时取5 mL容量瓶中溶液,离心取上清液3 mL,置25 mL容量瓶中,加水至刻度,摇匀即得。精密量取25 mL容量瓶中供试品溶液2 mL,置10 mL具塞试管中,同标准曲线制备法测定样品吸光度,代入标准曲线计算含量。
1.2.5 ICP-MS 测定微量金属元素 参照何晋浙等[16]方法,精确称取灵芝孢子粉样品1 g,过40目筛,60 ℃充分风干后,放入干燥器中恒重48 h以上。放入消解罐中,每个消解罐加入20 mL王水(盐酸∶硝酸=3∶1,V/V),在电子加热板中100 ℃加热2 h。冷却到室温后,再加入6 mL硝酸,继续在100 ℃消化2 h,后续升温至120 ℃加热4 h,冷却后20 ℃下静置12 h。消解后溶液呈透明黄色,用超纯水定容至100 mL。同步做一个空白实验,每个孢子样品同时做3个平行试验。
ICP-AES仪器设定射频功率1050 kW,雾化气压力为4.25×106Pa,辅助气流速为1.0 L/min,样品提升量1.7 mL/min,样品冲洗时间1 min,高波扫描5s,低波扫描30 s。
1.2.6 氨基酸测定 参照黄永连等[17]方法,精密称取30 mg的灵芝孢子粉样品于水解管中,向水解管内加入6 mol/L盐酸水解液10 mL,超声溶解、混匀,再充入氮气2 min后,拧紧螺丝盖,将水解管放在(110±1) ℃的恒温干燥箱内水解22 h后取出,冷却至室温。将水解液用超纯水转移并定容至25 mL容量瓶中,混匀,滤纸过滤。取滤液0.5 mL于小试管中,在(50±2) ℃的氮吹仪上浓缩至干,残留物加入2 mL 0.02 mol/L盐酸稀释液溶解,经0.45 μm滤膜滤头过滤,滤液即为试样溶液,后用氨基酸自动分析仪进行测定,检测限为1 μmoL/L。
1.2.7 HPLC法测定灵芝三萜 根据李保明等[18]方法,精确称取灵芝酸A 2.8 mg、灵芝酸B 2.5 mg、灵芝酸D 2.7 mg,分别溶解定容于5 mL甲醇溶液中,配成待测对照品溶液。精确称取去壁与破壁灵芝孢子粉各50 g,用1000 mL乙醇萃取过夜,反复提取三次,过滤后合并提取液,真空浓缩至原体积十分之一。每次分别取5 mL去/破壁灵芝孢子粉提取液,真空浓缩至干,甲醇复溶,过0.22 μm有机滤膜,供HPLC待测。
色谱条件:Agilent C18柱(4.6 mm×250 mm,5 μm),流动相A为0.1%冰乙酸水溶液,流动相B为乙腈;梯度洗脱条件:0~5 min,90% A,5~10 min,90%~85% A,10~30 min,85%~70% A,30~40 min,70%~60% A,40~70 min,60%~55% A,70~80 min,55%~50% A,80~100 min,50%~90% A。流速1 mL/min,Waters 2487紫外检测器,检测波长254 nm,进样量:10 μL。
1.2.8 抗氧化活性分析比较 参照Zhu等[19]方法,准确称取去/破壁灵芝孢子粉各10 g,分别用200 mL 95%乙醇萃取12 h,反复萃取3次,收集合并上清液,旋至10 mL左右后,冷冻干燥得到样品。残渣风干除去酒精后,加水200 mL,沸水浴提取2 h,反复提取3次,收集合并上清液,旋至少量后冷冻干燥得到样品。分别得到破壁灵芝孢子粉醇提物(A-PC)0.527 g,破壁灵芝孢子粉水提物(B-PS)0.449 g,去壁灵芝孢子粉水提物(C-QS)1.082 g,去壁灵芝孢子粉醇提物(D-QC)1.816 g。分别配制溶液即得到破壁灵芝孢子粉醇提相(A-PC)、水提相(B-PS),去壁灵芝孢子粉水提相(C-QS)、醇提相(D-QC),进行体外抗氧化测定。
分别将A-PC、B-PS、C-QS、D-QC、VC配成浓度为0.2、0.4、0.6、0.8、1.0和2.0 mg/mL 6个浓度的溶液进行总还原力及DPPH自由基清除能力的测定;同时,分别配制0.05、0.10、0.15、0.20、0.25和0.50 mg/mL不同浓度的溶液用于ABTS+自由基清除能力的测定;分别配制1、2、3、4、5和10 mg/mL不同浓度的溶液用于羟基自由基清除能力的测定。
1.2.9 总还原力 参照Tian等[20]方法,取A-PC、B-PS、C-QS、D-QC不同浓度的溶液各1 mL,加入0.2 mol/L pH6.6的磷酸盐缓冲溶液1 mL和1%的铁氰化钾溶液1.0 mL,将其混匀。50 ℃保温反应20 min,之后加入10%的TCA溶液1.0 mL,冷却至室温,再加入1.0 mL 0.1% FeCl3溶液。反应10 min后,测定700 nm处的吸光值Ax。VC作为阳性对照,用等体积的纯水作空白对照,测得的吸光值A0。
还原力=Ax-A0
式(4)
1.2.10 DPPH自由基(DPPH·)清除能力测定 参照Nagai等[21]方法,分别量取2 mL不同浓度的各相溶液于具塞试管中,加入浓度为0.2 mmol/L DPPH甲醇溶液1 mL。密封后混匀,于25 ℃恒温并避光反应1 h,测定517 nm处的吸光值Ai。用等体积的甲醇溶液代替DPPH溶液为样品对照组Aj,消除样品溶液对吸光值的影响,等体积的蒸馏水代替样品溶液作空白对照,测吸光度为A0。

式(5)
1.2.11 ABTS+自由基清除能力测定 参照Poonsit等[22]的方法,制备ABTS+·储备液,量取8 mL 浓度为7 mmol/L的ABTS溶液和141 μL浓度为140 mmol/L的过硫酸钾溶液,将两者混合后于4 ℃下避光反应12~16 h。用pH为7.4,浓度为10 mmol/L的磷酸盐缓冲液稀释储备液至OD=1.00±0.02后,备用。分别量取1 mL各浓度的各提取相溶液,加入ABTS+·溶液3 mL,混匀后,进行避光反应1 h,测定在734 nm处的吸光值Ai。用1 mL纯水作空白对照,同条件下测得吸光值A0;用3 mL纯水作为样品对照组,替代ABTS+·溶液,测得吸光值Aj。

式(6)
1.2.12 羟基自由基(·OH)清除能力测定 参照Zeng等[23]方法,量取0.8 mL各浓度的醇提、水提相溶液,分别加入浓度2 mmol/L的FeSO4溶液2 mL、2 mmol/L的水杨酸1 mL和0.1%的H2O2溶液1 mL。在37 ℃恒温水浴1 h,冷却至室温,测定其在510 nm波长处的吸光值Ai。以去离子水作空白,同等条件下测吸光值A0;样品对照组采用去离子水来代替水杨酸溶液,同等条件下测得吸光值Aj。

式(7)
1.3 数据处理
每组数据平行测定三次,表示为平均值±标准偏差。使用SPSS 19.0软件进行独立样本独立T检验,利用Origin 8.5软件绘图。
2 结果与分析
2.1 去/破壁灵芝孢子粉的化学物质基础
2.1.1 化学成分的对比与差异 由表1可见,去壁灵芝孢子粉在灰分、蛋白质、水溶性膳食纤维和总多糖等4个指标上均高于破壁灵芝孢子粉。而其非水溶性膳食纤维和总膳食纤维2个指标较低。本实验去/破壁灵芝孢子粉所测得总三萜和总多糖含量均高于文献[21-22],特别是经去壁处理的灵芝孢子粉总多糖含量显著高于其他灵芝孢子粉。
表1中微量金属元素显示,两种灵芝孢子粉样品中的有害金属元素均低于《破壁灵芝孢子粉浙江标准T/ZZB 0474-2018》规定的限量安全标准:Pb(≤2 mg/kg)、Cd(≤0.5 mg/kg)、As(≤1 mg/kg)、Hg(≤0.1 mg/kg)、Cu(≤20 mg/kg)、Cr(≤2 mg/kg)、Ni(≤1 mg/kg)。不同品种、产地、加工技术等与灵芝及其产品中金属元素含量有紧密的关系[24]。邹小龙等[25]对灵芝孢子粉破壁前后五种金属元素含量进行对比,发现Cu元素在灵芝孢子粉破壁前后没有明显差异,而破壁灵芝孢子粉中Mn、Cr、Ni、Fe四种金属元素均高于未破壁灵芝孢子粉。本实验中Cu、Cr、Ni、Se四种元素具有显著差异性(P<0.05),Pb、Cd、Hg、As没有显著性差异(P>0.05),去壁灵芝孢子粉没有因其生产工艺的改变而使其有害金属元素含量超标,反而显著提高了有益元素Se的含量,从而提高了产品的品质。

表1 去/破壁灵芝孢子粉成分指标Table 1 Properties of sporoderm-removal/brokenGanoderma lucidum spore powders
2.1.2 氨基酸含量的比较 本实验对去壁和破壁灵芝孢子粉中17种水解氨基酸的含量进行了测定,色氨酸因其易被酸水解,未对其进行检测。由表2可见,由于孢子壁的去除,缬氨酸、异亮氨酸、亮氨酸、酪氨酸、精氨酸均显著高于破壁灵芝孢子粉(P<0.05)。缬氨酸和异亮氨酸、亮氨酸作为人体必需氨基酸有助于修复组织,促进身体成长,调节血糖,提供能量[26]。酪氨酸既是生糖又是生酮氨基酸,精氨酸在人体内参与鸟氨酸循环,促进尿素的形成,从而降低血氨浓度。因此,去壁技术也提高了灵芝孢子粉的营养价值。
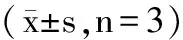
表2 去/破壁灵芝孢子粉氨基酸含量Table 2 Comparison of amino acids in sporoderm-removal/broken Ganoderma lucidum spore
2.1.3 三萜物质的HPLC比较 图1可见,去壁灵芝孢子粉中三萜类化合物在40~70 min洗脱时间段内有更为丰富的峰,与标准样品a中灵芝酸A、B和D可一一对应。而破壁灵芝孢子粉在该保留时间段内没有对应的特征峰。可见,去壁灵芝孢子粉中具有更为丰富的三萜类物质。而总三萜含量测定结果显示两者结果相近,这可能是由于灵芝孢子粉中的油脂类物质干扰紫外检测的结果。因此,测定三萜物质采用HPLC更为准确[27]。同时,灵芝孢子粉因品种、产地、加工工艺的不同,都会影响其物质成分组成及含量,灵芝孢子粉中壁壳含量占比60%以上,去壁技术将灵芝孢子粉中的三萜物质有效释放出来并加以浓缩,便于后续生产加工利用。

图1 去/破壁灵芝孢子粉三萜物质HPLC图Fig.1 HPLC of triterpenoids in sporoderm-removal/brokenGanoderma lucidum spore powders注:a:灵芝酸混合标准品(1:灵芝酸B、2:灵芝酸A、3:灵芝酸D);b:去壁灵芝孢子粉;c:破壁灵芝孢子粉。
2.2 体外抗氧化活性
如图2a所示,4种提取液还原力均随样品浓度增大而升高。浓度为1 mg/mL时,D-QC的总还原力高于A-PC和C-QS,其中A-PC的清除能力最弱。浓度为2 mg/mL时,D-QC的还原力最强。4种提取液对DPPH·清除能力也均表现出随浓度升高而增强的特性,如图2b所示,当浓度达到2 mg/mL时,4种提取相的清除率都超过80%。如图2c所示,4种提取液对ABTS+·均有很好的清除能力,其中D-QC的ABTS+·清除能力随浓度增加而上升速度最快,其次为A-PC,在0.25 mg/mL时,分别达到了99.714%和93.106%。图2d显示,4种提取液的羟基清除能力均随样品浓度增大而提升。D-QC的清除能力最强。灵芝孢子粉提取液均有很好的清除能力,对比4组不同体外抗氧化试验,达到最大测定浓度下,DPPH·清除能力的顺序为:D-QC>C-QS>B-PS>A-PC,总还原力顺序为:D-QC>B-PS>C-QS>A-PC其余2组抗氧化活性均为:D-QC>A-PC>C-QS>B-PS。

图2 灵芝孢子粉提取液的抗氧化活性Fig.2 Antioxidant activities of extracts from Ganoderma lucidum spore powders注:a-PC:破壁灵芝孢子粉醇提相;b-PS:破壁灵芝孢子粉水提相;c-QS:去壁灵芝孢子粉水提相;d-QC:去壁灵芝孢子粉醇提相。
总体来说,去壁灵芝孢子粉提取物的抗氧化活性高于破壁灵芝孢子粉提取物,这是由于去壁技术将孢子壁去除,使得灵芝孢子中的活性物质如多糖、三萜等完全溶出,进而提高了提取物的活性物质浓度。与水提物相比,以95%乙醇作为提取溶剂时,提取物的抗氧化活性更高,这可能是由于在使用95%乙醇作为提取溶剂时,灵芝孢子粉中醇溶性活性物质如三萜、多酚、生物碱等[28-29]被提取出来,这些物质的抗氧化活性高于灵芝孢子粉水提物中的多糖、核苷类化合物等[29],因此,灵芝孢子粉醇提物的抗氧化活性优于水提物。相似的结论也曾被报道过,赵镭等[30]报道在相同浓度下,不同灵芝提取物的OH清除能力,醇提相清除能力优于水提相,与本实验的测定结果相近。
3 结论
本研究首次对去壁灵芝孢子粉进行较为全面的物质成分分析及抗氧化活性的测定,并将其与破壁灵芝孢子粉进行对比,分析两者之间差异性。其中破壁灵芝孢子粉和去壁灵芝孢子粉中总多糖的含量差距较大,分别为1.150%和12.129%;总三萜含量测定结果分别为1.682%和2.556%。结合HPLC分析,去壁灵芝孢子粉中的三萜种类更为丰富,萃取得率更高。同时,去壁灵芝孢子粉中酪氨酸、精氨酸、亮氨酸、异亮氨酸、缬氨酸高于破壁灵芝孢子粉。基于去/破壁灵芝孢子粉的物质成分,其均表现出较好的抗氧化活性,为去壁灵芝孢子粉的进一步开发利用提供理论数据支持。
灵芝孢子粉在保健食品行业有较好的市场价值,本研究的物质基础对比只能客观地描述去/破壁孢子粉的成分差异,若要应用于人体,需将其活性物质分离纯化并进行细胞实验、动物实验等研究。此外,应用其开发新型保健品、药妆品都需要进一步进行临床实验,以便更深入了解其活性物质作用机制,并评价其安全性。
