台湾桤木DNA提取方法的优化及抗氧化剂对DNA质量的影响
2020-06-18刘佳哲申文辉谭长强滕维超
刘佳哲, 申文辉,谭长强,滕维超
(1.广西大学 林学院,广西 南宁 530002;2.广西壮族自治区林业科学研究院 广西优良用材林资源培育重点实验室,广西 南宁 530002)
1 引言
近年来植物种质资源信息系统的建立,基因资源库的完善,以及分子标记在生物学上的广泛应用,都离不开DNA的提取[1]。高质量的DNA提取对于基因组测序、PCR反应、基因克隆、酶切等试验至关重要[2]。从植物体内提取DNA是分子生物学的基础技术,但不同植物甚至是同种植物的不同部位提取的DNA质量都会有一定差异。因此为提取出高质量的DNA,需要对现有的方法进行一定的优化[3]。目前常使用提取DNA的方法有CTAB法、SDS法和高盐低pH法等[4],本研究采用成本低廉操作相对简易的CTAB法和SDS法进行研究。
台湾桤木(Aluusformosaua)原产中国台湾,是桦木科(Betμlaeeae),桤木属(Aluus)的落叶大乔木[5]。引种大陆以来,台湾桤木具有适应性较好以及生长速度快的优点[6]。但由于林木周期较长,目前主要研究内容为引种栽培、生长光合、根瘤形态等方面[7],分子标记对林业优良家系的选择以及提高林业生产效率具有积极作用[7]。台湾桤木由于叶片内含丰富的多糖、多酚类等影响DNA提取质量的次生物质,这些物质在植物组织的破碎过程中与空气接触被迅速氧化,影响到DNA的提取率[8]。而分子标记通常需要大量样品进行分析,一种高效简易的DNA提取方法对于台湾桤木的遗传研究至关重要。抗坏血酸和β-巯基乙醇都是常用的抗氧化剂,对此本研究采用两种不同方式提取DNA的质量进行对比,以及添加不同抗氧化剂对DNA质量的影响进行探究,以期获得高质量的DNA为后续试验提供材料。
2 材料与方法
2.1 试验材料
试验材料采自广西黄冕林场波寨分场台湾桤木试验林,试验林苗木树龄3年,平均树高5.37 m,平均胸径5.43 cm。选择健康植株的新生幼叶作为DNA提取材料。试验地位于广西桂林市永福县波寨(106°45′E,21°54′N),为低山丘陵地貌,海拔约300 m,属南亚热带季风气候。常年气温温暖,降雨充沛,阳光充足。年均气温19 ℃,绝对最低温-2.8 ℃,年均降水量1800 mm,降雨集中在4~8月。成土母岩以砂页岩、夹泥岩为主,土壤以红壤为主,表土层厚度20~25 cm,土层厚50~70 cm,pH值5.8。为桉树人工林采伐迹地。使用福建、湖南、昭新、昭南、昭卫和什邡共6个种源(表1)的台湾桤木幼叶作为优化后DNA提取方法的验证材料。幼叶采集后迅速放入变色硅胶中密封保存备用。
2.2 DNA提取试验方法
本研究采用两种DNA提取方法对比,抗氧化剂选择抗坏血酸和β-巯基乙醇两种,每种抗氧化剂浓度设置3个梯度(表2),在两种DNA提取方法上分别采用不同浓度的抗氧化剂进行试验。DNA提取方法采用改良CTAB法和改良SDS法。

表1 台湾桤木种源来源

表2 不同DNA提取方法和抗氧化剂处理梯度
2.2.1 改良CTAB提取法
取少量实验材料(约300 mg)置于研钵中,加入适量的抗坏血酸(表2)后,加入3 mL在65 ℃水浴预热的2%CTAB抽提缓冲液(含5% PVP),研磨至匀浆状;将充分研磨的匀浆取1.2 mL倒入2.0 mL的灭菌离心管中;同时加入适量的β-巯基乙醇(表1);置于65 ℃的水浴锅或恒温箱中,每隔10 min轻轻摇动,45 min后取出;冷却2 min后,加入氯仿-异戊醇(24∶1)至满管,振荡2 min(注意不要剧烈震荡,会使基因组断裂),使两者混合均匀;放入离心机中12000 r/min离心10 min;离心后轻柔取出离心管,使用移液器轻缓吸取约700μL上清液至新离心管中,再加入等体积的氯仿-异戊醇(24∶1),重复上述步骤;使用移液器轻轻地吸取400μL上清液至新离心管中,加入270μL -20℃预冷的异丙醇,将离心管盖稳后慢慢上下摇动30 s,使异丙醇与水层充分混合至能见到DNA絮状物(若摇动后不出现肉眼可见的DNA絮状物可以放入-20 ℃冰箱冷冻1 h);将离心管放入小型桌面离心机10000 r/min离心1 min后,倒掉液体,注意勿将白色DNA沉淀倒出;再加入1mL 75%乙醇,上下颠倒离心管使乙醇与DNA充分接触后倒出,重复此操作2次;将离心管倒立于铺开的纸巾上;数分钟后,直立离心管,干燥DNA(自然风干或用风筒吹干);加入200 μL 1 × TE,使DNA溶解后放置-20 ℃冰箱保存。
2.2.2 改良SDS提取法
改良SDS法与改良CTAB法步骤基本一致,区别在于提取液使用3%SDS提取液,研磨后取1 mL匀浆65 ℃水浴45 min,水浴后加入200μL KAc并在冰上静置30 min。
2.3 DNA质量的检测
采用1.0%琼脂糖凝胶电泳120V,20 min,使用超灵敏多功能成像仪拍照。使用超微量核酸检测仪检测DNA的浓度和纯度。最后将最佳DNA提取方法和抗氧化剂最适浓度下提取的DNA进行SSR分子标记的PCR扩增,使用8%聚丙烯酰胺凝胶电泳后观察条带。
3 结果与分析
3.1 不同DNA提取方法对DNA质量的影响
CTAB是一种阳离子去污剂,可以有效去除植物叶片内的多糖成分,SDS是一种阴离子去污剂,可以有效与植物组织内的蛋白结合起到去除蛋白的作用。两种方法都可以提取出一定量的DNA,从电泳结果上看(图1),CTAB法提取的DNA条带相对较亮较宽,SDS法提取的DNA条带较暗,说明CTAB法提取的DNA中蛋白杂质比SDS法提取的多,两种方式提取的DNA均有一定程度的拖尾,说明DNA发生降解或者是存在小分子杂质。使用超微量核酸检测仪测定DNA浓度和纯度,CTAB法提取的DNA浓度平均为478.5 ng/μL,OD260/OD230在1.84~1.92之间,说明仍存在少量的蛋白杂质、RNA和小分子杂质等;SDS法提取的DNA浓度平均为280.3 ng/μL,OD260/OD230在1.64~1.86之间,也存在杂质的污染。
使用CTAB法和SDS法研磨叶片后匀浆均呈黄褐色。加入CTAB提取液后研磨几乎无泡沫产生,离心后可产生足量的上清液以供后续步骤操作。加入SDS提取液后研磨会产生大量泡沫,泡沫会导致无法将研磨后的匀浆充分转移到离心管中。从沉淀的样品中发现,使用CTAB法提取的DNA絮状沉淀呈黄褐色,但SDS法提取的DNA呈黄白色。使用200 μL TE溶解晾干DNA样品后发现所有DNA样品难溶,说明无论是CTAB法还是SDS法,在不加抗氧化剂的情况下提取出的DNA的质量均不佳,其中混杂有一定的杂质导致无法溶解。
3.2 不同抗氧化剂对台湾桤木DNA质量的影响
抗氧化剂在DNA提取过程中可以起到防止酚类物质被氧化成醌以及防止植物组织的褐变。在上述试验中发现不添加抗氧化剂的情况下,台湾桤木很容易被氧化成褐色,使用氯仿抽提也无法去除附着的色素,导致DNA沉淀呈黄(红)褐色状态。本研究采用β-巯基乙醇和抗坏血酸两种抗氧化剂对比(图1),结果表明:在CTAB法或SDS法中使用β-巯基乙醇可以有效防止褐变,抗坏血酸也可以防止样品的褐变但高浓度的抗坏血酸会导致DNA的降解。从电泳图中可以看出使用β-巯基乙醇的量与DNA质量没有明显差异,但使用抗坏血酸的样品出现随着抗坏血酸浓度的增加而降解的情况。当抗坏血酸用量为0.015 g时效果最好,既能防止样品的氧化褐变,又不会导致DNA的降解。抗坏血酸用量为0.05 g时无论是SDS法还是CTAB法提取的DNA几乎都被完全降解。
添加抗坏血酸的样品在研磨过程中样品始终保持新鲜青绿色状态,水浴45 min后仍保持鲜绿色,使用氯仿抽提后的上清液也呈略带黄绿的澄清液体,最后使用异丙醇沉淀时得到白色且易溶于TE的絮状DNA沉淀。β-巯基乙醇是在65 ℃水浴前在离心管中加入后混匀,因此在研磨过程中不可避免的样品已经被氧化为黄褐色。加入β-巯基乙醇混匀水浴45 min后黄褐色的样品匀浆被还原为黄绿色,使用氯仿抽提后的上清液呈黄绿色较抗坏血酸处理的上清液颜色更深,最后使用异丙醇沉淀后可得到淡黄近白色且可溶于TE的DNA絮状沉淀。
图1不同浓度-巯基乙醇和抗坏血酸在两种DNA提取方法提取DNA电泳图
3.3 SSR-PCR扩增检测DNA提取质量
本研究发现使用SDS法提取的DNA得率比CTAB法要低,质量稍微欠佳,虽然可以满足部分分子标记的使用,若是进行测序等试验还略有欠佳。在研磨过程中SDS提取液会与样品产生大量泡沫,大量泡沫会导致无法充分的将研磨液从研钵中转移到离心管中,CTAB提取液则无泡沫产生。因此无论是DNA得率和质量,还是操作的高效性,CTAB法更适合台湾桤木DNA的提取。在抗氧化剂的选择上,采用抗坏血酸作为抗氧化剂时存在高浓度会导致DNA降解(图1),而采用β-巯基乙醇不会导致DNA的降解。β-巯基乙醇作为一种液体试剂,相比抗坏血酸固体粉末试剂要更方便定量使用。从图上(图1)明显看出使用30μL β-巯基乙醇后DNA电泳条带明显亮于两外两个梯度,表明提取出的DNA质量和浓度均高于另两个梯度的β-巯基乙醇,因此选择30 μL β-巯基乙醇作为抗氧化剂。再采用改进后的方法(改良CTAB法,30μL β-巯基乙醇)对6个不同种源的台湾桤木样品DNA进行提取。从琼脂糖凝胶电泳(图2)中可以明显看出,提取出的台湾桤木DNA质量较好,条带清晰,胶孔无残留,几乎无拖带。说明提取出的DNA样品浓度高、杂质相对较少,适合用于后续SSR-PCR扩增。将台湾桤木DNA使用高通量测序后开发SSR引物,本研究采用基因组测序后设计的引物QR83(F:TGAACAATGCAAAAGGGTGA;R:AAATGGTCTGCTGCGTTTCT)进行SSR-PCR扩增以验证本次使用改良方法提取的DNA在PCR中扩增效果。扩增程序为:94 ℃预变性4 min;94 ℃变性30 s,56 ℃退火1 min,75 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。SSR-PCR扩增产物使用8%非变性聚丙烯酰胺凝胶电泳(120 V,2 h)后采用银染法显影观察条带(图3)。从聚丙烯凝胶条带可以看到,台湾桤木6个种源的DNA在SSR-PCR扩增中都能扩增出明显条带,且条带清晰边缘锐利。说明改进后的DNA提取方法对台湾桤木非常适用,可高效的获得供分子标记使用的高质量DNA材料。
4 讨论
一种高效的DNA提取方法在分子生物学中至关重要[9],通常植物组织富含多糖、多酚类物质,会降低提取到的DNA质量从而影响后续PCR扩增的结果[10]。CTAB可以有效去除多糖,SDS虽可有效去除蛋白质但对多糖多酚不能有效去除[11],本研究发现使用两种方法结果差异不大。SDS法提取的DNA得率比CTAB法要低,质量稍微欠佳,虽然可以满足部分分子标记的使用,若是进行测序等试验还略有欠佳。在研磨过程中SDS提取液会与样品产生大量泡沫,大量泡沫会导致无法充分的将研磨液从研钵中转移到离心管中,CTAB提取液则无泡沫产生。因此无论是DNA得率和质量,还是操作的高效性,CTAB法更适合台湾桤木DNA的提取。杨立国[12]等在对5种(小麦、玉米、甘蓝、花生、菠菜)常见植物DNA提取的研究中也同样认为CTAB法比SDS更适合植物幼叶DNA的提取。
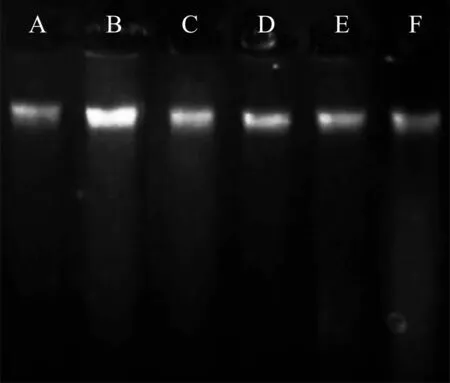
图2 台湾桤木6个种源样品DNA琼脂糖凝胶电泳图
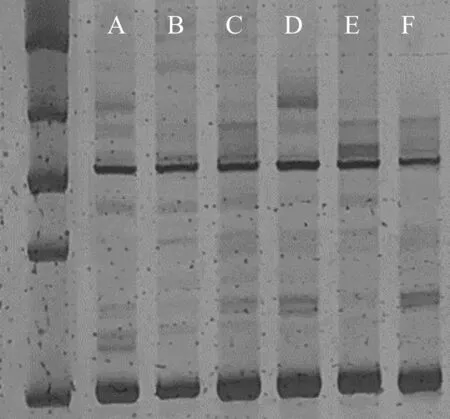
Marker由上往下分别为900bp、500bp、300bp、200bp、100bp
图3引物QR82在6个台湾桤木种源样品中SSR-PCR扩增结果
植物叶片中的多糖、多酚等次生物质会在DNA沉淀时附着在DNA上形成难溶于TE的胶状沉淀或是发生褐变[13,14]。使用抗氧化剂可以避免植物样品发生褐变以去除多酚类次生物质[15]。本研究结果表明β-巯基乙醇和抗坏血酸都可以在抗氧化上起到作用。β-巯基乙醇的用量越高DNA的得率也越高,但高浓度对抗氧化效果基本无显著差异,但具有刺激性气味且容易挥发。抗坏血酸低浓度时可起到抗氧化作用且不会导致DNA的降解,高浓度的抗坏血酸会造成DNA的降解,但具有无刺激性气味的优点。抗坏血酸是粉末状需要精准称量,这增加了试验的操作步骤,与提出高效高质DNA的目的相悖,而β-巯基乙醇为液体吸取方便。因此对比两种抗氧化剂后认为β-巯基乙醇配合CTAB法更适合台湾桤木DNA的提取。
