G SK126通过Wnt/β-catenin信号通路调控牙周膜干细胞成骨分化能力
2020-06-17郭灵巧来国芹王潇轶
郭灵巧 来国芹 王潇轶
牙周炎可导致牙周支持组织进行性破坏,是引起牙列缺损的主要原因之一[1]。牙周膜干细胞(PDLSCs)是分布于牙周组织的一种成体干细胞,具有较强体外增殖能力及向成骨、成软骨和成脂等多向分化的生物学特性,是组织工程重要的干细胞来源,它的发现为牙周病的治疗提供了新的方法和思路[2,3]。在牙周病的临床治疗过程中,恢复牙周骨质缺损是牙周病治疗的重要内容,而 PDLSCs 在牙周组织再生及骨质缺损修复中发挥重要作用[3,4]。因此,深入研究PDLSCs成骨向分化的调控机制对PDLSCs 的组织工程应用发挥重要作用。
EZH2 作为 H3K27me3 的特异性甲基化酶,可通过催化H3K27me3,招募DNA甲基转移酶(DNMT)、去乙酰化酶(HDAC)等蛋白,使靶基因启动子发生甲基化,进而介导蛋白复合物转录抑制,对维持干细胞特性,抑制干细胞衰老具有重要作用[5]。EZH2 可促进骨髓间充质干细胞(BMSCs)体外脂肪生成,抑制体内外成骨分化潜能;相反,抑制 EZH2酶活性和抑制 EZH2 基因表达可抑制 BMSCs 成脂向分化,促进成骨分化[6,7]。近年来,Wnt/β-catenin信号通路在调控牙源性干细胞分化的重要作用得到越来越多的认可,Wnt/β-catenin信号通路的激活可促进牙源性干细胞成骨向分化[8,9]。研究显示,EZH2 可通过直接招募 β-catenin 转录复合物的方式激活 Wnt/β-catenin 信号通路进而增强 Wnt 通路靶基因转录活性[8,10]。然而新型 EZH2 抑制剂 GSK126是否影响 PDLSCs 的成骨分化及其作用机制尚不明确。本研究将通过探索 GSK126 对 PDLSCs 成骨向分化能力的影响及其机制,以期为 PDLSCs 在牙周组织再生中的应用提供理论依据。
资料和方法
1.实验材料青霉素、链霉素、胎牛血清(Gibco,美国);胰蛋白酶、α-MEM 培养基(Hyclone,美国);显微镜(Olympus,日本);细胞培养箱(Heraeus,德国);低温高速离心机(Eppendorf,德国),H3K27me3、β-catenin 抗体(Abcam,美国);RUNX2、ALP、OCN、EZH2 及β-actin引物(上海生工,中国),Ⅰ型胶原酶、地塞米松、维生素 C、β-甘油磷酸钠(Sigma,美国),SYBR Green 试剂盒(Takara,日本)。
2.细胞培养及矿化诱导收集 18~25 岁临床志愿者即刻拔除的前磨牙或第三磨牙,要求健康完整、无龋坏。在超净台内用手术刀片分离出牙周膜组织,PBS 清洗 3 遍,加入 4mg/L I 型胶原酶消化 40min,用含 20%胎牛血清的 α-MEM 培养液终止消化,培养基重悬后将组织块接种于培养皿中,于二氧化碳细胞培养箱内培养,每两天更换一次培养基,待细胞从组织块周围爬出并长至 80%融合率时,采用有限稀释法纯化细胞单克隆株,扩大培养后用于后续实验。
取状态良好的 P3 代牙周膜干细胞以 1×105个/ 孔的接种于培养板中,分为矿化诱导组和空白对照组组,当细胞达到 80%以上的汇合率;更换成骨诱导液 (10%FBS,10nmol/L 地塞米松、50mg/L 维生素 C 和 10mmol/L β- 甘油磷酸钠)进行成骨诱导,诱导 1-3周后进行通过 qRCR 检测 EZH2 及成骨相关基因表达。
3.实时定量聚合酶链反应(q-RCR)实验将处于对数生长期的 P3 代 PDLSCs 消化后接种于培养板中,分 为 GSK126组和对照组(Con),GSK126+XAV939 组,成骨诱导后提取细胞的总 RNA,按照Prime ScriptTMRT reagent Kit(Takara 生物技术公司)说明书逆转录合成 cDNA,储存于 -20℃条件下备用。
q-PCR 反应根据SYBR ® Premix Ex TaqTM(Takara 生物技术公司)说明书操作,RUNX2 上游引物 为 :5’-GGGTAAGACTGGTCATAGGACC-3’,下游引物为:5’-CCCAGTATGAGAGTAGGTGTCC-3’;OCN 上游引物为:5’-GCCGAGGTGATAGTGTGGTT-3’,下游引物为:5’-ACTCCTCGCTTTCCATGTGT-3’;,ALP 上游 引 物为 :5’-CCCACCTCAGGCTA -TGCTA-3’,下 游引物为:5’-CACTGGGCAGACAGTCAGAA-3’;内参β-actin上游引物为:5’-AAAGACCTGTACGCCAACAC-3’,下游引物为:5’-GTCATACTCCTGCTTGCTGAT-3’。
4.Western blot 实验用 RIPA 裂解液提取各实验组细胞的总蛋白,制备 10%SDS-PAGE 凝胶,经电泳分离蛋白、转膜、5%脱脂奶粉封闭后,加入兔抗人H3K27me3、β-catenin(1:1000 稀释)、β-actin(1∶10000 稀释)抗体,于 4℃冰箱孵育过夜。TBST 洗涤3 次,每次十分钟,加入抗兔二抗室温孵育 1h;使用ECL 化学发光。采用 Image J 软件分析条带灰度值。
5.茜素红实验取生长状态良好 P3 代 PDLSCs以 1×105个 / 孔的接种于 6 孔培养板中,分为空白对照组(Con)、GSK126 组和 GSK126+XAV939 组,当细胞达到 80%以上的汇合率,更换成骨诱导培养基(10%FBS,50mg/L维生素C和10mmol/Lβ-甘 油磷酸钠、10nmol/L 地塞米松),诱导 2周后进行茜素红染色:PBS 轻轻漂洗细胞 3 次,4%的多聚甲醛固定细胞 30min;PBS 漂洗细胞 3 次,茜素红染液染色20min;PBS 轻轻洗去残留的染液,倒置显微镜下观察并拍照记录矿化结节的形成情况。
6.统计学分析采用 SPSS19.0 统计软件对数据进行统计学分析,计量资料以均数±标准差表示,组间比较采用 t 检验或单因素方差分析,P<0.05 表示差异有统计学意义。
结 果
1.牙周膜干细胞成骨分化前后EZH2 和H3K27me3 的表达:qPCR 检测牙周膜干细胞成骨分化前后 EZH2 和成骨相关基因 mRNA 的表达水平,结果显示,与对照组相比,牙周膜干细胞诱导分化1~3周后 OCN、ALP、Runx2 的表达水平明显升高(图1A),而 EZH2 的表达水平显著下调(图 1B),Western blot 显示牙周膜干细胞诱导分化 1~3周后H3K27me3 蛋白的表达水平明显降低(图1C,D),差异有统计学意义。
2.GSK126 调控牙周膜干细胞的成骨分化能力q-PCR 检测 GSK126 对牙周膜干细胞成骨分化的影响,结果显示 GSK126 组中的成骨基因表达显著上调,而 EZH2 的表达明显下调,差异有统计学意义(P<0.05)(图 2A,B)。茜素红染色结果显示 GSK126组中矿化结节比对照组明显较多;而 Western blot结果显示 GSK126 组中 H3K27me3 蛋白的表达水平显著下调,差异有统计学意义(P<0.05)(图 2C,D)。
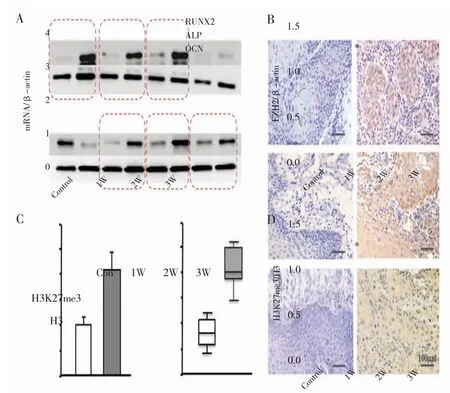
图1 牙周膜干细胞分化前后 EZH2、H3K27me3 及成骨基因的表达

图2 GSK126 通过抑制 H3K27me3 促进牙周膜干细胞成骨分化( ×10)
2.3 XAV939 逆转 GSK126 对牙周膜干细胞成骨向分化的促进作用为进一步探索GSK126 调 控PDLSCs 成骨向分化的分子机制,在 GSK126 组加入Wnt/β-catenin 信号通路阻断剂(XAV939),分析其对牙周膜干细胞的成骨分化能力的影响。结果显示,GSK126 组 PDLSCs 中的 β-catenin 水平显著提高,而 XAV939 能逆转 β-catenin 的上调(图3C,D)。茜素红染色及 q-PCR 检测结果显示,XAV939 可逆转GSK126 对 PDLSCs 成骨分化能力的促进作用,差异有统计学意义(P <0.05)(图 3A,B)。结果说明GSK126 通过 Wnt/β-catenin 信号通路调控 PDLSCs成骨向分化。
讨 论
表观遗传是指在基因的核苷酸序列(DNA)不发生改变的情况下,基因表达在亲代和子代间发生可遗传的变化。表观遗传调控在生命过程中的重要作用已被越来越多的国内外学者关注。H3K27me3 组蛋白甲基化修饰是组蛋白 H3 亚基最稳定的表观修饰标记之一,修饰位点主要位于靶基因启动子及转录起始位点附近,广泛参与胚胎发育和细胞分化等过程[11]。H3K27me3 作为抑制性组蛋白修饰,通过改变核小体结构、紧缩染色质结构,使基因转录起始位点无法与转录酶 RNA Pol Ⅱ结合,从而抑制基因的表达[7,12]。EZH2 是 H3K27me3 特异性组蛋白甲基化转移酶,可将甲基基团(-CH3)转移到组蛋白 H3 的27 位赖氨酸残基上,抑制靶基因转录活性[13]。研究显示,EZH2 靶向调控 MX1、FHL1 及 Runx2 抑制间充质干细胞的成骨分化[14]。然而,EZH2 及H3K27me3 在牙周膜干细胞成骨分化中的作用仍不清楚。
本研究发现牙周膜干细胞在成骨诱导后 1~3周 EZH2 及 H3K27me3 的表达显著下调,与成骨基因 Runx2、ALP 和 OCN 的表达相反。为了进一步探索 EZH2 及 H3K27me3 对牙周膜干细胞成骨分化能力的影响及其分子机制,本实验在牙周膜干细胞成骨诱导分化过程中加入 EZH2 新型小分子抑制剂GSK126,结果显示 GSK126 可显著抑制EZH2 及H3K27me3 的表达,而明显促进牙周膜干细胞成骨基因的表达和钙化结节的产生,说明 GSK126 可促进牙周膜干细胞的成骨向分化能力。
Wnt/β-catenin 信号通路是广泛存在于生物体内高度保守的信号通路,在胚胎发育和维持组织细胞内稳态等生理活动中发挥重要作用。研究显示,正畸牙移动过程中可激活牙周膜干细胞中的Wnt/β-catenin 信号通路,进而调控牙槽骨改建[15]。在牙周膜干细胞中抑制 Wnt/β-catenin 信号通路的表达可显著抑制牙周膜干细胞成骨向分化[9]。因此,本实验检测 GSK126 作用下 Wnt/β-catenin 信号通路的表达,结果显示加入 GSK126 后β-catenin 的表达显著上调,说明 Wnt/β-catenin 信号通路可能参与了 GSK126 调控牙周膜干细胞的成骨向分化。为进一步探索 GSK126 调控牙周膜干细胞的分子机制,我们在 PDLSCs 成骨诱导液中同时加入 GSK126和 Wnt/β-catenin 信号通路抑制剂 XAV939,实验结果显示 XAV939 可明显逆转 GSK126 对牙周膜干细胞成骨分化能力的促进作用。
综上,我们通过在牙周膜干细胞成骨诱导液加入 EZH2 特异性抑制剂 GSK126,确定了 GSK126 对PDLSCs 成骨分化能力的促进作用,进一步探索了Wnt/β-catenin 信号通路在GSK126调控PDLSCs成骨分化中的作用。研究结果显示,GSK126 可通过Wnt/β-catenin 信号通路促进牙周膜干细胞的成骨分化能力,提示新型小分子化合物 GSK126 在牙周组织损伤修复过程中可发挥重要作用。
