ENPP1诱导肿瘤干性和上皮间质转化促进口腔鳞癌的发展
2020-06-17林润台余立江安普根李依洲赵继志
马 超 张 韬 林润台 周 炼 余立江 安普根 李依洲 赵继志
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一[1]。近年来OSCC 的治疗取得了很多的创新和改革,但患者的 5年生存率仍不超 60%[2]。肿瘤干细胞理论研究发现,OSCC 中存在肿瘤干细胞,治疗后仍顽固存在的肿瘤干细胞是导致肿瘤复发和转移的重要原因之一[3]。
ENPP1 (外核苷酸焦磷酸酶 / 磷酸二酯酶 1)是具有焦磷酸酶和磷酸二酯酶 活 性的Ⅱ型跨膜糖蛋白,在骨骼和软骨中高表达。ENPP1 通过水解焦磷酸键和磷酸二酯键,生成核苷 5'- 单磷酸酯,在多种生理活动中起调节作用,包 括核苷酸再循环以及ATP 介导的细胞凋亡等[4,5]。最近的研究表明,ENPP1上调了干细胞标志物 ABCG2,增加了肿瘤迁移能力并对乳腺癌的常规化学疗法产生抗药性[6]。抑制胶质母细胞瘤干细胞中的 ENPP1 会下调肿瘤干细胞标志物,从而诱导肿瘤分化,凋亡以及增加对化学治疗的敏感性[7]。肺癌组织中亦检测到 ENPP1 的高表达,并且证实其高表达激活了肿瘤干细胞特性并参与了肿瘤细胞 EMT 的发生[8]。已有研究显示,EMT在获得癌症干细胞表型的过程中起着至关重要的作用[9]。但 ENPP1 是否在诱导 OSCC 细胞干性和转移中起调节作用仍不清楚。
本研究的目的在于探究ENPP1在OSCC患者肿瘤组织和OSCC细胞系中的表达及其调控 OSCC细胞干性和转移的重要作用。
资料和方法
1.临床样本:选取北京协和医院口腔颌面外科2017 年至 2019 年收集资料完整的OSCC患者16例,所有患者均未行术前放化疗。术中留取肿瘤原发灶和癌旁正常黏膜组织(对照)样本。相关的组织标本均经过病理科鉴定,并经过患者知情同意及伦理委员会许可。
2.主要试剂:试剂 RPMI1640 培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)(Gibco 公司,美国);总蛋白提取试剂盒和细胞裂解液(上海碧云天公司);ENPP1 shRNA (上海锐博生物);抗 GAPDH 抗体(sc-365062)和抗 β-actin 抗体(sc-365062)购自美国 Santa Cruz 公司;抗 ABCG2 (#42078),抗 Sox2(#4900),抗 NAOAG(#4893),抗 E-cadherin(#3195)和抗 Vimentin(#5741)抗体购自美国 CST 公司。
3.细胞 培养:人口腔鳞癌细胞系 Tca-8113、CAL-27 和 SCC-9 和正常人口腔粘膜细胞系购于美国模式菌种收集中心(ATCC)。所有细胞培养在含10%胎牛血清的 RPMI1640 培养基中,培养环境为37℃恒温培养箱中培养并通入 5% CO2。
4.免疫组织化学染色:ENPP1 免疫组织化学检测按照文献所述的方法进行[8],运用 Image J 图像分析软件进行图像信息分析,根据染色程度和阳性细胞所占比例综合评分。按照染色轻重分类:无染为 0分,轻度棕色 1 分,中度棕色 2 分,重度棕色3分;按照染色范围分类:染色区域<5%为0分,5%~25%为 1 分,25%~75%为 2 分,≥75%为 3 分。IHC 综合评分为上述两个评分的总和。0~2 分为阴性,3~6 分为阳性。
5.shRNA 转染沉默 ENPP1 的表达:转染前 24h用 1ml RPMI1640 全培养基将 CAL-27 细胞接种在6 孔板上,待细胞汇合度达到 70%~90%时,更换培养基。shRNA 的转染浓度为 60pmol/ml,设立两个ENPP1 转染组(shENPP1-#1,shENPP1-#2)和 空 载对照组(shRNA-NC),培养 24h 后进行实验检测。
6.免疫印迹:按照文献所述的方法检测蛋白表达[7]。蛋白印迹结果通过 Syngene Imaging System 进行成像,通过 Image J 软件对蛋白印迹条带进行处理和分析。
7.免疫荧光:将 CAL-27-NS 和 CAL-27-shENPP1细胞分别接种到6孔板的盖玻片上,将细胞用TGF-β(5μM/ml)处理2天。如先前所述[8]进行免疫荧光检测。
8.细胞迁移能力检测:在6孔板中培养CAL-27-NS和CAL-27-shENPP1 细胞,当细胞完全铺展时,用200μl 移液器吸头刮擦细胞。相同实验组通过 TGF-β(5μM/ml)处理 2 天,捕获图片,检测细胞迁移能力。
9.统计方法:采用 Graphpad Prism 6 软件进行统计分析并绘图,采用非配对双边 t 检验,实验数据用()表示,P<0.05 为差异有统计学意义。
结 果
结果显示,与正常口腔黏膜组织相比,ENPP1在 8 个 OSCC 组织中有 6 个显著上调 (如红色圆形框所示)(图 1A 和 B)。为进一步分析,笔者通过免疫组织化学染色检查了 16 对 OSCC 组织中 ENPP1的表达水平。结果表明,与正常口腔黏膜组织(N)相比,肿瘤组织(T)中其染色强度和染色范围显著增加(图 1C 和 D)。结果证实 ENPP1 高表达与 OSCC的发展密切相关。
ENPP1 在正常人口腔粘膜细胞系中表达较低,其在人 OSCC 细胞株(CAL-27 和 Tca-8113)中表达显著升高(图 2A)。为确定 ENPP1 在 OSCC 中的作用,我们使用 CAL-27 细胞建立 ENPP1 敲低细胞系(shENPP1-#1 和 shENPP1-#2),发现 shENPP1-#1敲低效果最佳(图 2B)。同时我们发现,与亲代细胞CAL-27(NS)相比,shENPP1-#1 细胞中的 CSC 标记NANOG、ABCG2、SOX2 和 CD44 显著降低(图 2C),证实 OSCC 细胞中上调的 ENPP1 对于维持肿瘤细胞的干细胞表型至关重要。
研究显示EMT可以促进肿瘤细胞的干性特征[9]。笔者发现 TGF-β 处理 CAL-27 细胞后,EMT标志物 vimentin 显著增加,同时降低 E-cadherin 的表达。但在 CAL27-shENPP1 细胞中,TGF-β 诱导EMT 的作用显著降低(图 3A,3B)。结果证实,下调ENPP1 能够抑制 OSCC 细胞 EMT 转化。

图1 ENPP1 在 OSCC 组织中表达升高A:OSCC 肿瘤组织(T)和癌旁正常口腔黏膜组织(N)中 ENPP1 的蛋白质印迹图;B:ENPP1 的蛋白质印 迹分析结果(n=8,*P<0.05vs 正常组 N);C.D:OSCC 肿瘤组织(T)和正常口腔黏膜组织(N)中 ENPP1 的免疫组织 化学染 色的代表性图像和评分(n=16,*P<0.05vs 正常组 N)。比例尺=100μm。
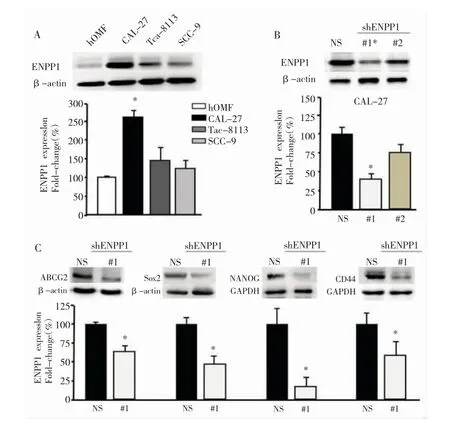
图2 下调 ENPP1 能够抑制 OSCC 细胞的干细胞表型A:ENPP1 在3种OSCC细胞系(CAL-27,Tac-8113,SCC-9)和正常人口腔粘膜细胞系中的表达和分析 (n=3,*P<0.05vs hOMF 细胞组);B:CAL-27细胞用非特异性 shNS 或 shENPP1-#1 和 shENPP1-#2 细胞稳定转染,检测ENPP1 的表达 (n=3,*P<0.05 vs NS 组);C:CAL-27 NS 或 shENPP1-#1 细胞系中 ABCG2,SOX2,NANOG 和 CD44 的癌症干细胞 marker 的表达和分析(n=3,*P<0.05 vs NS 组)
笔者通过划痕实验检测细胞的增殖迁移,发现CAL-27-NS细胞在48小时内迅速增殖,而CAL-27-shENPP1 细胞增殖速度显著降低(图 4A,4B)。TGF-β处理(5ng/ml)48小时之后,CAL-27-NS 和 CAL-27-shENPP1 细胞的迁移活性均增加,但两组仍存在显著差异(图4C,4D)。结合图3表明,ENPP1 在诱导 OSCC 细胞 EMT 转化和迁移中起到重要作用。

图3 ENPP1 敲低降低了 TGF-β 诱导的 EMTA、B:CAL27-NS 和 CAL27-shENPP1 细胞系用 TGF-β(5ng/ml) 处理 2天。免疫荧光染色分析 vimentin(绿色)和 E-cadherin(红色)的表达,通过共聚焦显微镜对 DAP(I蓝色)进行成像。比例尺=100μm。

图4 ENPP1 敲低降低了 CAL-27 的迁移A:CAL27-NS 和 CAL27-shENPP1 细胞系 48 小时迁移分析图,比例尺=200μm;B:细胞迁移能力分析 (n=3,*P<0.05 vs CAL-27-NS);C:TGF-β(5ng/ml)处理 48 小时后,CAL27-NS 和 CAL27-shENPP1 细胞系迁移分析图,比例尺=200μm;D:TGF-β(5ng/ml)处理细胞的迁移能力分析(n=3,*P<0.05 vs CAL-27 细胞 NS)。
讨 论
本研究发现,与正常口腔黏膜组织相比,ENPP1在 OSCC 患者肿瘤组织中大概率表达上调。笔者通过细胞实验敲低 ENPP1 的表达,有效抑制了 OSCC细胞干性,迁移活性和 EMT 表型,结果证实 ENPP1在维持 OSCC 的干性和转移中起重要作用。
ENPP1 是一种膜蛋白,可以水解三磷酸,二 磷酸和一磷酸核苷和二磷酸核苷多磷酸,并生成二磷酸核苷,一磷酸核苷,核苷,磷酸和无机焦磷酸盐(PPi)[10]。已有研究显示 ENPP1 在多种肿瘤恶化和发展中起重要作用,例如乳腺癌和肺癌[6,8]。本研究发现 ENPP1 在 OSCC 肿瘤组织中表达较正常粘膜明显升高。同时通过 GEO2R 软件分别对 Affymetrix 芯片数据集 GSE3524[11]和 GSE31853[12]中 ENPP1 mRNA 的表达进行了分析,发现 ENPP1 mRNA 在OSCC 特别是高分化 OSCC 肿瘤组织中高表达。结合笔者的实验数据,证实 ENPP1 与 OSCC 的恶化和发展密切相关。
肿瘤干细胞具有无限分裂增殖能力,其干细胞特性使得肿瘤细胞对放化疗药物产生抗性,导致肿瘤复发和治疗困难[13]。笔者发现,ENPP1shRNA 处理OSCC 细胞系 CAL-27 后,CAL-27-shENPP1 细胞系中肿瘤干细胞标志物NANOG、ABCG2、SOX2 和CD44 的表达显著降低。已有研究显示胶质母细胞瘤 CSC 中 ENPP1 mRNA 的表达较正常组织显著升高,这与胶质母细胞瘤中干性表型的增加有关[7]。本文结果也表明 ENPP1 在维持 OSCC 细胞干性中的重要作用,与文献结果报道一致。
有研究显示,EMT 对于诱导和维持干细胞样特征至关重要[14]。OSCC 是上皮来源的恶性肿瘤,上皮细胞 E-cadherin 表达降低预示着上皮细胞粘附的丧失,已被证实在 OSCC 的发展和预后中起关键因素[15]。有学者发现肿瘤相关巨噬细胞以及癌症相关成纤维细胞可促进癌细胞 EMT 转化,通过启动多条调控通路(ERK1/2/JNK、TGFb1/smad)[16],从而导致OSCC 的进展[17,18]。笔者将 CAL-27 细胞敲低 ENPP1,发现TGF-β诱导的EMT转化显著降低,同时CAL-27 细胞的迁移和增长也显著降低。有研究发现 ENPP1 在维持胶质母细胞瘤的间质化表型中发挥重要作用[7]。因此 ENPP1在OSCC 间质化表型和干细胞特征维持中起重要作用,然而 ENPP1 在介导EMT 和干性功能中是否通过类似通路机制尚不清楚,还需要进一步研究探索 ENPP1 的调控机制。
