协同刺激分子B7-H7在肿瘤中的表达及机制研究进展*
2020-06-16符圆圆吴昌平蒋敬庭苏州大学附属第三医院肿瘤生物诊疗中心江苏省肿瘤免疫治疗工程技术研究中心苏州大学细胞治疗研究院江苏常州213003
符圆圆,吴昌平,蒋敬庭(苏州大学附属第三医院肿瘤生物诊疗中心,江苏省肿瘤免疫治疗工程技术研究中心,苏州大学细胞治疗研究院,江苏常州213003)
免疫系统主要通过T细胞介导的细胞免疫识别和清除机体突变细胞,维持生理平衡。肿瘤的发生、发展与机体免疫监视功能异常及肿瘤免疫逃逸有关。研究发现,协同刺激分子参与肿瘤免疫逃逸,肿瘤转移及迁移的过程,在肿瘤的发生、发展、转移及预后中起重要作用,是构成肿瘤微环境的重要组成部分。协同刺激分子B7-H7是B7家族的新成员,目前研究发现,B7-H7在人类肿瘤组织中均有广泛表达,且与肿瘤的进展及预后相关[1]。B7-H7与TMIGD2受体结合,能抑制或促进T细胞功能,减少或增加细胞因子的产生[2-3],从而抑制或增强肿瘤的免疫应答,B7-H7可能成为肿瘤免疫治疗的新靶点。
1 协同刺激分子B7-H7的生物学特性及检测技术
1.1协同刺激分子B7-H7的生物学特性 B7-H7作为B7免疫球蛋白超级家族的成员[4],是人类CD28H的特定配体,最先发现其为人类内源性逆转录病毒H长末端重复序列结合蛋白2,被命名为HHLA2(human endogenous retrovirus-H long terminal repeat-associating protein 2,又称B7-H5)。B7家族成员包括B7-1、B7-2、诱导共刺激分子配体(inducible co-stimulator ligand,ICOS-L)、程序性死亡受体-配体1(programmed cell death protein 1,PD-L1)、PD-L2和B7x等,通常由1个IgV、1个IgC的胞外结构和1个胞质尾组成。B7-H7被证实与B7家族的其他成员之间存在23%~33%的氨基酸相似性;B7-H7具有1个氨基酸末端信号肽,其外功能区由串联的IgV-IgC-IgV的结构域、6-N-连接糖基化的位点、1个跨膜区和49-aa胞质尾构成[2]。B7-H7基因定位于3号染色体q13.13区域。其免疫活性与B7家族其他成员亦具有相似性,且与B7-H3及B7x(B7-H4/B7S1)同源性最高。
1.2协同刺激分子B7-H7的检测技术 Mager等[4]通过DNA基因测序技术首次在人和狒狒细胞中发现HHLA2基因,并进一步通过RT-PCR技术证实其编码的膜蛋白为B7-H7。目前已经开展的实验室检测协同刺激分子B7-H7的技术主要包括:(1)免疫组化染色分析及免疫荧光检测B7-H7在组织中的表达;(2)ELISA法和流式细胞技术检测B7-H7在细胞中的表达;(3)PCR技术检测外周血中HHLA2mRNA的表达等。
2 协同刺激分子B7-H7受体及免疫调控机制
2.1B7-H7受体 TMIGD2最先是作为一种内皮粘附分子被报道,又被称为富含脯氨酸受体的免疫球蛋白(immunoglobulin-containing and proline-rich receptor-1,IGPR-1)[2]。TMIGD2相对分子量(Mr)为31×107,是与CD28、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)、诱导共刺激分子(inducible co-stimulator,ICOS)和程序性死亡受体1(programmed cell death protein 1,PD-1)有10%氨基酸相似性的膜蛋白,因此被命名为CD28H。其分子结构包含有1个IgV的胞外区,1个跨膜区,1个富含脯氨酸且带有2个酪氨酸信号的胞质尾,该基因定位于人染色体19q13.3。
TMIGD2表达于人类及灵长类动物中,而在鼠类中不表达。TMIGD2在所有幼稚T细胞及多数自然杀伤细胞(natural killer cell,NK)上均有表达,而在调节性T细胞(regulatory cell,Treg)及B细胞上不表达。TMIGD2仅在约50%的记忆T细胞上表达,TMIGD2表达阴性的T细胞具有最终分化、衰老的表现,故而推测其在抗原递呈细胞上可能存在第二受体,但此第二受体目前尚未明确[5]。TMIGD2也在内皮细胞和上皮细胞表达,能促进细胞间相互作用,在细胞迁移及血管生成中起重要作用[6]。
2.2B7-H7-TMIGD2通路及调控机制 B7-H7具有调节T细胞的功能[7],但是其具有协同抑制还是协同刺激功能尚存在一定争议。有学者研究认为,B7-H7抑制T细胞增殖和细胞因子(INF-γ、TNF-α等)的产生[8]。另有研究显示,B7-H7可增加T细胞增殖及细胞因子的产生[3]。分析原因可能是B7-H7可以通过与不同的正、负受体结合而对T细胞功能产生的相反作用,但需进一步研究证实B7-H7是否存在双重调节机制。
Janakiram等[2]认为,B7-H7作为T细胞的协同抑制分子,抑制了CD4+和CD8+T细胞的增殖和细胞因子的产生。与PD-L1和B7-1不同的是,在T细胞上无法诱导B7-H7产生。B7-H7表达于人单核细胞,并由B细胞刺激后诱导产生。这种在免疫细胞表达的差异,提示B7-H7可能在免疫调节中具有与其他B7家族成员不同的功能。目前已证实B7-H7至少有两种上调机制,一种是炎症刺激:炎症通过刺激LPS和IFN-γ诱导B细胞,使单核细胞表达B7-H7增加;第二种是基因拷贝数的增加[9]。
抗原提呈细胞(antigen-presenting cell,APC)上的B7-H7与TMIGD2受体结合,通过AKT依赖的信号通路刺激幼稚T细胞增殖和细胞因子生成[5-10],TMIGD2在细胞迁移及血管生成中发挥作用[6]。当活化后的T细胞失去TMIGD2表达后,B7-H7即与T细胞上的第二受体结合,发挥对T细胞的共抑制作用[2]。如能明确第二受体,则可以明确B7-H7在免疫机制中的双重作用,以及在肿瘤微环境中的作用。B7-H7调控机制见图1。
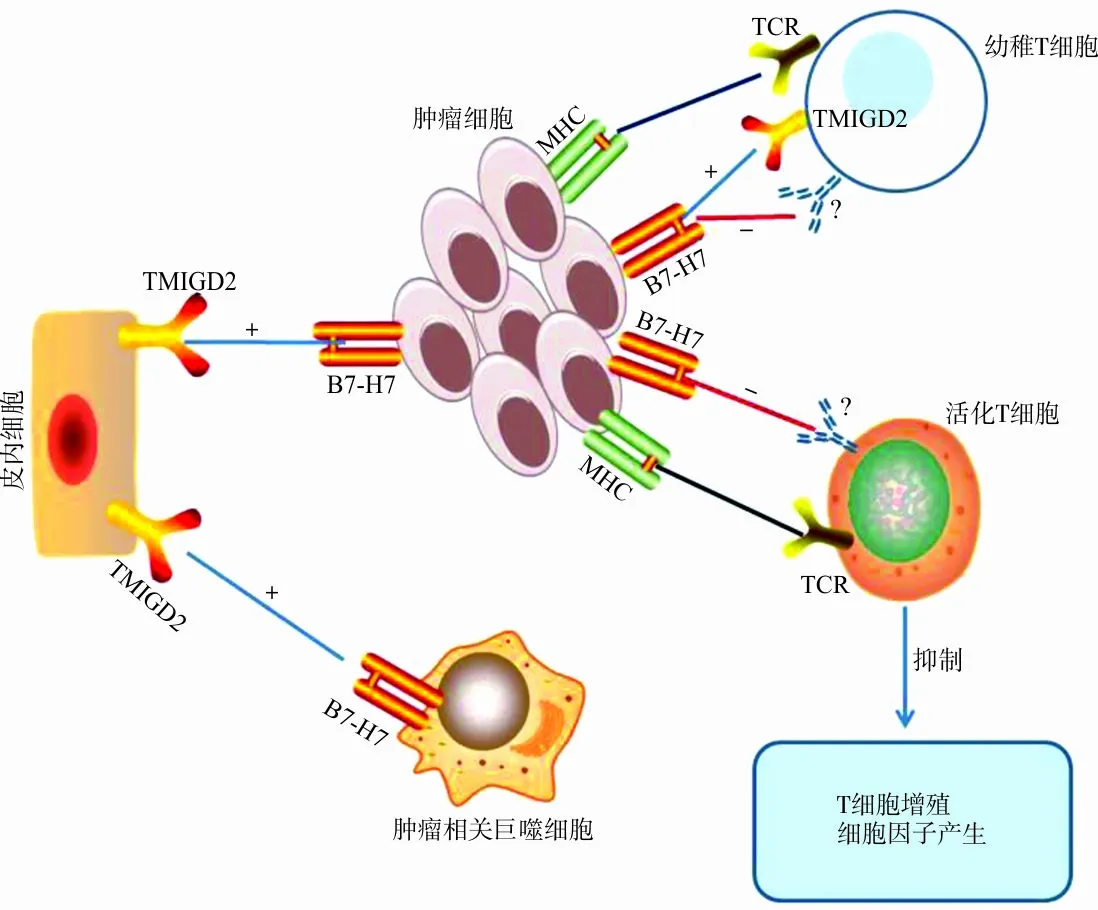
图1 B7-H7调控机制
3 协同刺激分子B7-H7在组织中的表达及意义
在物种表达方面,B7-H7蛋白直接同源物出现于鱼类、蛙类、熊猫、猴子及人类,而在鼠类中不表达。在人体组织中,除了胎盘滋养细胞,在肾脏、肠道、胆囊、膀胱、乳房组织的上皮细胞亦有表达,然而,B7-H7在正常人体组织中的表达量极少[5]。在肿瘤组织中B7-H7存在广泛表达(表1),B7-H7蛋白主要定位在肿瘤细胞中的细胞膜和细胞质。Janakiram等[1]研究发现,B7-H7在多种肿瘤组织中呈高表达,如乳腺癌(70.0%)、肺癌(66.7%)、甲状腺癌(66.7%),黑色素瘤(55.6%)、卵巢癌(50.0%)、胰腺癌(50.0%)、肝癌(40.0%)、膀胱癌(40.0%)、结肠癌(37.5%)、前列腺癌(33.3%)、肾癌(33.3%)和食道癌(20.0%)等。
3.1B7-H7与乳腺癌 一项回顾性研究收集了50例早期三阴乳腺癌患者样本并进行分析,结果发现B7-H7高表达与乳腺癌患者淋巴结阳性及较高的临床分期相关[1],而淋巴结阳性和较高的临床分期被认为是乳腺癌复发的危险因素。因此,B7-H7高表达患者更易发生肿瘤的进展及远处转移,预示B7-H7高表达的肿瘤具有更高的侵袭性,B7-H7与肿瘤免疫逃逸有关。另外,B7-H7在绝大多数三阴性乳腺癌中基因拷贝数增加(>95%),提示基因拷贝增加是B7-H7表达上调的机制之一。
3.2B7-H7与肺癌 B7-H7在正常肺组织中较少表达,而在肺癌中广泛表达。Cheng等[11]采用免疫组化染色法检测了非小细胞肺癌组织芯片,结果发现在679例非小细胞肺癌组织中有66%的病例表达B7-H7,且在肺腺癌中的阳性表达率(68.6%)显著高于肺鳞癌(35.4%)和大细胞癌(11.1%);其研究还发现, B7-H7表达水平的高低与组织内肿瘤浸润淋巴细胞(tumor infilt rating lymphocyte,TIL)密切相关,由此证实B7-H7在肿瘤微环境中起免疫抑制作用。
在另一项研究中,Cheng等[8]研究了B7-H7、B7x、PD-L1在非小细胞肺癌中的表达及其对T细胞增殖、细胞因子产生的影响,发现PD-L1极少与B7-H7及B7x共表达,约有78% PD-L1表达阴性的肺癌患者组织中存在B7-H7或B7x表达,且B7-H7与B7x常出现共表达。另有研究发现,此三者均抑制了T细胞受体(T cell receptor,TCR)介导的T细胞增殖并抑制T细胞产生细胞因子,且B7x和B7-H7对T细胞增殖的抑制作用比PD-L1更强[8]。目前,CTLA-4、PD-1、PD-L1抑制剂已经用于临床肺癌治疗,PD-L1抑制剂使一部分PD-L1表达阳性的患者获益[12],对于PD-L1阴性的患者,B7-H7可能是新的免疫治疗的方向,也为实现联合肿瘤免疫治疗提供了新思路。
3.3B7-H7与胃癌 Shimonosono等[13]采用定量RT-PCR检测111例胃癌患者与20例健康志愿者外周血标本中B7-H7的表达水平,结果发现胃癌患者B7-H7mRNA的拷贝数(0.515±0.228)显著低于对照组(1.140±0.509)。此外,进一步对其进行单变量分析,结果发现B7-H7低表达与肿瘤浸润深度、远处转移以及肿瘤分期晚期密切相关。高表达患者的5年生存率(77.6%)显著高于低表达患者(46.5%)。进一步进行多变量分析显示,B7-H7不是独立预后因素,而远处转移和血清高CEA水平是胃癌预后较差的独立影响因子。该结果与B7-H7在乳腺癌及骨肉瘤等肿瘤中的研究结果不同,故而推测B7-H7可能存在免疫双重作用。另外,该研究通过免疫组化染色法检测了73例胃癌组织,结果发现B7-H7表达于肿瘤细胞膜、细胞质及正常上皮细胞,且证实B7-H7mRNA在血液与组织中的表达水平存在弱相关关系,故可以通过检测患者外周血标本,推测肿瘤原发部位中B7-H7的表达水平。

表1 协同刺激分子B7-H7在肿瘤中的表达及生物学意义
3.4B7-H7与结肠癌 B7-H7在结肠癌组织及癌旁组织中均有表达,在癌组织中主要表达于肿瘤细胞的细胞膜、细胞质及基质的成纤维细胞中,而癌旁组织中多表达于肠上皮及巨噬细胞。Zhu等[14]检测了63例结肠癌患者癌及癌旁组织中B7-H7与CD8的表达,结果发现B7-H7在癌组织中的表达水平较癌旁组织明显升高,并且证实B7-H7高表达的结肠癌组织中CD8+T细胞显著少于低表达组织(15.9% vs 33.3%)。此外,其还发现B7-H7表达水平较高的患者生存期显著低于表达水平较低的患者;单因素分析结果显示,B7-H7高表达与更差预后相关;多因素分析结果显示,B7-H7高表达与淋巴转移是预后较差的独立影响因素。进一步证实了B7-H7在肿瘤微环境中具有抑制T细胞的作用,从而使肿瘤免疫逃逸,促进肿瘤生存生长。
3.5B7-H7与膀胱癌 Sankin等[15]研究显示,超过50%的高级别泌尿系肿瘤患者高度表达B7-H7,并证实其与肿瘤不良预后相关,B7-H7高表达可抑制T细胞的免疫应答,从而导致肿瘤的免疫耐受能力提高。
Lin等[16]用免疫组化染色法及qRT-PCR检测了212例膀胱癌组织及36例正常组织,结果发现B7-H7在癌组织中的表达显著高于正常组织(表达阳性率分别为77.8%和22.2%),且证实B7-H7高表达与淋巴转移有关,B7-H7表达与临床分期是膀胱癌的独立预后因素,B7-H7高表达的患者无复发生存期(recurrence-free survival,RFS)及总生存期(overall survival,OS)显著低于低表达患者。其还发现B7-H7在膀胱癌诊断中的敏感性为82%,特异性为87%,与目前临床上使用的生物标志物——血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)(敏感性83%,特异性87%)相比,诊断效率相当,故而认为B7-H7可能成为新的肿瘤标志物及预后指标。
3.6B7-H7与骨肉瘤 研究证实,几乎所有骨肉瘤转移性瘤中均表达B7-H7,且转移的原发病灶中B7-H7的表达比未转移更高(93% vs 53%)[17],表明高表达B7-H7的肿瘤细胞具有更强的侵袭能力。其还发现B7-H7高表达患者OS及无PFS显著低于低表达患者,在骨肉瘤组织中,B7-H7比PD-L1表达阳性率更高(56% vs 25%)。
3.7B7-H7与胰腺癌 在胰腺组织中,B7-H7极少表达于正常腺泡、导管及胰岛细胞,但是在早期癌前病变至侵袭性癌组织中广泛表达,阳性率约为95%。胰腺癌患者中B7-H7高表达组比低表达组的生存期显著延长。B7-H7表达与CD8+T细胞密度存在显著相关性[18]。显示了B7-H7在胰腺癌中主要发挥协同刺激作用。
3.8B7-H7与肾透明细胞癌(clear cell renal cell carcinoma,ccRCC) Chen等[19]检测了90例ccRCC患者癌组织和癌旁组织中的B7-H7表达水平,结果发现B7-H7在癌组织中的表达水平高于癌旁组织,且B7-H7低表达的ccRCC患者的OS显著高于高表达患者,并证实B7-H7表达水平是预后独立风险因素。该研究还首次从细胞水平观察到B7-H7下调后降低了肾癌细胞增殖、转移、侵袭能力,并通过检测上皮间质转化(epithelial-to-mesenchymal transition,EMT)标志物上皮钙粘素(e-cadherin)、神经钙粘素(N-cadherin)及波形纤维蛋白(Vimentin)水平证实B7-H7参与了肿瘤EMT进程,促进了肿瘤的发生、发展。
另一项研究也显示,在ccRCC组织中B7-H7表达水平几乎是正常组织中的8倍,且在94.5%的ccRCC中呈现高表达,B7-H7高表达与肿瘤远处转移相关,B7-H7高表达的患者预后较差[20]。
3.9B7-H7与口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC) Xiao等[21]首次采用免疫组化染色法在肿瘤中同时检测了B7-H7及TMIGD2受体,结果显示大多数OSCC表达B7-H7,而正常口腔粘膜极少表达B7-H7;而TMIGD2结果相反,其在大多数正常口腔粘膜表达,而在OSCC很少表达。生存分析结果显示,B7-H7高表达的OSCC患者生存期显著减少,同样TMIGD2高表达的OSCC患者生存期显著减少。TMIGD2是B7-H7的受体,但是TMIGD2只表达于幼稚T细胞,其他免疫细胞不表达TMIGD2,所以在肿瘤组织中B7-H7与TMIGD2表达不同步,肿瘤微环境中B7-H7不可能与TMIGD2结合抑制免疫,B7-H7必然存在另外的受体,但需进一步研究明确。
3.10B7-H7与肝癌 Jing等[22]用免疫组化方法检测了B7-H7和PD-L1在肝癌组织中的表达,结果发现B7-H7的表达水平(49%)显著高于PD-L1(28.1%),且少见两者共表达。B7-H7高表达是肝癌预后差的独立影响因素。
4 小结及展望
协同刺激分子B7-H7是B7家族成员,通过T细胞及其他免疫细胞上的受体结合使肿瘤逃避免疫攻击,且能与TMIGD2受体相互作用促进血管生成,影响肿瘤微环境。现有的研究证实其在许多肿瘤中广泛表达,参与了肿瘤免疫的过程,与肿瘤进展及预后相关,提示B7-H7可能成为肿瘤免疫检查及治疗的新靶点。然而,相关研究也表明协同刺激分子B7-H7可能存在双重免疫功能,类似于B7家族其他成员如B7-H3、B7x也都曾报道存在双重作用,这取决于免疫环境的不同,受体参与或阻断,或与不同受体的相互作用[18]。因此,对于B7-H7肿瘤中的表达及预后意义仍需展开广泛深入的研究,探究其在肿瘤中的免疫调控机制,从而为肿瘤的免疫治疗提供新的策略。
