厌氧菌预还原琼脂平板培养方法
2020-06-16宫利宏王贵平
郑 昕, 宫利宏, 杨 毅, 王贵平, 尹 崇
(湖南农业大学 动物医学院,湖南 长沙 410128)
厌氧菌是在无氧环境中才能生长的细菌[1],肠道菌群中90%以上为厌氧菌[2]。受培养条件限制,厌氧菌研究的开展程度远不及非厌氧菌[3]。亨氏滚管法和厌氧培养箱是目前分离培养厌氧菌最可靠的方法,但是设备的购置和运行都需要很高的费用[4]。厌氧罐和厌氧袋是分离培养厌氧菌更为常用的方法,但是在操作与耗氧过程中,仍然使细菌暴露氧气一段时间,非芽胞专性厌氧菌的初始分离培养较难用此方法获得[5-6]。深层试管法和庖肉培养基是在普通条件下培养厌氧菌的常用方法,但是这些液体培养方法无法对厌氧菌进行分离纯化培养[7]。如上因经费和方法的限制,使得广大基层细菌实验室难以开展厌氧菌研究。本研究改进庖肉培养基,用以代替硫化钠等制备无氧试剂,在琼脂柱下进行菌液倍比稀释,并将厌氧琼脂平板进行预还原。通过厌氧指示剂全程监测,专性厌氧菌青春双歧杆菌分离培养,鸡源肠道乳酸杆菌及Veillonellamagna的分离鉴定,证明该方法无需特殊厌氧设备,即可在普通实验条件下有效分离厌氧菌。
1 材料与方法
1.1 材料
1.1.1 菌种来源 枯草芽胞杆菌(Bacillussubtilis)由湖南农业大学动物医院微生物实验室分离保存;青春双歧杆菌(Bifidobacteriumadolescentis)为市售双歧杆菌活菌胶囊。
1.1.2 培养基 TPY液体培养基、TPY琼脂培养基(青岛高科园海博生物技术有限公司);营养琼脂培养基(国药集团化学试剂有限公司)。
1.1.3 试剂与仪器 厌氧指示剂(将300 μL 0.5%美蓝水溶液、600 μL 0.1 mol/L KOH和6 g葡萄糖分别用100 mL蒸馏水等量稀释后混匀)[8];注射器;15 cm针头;细菌基因组DNA提取试剂盒(北京天根生化科技有限公司产品);手提式压力蒸汽灭菌器(上海申安医疗器械厂);超净工作台(苏州安泰空气技术有限公司);生化培养箱(广东省医疗器械厂)。
1.2 方法
1.2.1 预还原琼脂平板制备方法 预还原琼脂平板培养法需制备如下三部分:①无氧稀释液:在试管内分装庖肉液体培养基[8],用倒立小试管或自制铁丝网将肝粒承托,使之悬于液面下,高压灭菌备用(图1A);②厌氧倍比稀释管:取蒸馏水和琼脂粉配置成1%琼脂,加热溶解后分装至试管中,每个试管约5 mL,高压灭菌备用(图1B的0号试管);③预还原琼脂平板:由大培养皿(直径150 mm)和小培养皿(直径80 mm)组成,皿盖上都打小孔并粘贴胶塞密封,以小孔为中心在皿盖上画出垂直十字线。小培养皿用于培养厌氧菌,大培养皿用于培养耗氧菌(图1C)。在超净工作台中将灭菌的TPY琼脂培养基倒入小培养皿,等待凝固后倒置,加入玻璃珠,将小培养皿盖上的十字线和大培养皿盖上的十字线重叠,使两培养皿胶塞孔对准。营养琼脂铺满大培养皿上下两个面,在上下两个面上均匀接种枯草芽胞杆菌[9],合住大培养皿上下两面,用融化的1%琼脂注入大培养皿盖与底的缝隙,待凝固后套上橡皮筋固定(图1D)。放入湿盒中于培养箱中培养48 h进行预还原备用。

图1 厌氧菌培养装置示意图Fig.1 Schematic diagram of anaerobic bacteria culture devicea:肝粒;b:稀释液;c:1%琼脂;d:大培养皿;e:小培养皿;f:营养琼脂培养基;g:TPY琼脂培养基;h:胶塞;i:玻璃珠a: liver granules; b: diluent; c: 1% agar; d: large petri dish; e: small petri dish; f: nutrient agar medium; g: TPY agar medium; h: rubber plug; i: glass beads
1.2.2 预还原琼脂平板操作方法 ①用安装长针头的注射器将样本菌液注射接种到庖肉培养基中,放入培养箱中增菌培养24~48 h;②注射器吸取少许无氧稀释液,置换注射器和长针头内空气后,取1.8 mL无氧稀释液和0.2 mL增殖菌液,酒精灯灼烧稀释管底部3~5 s,使底部琼脂融解形成缝隙,长针头穿过琼脂柱将稀释菌液打入1号稀释管底部,混匀3次,照此方法依次倍比稀释至10-7(图1B);③分别从6号稀释管和7号稀释管中吸取50 μL稀释菌液,穿过预还原琼脂平皿胶塞孔接种到TPY琼脂培养基表面,通过前后左右倾斜使玻璃珠在小培养皿内反复滑滚,将接种菌液涂匀后放入培养箱中培养48 h观察菌落形成。
1.2.3 预还原琼脂平板培养法无氧效果检测情况 ①厌氧指示剂检测:厌氧指示剂替代蒸馏水,配制庖肉培养基、倍比稀释液,检测倍比稀释过程的无氧效果。在厌氧指示剂中加入2%的琼脂粉,加热溶解后注入到小试管内,置沸水浴加热至无色,等待凝固后将小试管放入小培养皿中,预还原48 h后模拟细菌接种操作,通过观察厌氧指示剂的颜色变化检测预还原琼脂平板的无氧效果。②双歧杆菌分离培养检测:取市售双歧杆菌活菌胶囊内菌粉颗粒,用TPY液体培养基增菌24 h,取10-6和10-7稀释菌液注射接种至预还原琼脂平板和普通TPY琼脂平板,置培养箱中培养48 h。用接种环挑取单个菌落,革兰染色镜检观察菌体形态。细菌基因组提取试剂盒提取菌株DNA,16S rRNA 通用引物 27F(5′-AGAGTTTGATCMTG-GCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGAC-TT-3′)扩增目的片段。将扩增产物送生工生物工程(上海)股份有限公司测序,测序结果在NCBI网站BLAST进行同源性比较。
1.2.4 预还原琼脂平板培养法的试用 ①细菌分离培养:取鸡盲肠内容物,用TPY液体培养基增菌24 h,取10-6和10-7稀释菌液注射接种至预还原琼脂平板和普通TPY琼脂平板,置培养箱中培养48 h。②细菌形态学观察及种属分析:挑取单个菌落纯化3代后,革兰染色镜检观察菌体形态。细菌基因组提取试剂盒提取菌株DNA,16S rRNA通用引物27F、1492R;dnaK基因测序引物B1(5′-ATTGAYTTAGGWACAACAAA-3′)、 B2(5′-GCTTTTTCAGCHGCDTCYTT-3′)[10]扩增目的片段,将扩增产物送生工生物工程(上海)股份有限公司测序,测序结果在NCBI网站BLAST进行同源性比较,用MEGA7软件构建系统进化树。
2 结果与分析
2.1 预还原琼脂平板培养法无氧效果
2.1.1 稀释液的无氧效果 如图2所示,1号试管用厌氧指示剂空白对照;2号试管底部加入数颗肝粒;3号试管在2号试管基础上添加1 mL液体石蜡;4号试管用倒立小试管将肝粒托起。结果显示,2号和3号试管在肝粒周围形成无氧区域,且加了液体石蜡的3号比2号无氧区域稍有增加,而将肝粒托起的4号试管无氧效果最好,只有液体表面变蓝,试管内均为无氧。

图2 稀释液的无氧效果Fig.2 Anaerobic effect of diluenta:肝粒;b:液体石蜡a: liver granules; b: liquid paraffin
2.1.2 厌氧稀释管无氧效果 将图2中4号试管所制备的无氧稀释液直接注入1号空试管,因与氧气接触,溶液立即呈现绿色;将无氧稀释液穿过琼脂打入2号试管底部,虽也变色但相比1号颜色稍浅;用少许无氧稀释液置换注射器和针头的空气后吸取稀释液并穿过琼脂打入3号试管底部,仅轻微变色(图3)。说明排尽注射器内空气后吸取无氧稀释液再打入厌氧稀释管中,能够有效减少菌样与氧气接触。

图3 厌氧稀释管无氧效果Fig.3 Anaerobic effect of anaerobic dilution tube
2.1.3 预还原琼脂平板无氧效果 2%琼脂厌氧指示管放入小培养皿内,大培养皿接种枯草芽胞杆菌(图4A)。培养6 h后(图4B)厌氧指示瓶管口呈蓝色;24 h后(图4C)厌氧指示瓶管口蓝色部分颜色变浅;48 h后(图4D)厌氧指示瓶管口蓝色消失说明厌氧盒内为无氧,模拟接种后,未见指示剂有颜色变化,说明需氧菌生长耗尽平皿内氧气且该方法密封良好,接种操作没有破坏厌氧平皿内的预还原效果。
2.1.4 双歧杆菌分离培养效果 市售双歧杆菌活菌胶囊内菌粉颗粒经过增殖、倍比稀释注射接种到预还原琼脂平板表面后,在预还原琼脂培养基上生长良好,而普通培养条件下不生长。镜检呈革兰阳性,短杆状(图5A)。将16S rDNA序列在NCBI网站BLAST进行同源性比较,与Bifidobacteriumadolescentisstrain KLDS 2.0609相似度为98.86%,确认为青春双歧杆菌。

图5 革兰染色结果Fig.5 Gram staining
2.2 试用结果
从鸡盲肠内容物中分离到15株厌氧菌,其中14株乳酸杆菌,在普通培养条件下生长贫瘠甚至不生长,而在预还原琼脂平板上生长良好;1株韦荣球菌(命名为HM-1),严格厌氧的革兰阴性无芽胞球菌(图5B),在普通培养条件下不生长,而在预还原琼脂平板上生长良好。韦荣球菌的16S rDNA基因扩增片段1 426 bp(图6A),序列上传到NCBI网站,序列登录号为MK088246,与Veillonellamagnalac18T[11]菌株相似度为99.8%。
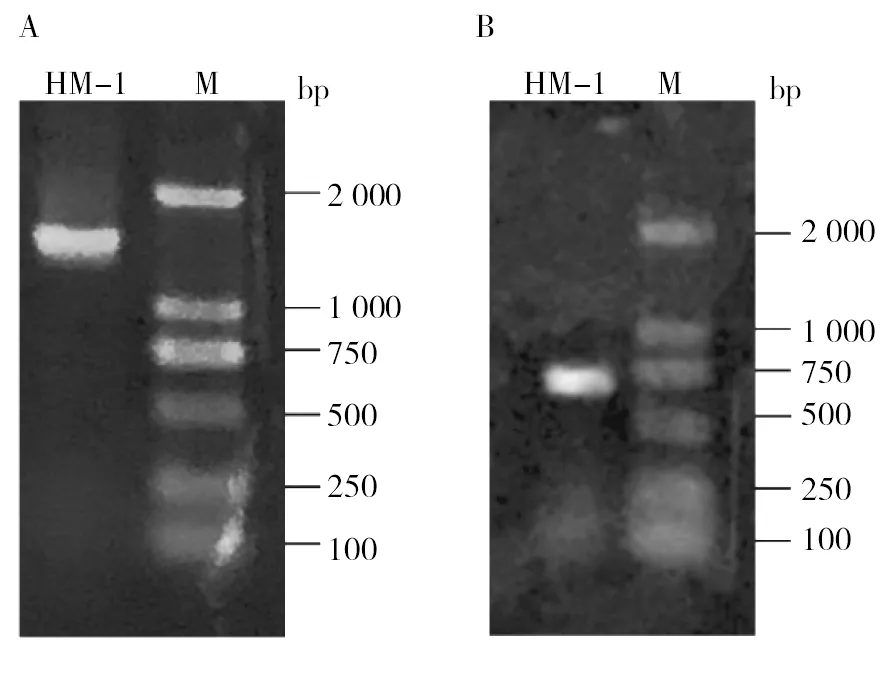
图6 PCR扩增结果Fig.6 PCR amplification resultsM: 2 000 bp DNA Marker
dnaK基因扩增片段587 bp(图6B),与Veillonellamagnalac18T菌株相似度为99.49%。选取与其同源性最高的韦荣球菌核酸序列进行同源性分析,构建neighbor-joining(NJ)进化树(图7)。由图7可见,HM-1号菌株与Veillonellamagnalac18T模式菌株处于同一个进化分支,同源性最高。

图7 基于16S rRNA基因序列构建的系统发育树Fig.7 Neighbor-Joining phylogenetic tree based on 16S rRNA gene sequences参与比对序列的 GenBank 登录号列于括号中;分支处标注有自展值;标尺所示长度为 0.005 核苷酸置换率The GenBank accession numbers of aligned sequences are shown in the brackets; The bootstrap values are shown at the node; Bar 0.005 means the nucleotide substitution rate of 0.005
3 讨 论
亨氏滚管技术和厌氧手套箱技术因为设备昂贵、操作复杂,大多数基层实验室不能满足这样的条件,所以依然有人在试图寻找简易的厌氧菌培养方法[12-15]。厌氧罐和厌氧袋由于在操作过程中易与氧气接触而较难分离到非芽胞专性厌氧菌[16]。为了减少菌液与氧气接触机会,通常应用无氧试剂进行菌液稀释。但由于无氧试剂所采用的硫化钠等试剂性质不稳定,存放期间如果暴露空气容易吸潮和氧化。动物组织块经过高温处理,也能在液体培养基中制造稳定厌氧环境,在配置液体培养基时加入0.01%的琼脂(通常0.05%)能够有效防止液体对流,减慢氧气扩散,因而深层试管庖肉培养基是在普通培养条件下培养厌氧菌的常用方法。通过对深层试管庖肉培养基制备方法进行改进,将肝粒用倒立的小试管托起至培养基液面下,从而获得足量用于倍比稀释的无氧稀释液。在稀释的过程中也充分考虑氧气的排除问题,每次使用注射器和长针头均用预还原的厌氧肝汤置换注射器和长针头内的空气,并注射到1%琼脂柱下面,最大可能减少样本与氧气接触。最终将无氧倍比稀释菌液注射接种到预还原琼脂平板表面,使厌氧菌能在固体培养基上形成单个菌落。本研究双歧杆菌的成功培养以及成功分离到HM-1非芽胞专性厌氧菌都证明了该方法的可靠性。如若在临床上应用,可省去增菌和稀释两个步骤将样本直接注射接种到预还原琼脂平板表面,相比早年 Chan等[17]对亨氏滚管方法的改进,此方法更加简便。预还原琼脂平板装置中的大培养皿也可用厌氧袋代替,在厌氧袋外需进针处粘贴胶塞密封,在袋内放另一平皿培养需氧菌或用市售厌氧产气袋耗氧。本研究设计方法操作简单,有望被基层实验室采用。
