表皮生长因子受体靶向药物对进展期胰腺癌治疗作用的Meta分析
2020-06-16周子栋李仁礼张文成夏时海
周子栋, 李仁礼, 陈 凯, 张文成, 夏时海
1 武警后勤学院, 天津 300309; 2 武警特色医学中心 消化疾病研究所, 天津 300162;3 武警特色医学中心 肝脏胰腺纤维化与分子诊疗重点实验室, 天津 300162
胰腺癌的预后非常差,其突出表现为发病率和死亡率之间的密切平行关系[1],80%以上的病例在确诊时已经是晚期[2],5年生存率约5%,中位生存期<11个月,胰腺导管腺癌预后极差,是西方社会癌症相关死亡的第四大原因[3]。我国的最新统计数据[4-5]也显示,胰腺癌居北京市和上海市人群恶性肿瘤死亡率的第5位。胰腺癌组织中表皮生长因子受体(EGFR)及其配体表达增加,预示着预后不良[6-7]。EGFR也称为ERBB1或HER1,是一种跨膜酪氨酸激酶受体[8],属于细胞表面受体酪氨酸激酶ERBB家族[9],EGF与EGFR结合,会引发该受体与ERBB其他成员形成同源二聚体或异源二聚体,即HER2,受体磷酸化并激活下游效应因子,如RAS-RAF-MEK-ERK-MAPK和PI3K-AKT-mTOR,导致细胞增殖。
EGFR在高达90%的胰腺癌细胞中过表达[10],以EGFR为靶点的药物分为两类,一类为单克隆抗体,如西妥昔单抗、尼妥珠单抗等;另一类为小分子酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼等。目前我国及国外的最新胰腺癌诊治指南[11-13]给出了胰腺癌的一、二线辅助化疗方案,但均未纳入EGFR靶向药物。本文旨在为EGFR靶向药物治疗进展期胰腺癌提供循证医学证据。
1 材料与方法
1.1 文献检索及策略 英文文献检索自EMbase、PubMed和Cochrane Library数据库,中文文献检索自中国知网、万方和维普数据库。最后在Clinical Trials网站检索注册的临床试验。上述检索时间均截至2019年8月13日。
检索英文文献时,根据目前已有相关研究的EGFR靶向药物,按照“PICO”模式,在EMbase和Cochrane Library数据库以“pancreatic cancer”“pancreatic neoplasm”“pancreatic adenocarcinoma”“EGFR”“targeted therapy”“panitumumab”“cetuximab”“nimotuzumab”“matuzumab”“gefitinib”“erlotinib”“icotinib”“afatinib”“osimertinib”“lapatinib”为主题词进行检索;在PubMed数据库以上述词汇的MeSH词进行检索(上述药物英文通用名、商品名等代称均包含在相应MeSH词表中),检索式为:“pancreatic neoplasm”[Mesh] and((“EGFR”[Mesh] or “targeted therapy”[Mesh]) or (“panitumumab”[Mesh] or “cetuximab”[Mesh] or “nimotuzumab”[Mesh] or “matuzumab”[Mesh] or “gefitinib”[Mesh] or “erlotinib”[Mesh] or“icotinib”[Mesh] or“afatinib”[Mesh] or“osimertinib”[Mesh] or “lapatinib”[Mesh]))。检索中文文献时以“胰腺癌”“表皮生长因子受体”“靶向药物”“帕尼单抗”“西妥昔单抗”“尼妥珠单抗”“马妥珠单抗”“吉非替尼”“厄洛替尼”“埃克替尼”“阿法替尼”“奥西替尼”“拉帕替尼”为主题词进行检索。
1.2 筛选原则 检索结果分别由两位评价者根据考科兰系统评价手册(Cochrane Handbook for Systematic Reviews of Interventions)进行初筛和全文筛选,若结论不一致通过讨论解决分歧。如果讨论仍无法解决分歧,由第三位评价者进行判断和仲裁。
1.3 纳入标准
1.3.1 研究对象 患者年龄≥18岁、组织学或细胞学检查证实为不可切除的进展期胰腺癌(包括局部进展和远处转移)、肿瘤病灶可测量(根据实体瘤疗效评价标准RECIST 1.0)。
1.3.2 文章类型和试验性质 论著、临床随机对照试验、可提取有效数据。
1.4 干预措施 试验组为EGFR靶向药物或EGFR靶向药物联合胰腺癌常规化疗药物,对照组为安慰剂或安慰剂联合胰腺癌常规化疗药物。
1.5 结局指标 主要结局指标为:总生存期和无进展生存期;次要结局指标为:疾病控制率和客观缓解率,纳入研究的结果应至少包含一条主要结局指标。
1.6 排除标准
1.6.1 研究对象 可手术切除的早期胰腺癌患者,合并其他原发性肿瘤患者,接受其他辅助治疗6个月以内患者,近期接受过大型手术患者,血液学指标、肝功能、肾功能明显异常患者。
1.6.2 文章类型和试验性质 重复发表的文献,其他语言的文献、综述、病例报道等,非随机试验,单臂无对照组试验,回顾性研究。
1.7 资料提取质量评价
1.7.1 资料提取 由前述2位研究者提取资料,资料提取内容包括作者名称、发表时间、期刊名称、国家和地区、是否多中心、研究时程、临床试验登记注册号、诊断情况、治疗方案、结局指标、纳入患者样本量、患者平均年龄、性别构成。
1.7.2 质量评价 由前述2位研究者对文献进行质量评价,评价工具包括Cochrane风险偏倚评估表、改良Jadad评分(1~3分为低质量文献,4~7分为高质量文献)等。
1.8 统计学方法 采用RevMan 5.3对结果进行Meta分析。总生存期与无进展生存期为连续性变量,采用风险比(HR),疾病控制率和客观缓解率为二分类变量,采用相对危险度(RR)作为合并统计量。对于文献中未直接给出总生存期和无进展生存期的HR值的,通过Engauge Digitizer 4.1软件对其生存曲线进行连续取点法获取生存率,根据Tierney等[14]提供的Excel程序文件计算得到HR、95%可信区间(95%CI)、lnHR和SelnHR值。利用异质性检验判断纳入研究之间的异质性,Q值通过χ2检验得出。若I2≤50%或P>0.10时,可认为多个同类研究具有同质性,使用固定效应模型计算合并统计量。当I2>50%或P≤0.10时,首先分析导致异质性的原因,然后利用STATA 12.0软件进行敏感性分析,找出异质性来源,并用亚组分析进行合并统计量的计算。若经上述方法处理后,多个研究的结果仍然有异质性,则采用随机效应模型计算合并统计量。最后用Begg’s检验和Egger’s检验评价发表偏倚。
2 结果
2.1 文献检索结果 共检索到中文文献0篇,英文文献9453篇,排除来自不同数据库的重复文献8240篇,实际检索到1213篇。通过阅读题目和摘要,排除综述、病例报道、通讯和用其他语言发表的文献,初筛得到189篇。通过阅读全文排除单臂研究、非随机研究、非对照研究、纳入两种及以上EGFR靶向药物的研究181篇,最后纳入8篇文献[15-22],合计2382例患者。纳入文献基本信息见表1,Cochrane风险偏倚评估见图1。

图1 纳入研究的偏倚风险
2.2 纳入文献 纳入8篇文献的改良Jadad评分显示均为高质量文献(表1)。8篇文献均包含主要结局指标总生存期, 其中5篇直接给出了HR值和95%CI,剩下3篇通过文献中的生存曲线求得。6篇文献提供了主要结局指标无进展生存期,其中5篇直接给出了HR值和95%CI,剩余1篇通过生存曲线求得。次要结局指标疾病控制率和客观缓解率各有6篇文献报道。
2.3 偏倚风险 Begg’s检验(Pr>|z|=0.711)和Eggers’s检验(P>|t|=0.126)结果显示本文纳入8篇文献无明显发表偏倚(图2)。Cochrane偏倚风险评估表显示纳入文献报告偏倚风险较低(图1)。
2.4 Meta分析结果
2.4.1 总生存期
2.4.1.1 纳入研究的总生存期 纳入的8个研究均报道了总生存期,其中尼妥珠单抗治疗1篇,西妥昔单抗治疗3篇,厄洛替尼治疗4篇,异质性检验提示异质性显著(P=0.010,I2=62%),采用随机效应模型,结果显示试验组与对照组的总生存期差异无统计学意义(HR=0.86,95%CI:0.74~1.02,P>0.05)(图3),为寻找原因进一步进行亚组分析。

表1 纳入文献基本信息

作者治疗方案结局指标纳入患者(例)试验组对照组失访患者(例)试验组对照组平均年龄(岁)试验组对照组男∶女(例)试验组对照组Jadad评分Schultheis等[22]gem+nimo vs gem+placeboOS、PFS、DCR、ORR9696336463.261∶3255∶386Cascinu等[16]gem+cis+cet vs gem+cisOS、PFS、DCR、ORR424221616429∶1322∶207Philip等[17]gem+cet vs gemOS、DCR、ORR372371101463.764.351∶4954∶465Burtness等[20]doc+iri+cet vs doc+iriOS434432606037∶624∶204Hammel等[21]gem+erlo vs gemOS、PFS219223无无6364111∶108117∶1065Wang等[19]gem+erlo vs gemOS、PFS、DCR、ORR4444无无67.470.332∶1233∶117Moore等[15]gem+erlo vs gem+placeboOS、PFS、DCR、ORR285284131363.764136∶149162∶1227Propper等[18]erlo vs placeboOS、PFS、DCR、ORR10410332未给出未给出59∶4559∶446
注:OS,总生存率;PFS,无进展生存期;DCR,疾病控制率;ORR, 客观缓解率。gem,吉西他滨;nimo,尼妥珠单抗;cis,顺铂;cet,西妥昔单抗;doc,多西他赛;iri,伊立替康;erlo,厄洛替尼;placebo,安慰剂。
2.4.1.2 按药物分类亚组分析 按药物分类做亚组分析,单克隆抗体类纳入4个研究,异质性检验提示无异质性(P=0.40,I2=0%),采用固定效应模型;酪氨酸激酶抑制剂类纳入4个研究,异质性检验提示异质性显著(P=0.001,I2=81%),采用随机效应模型, 结果显示两组治疗效果差异均无统计学意义(单克隆抗体组HR=0.90,95%CI:0.80~1.02,P>0.05;酪氨酸激酶抑制剂组HR=0.83,95%CI:0.61~1.12,P>0.05)(图4)。

注:a,Begg’s 检验;b,Egger’s 检验。

图3 试验组和对照组总生存期的Meta分析
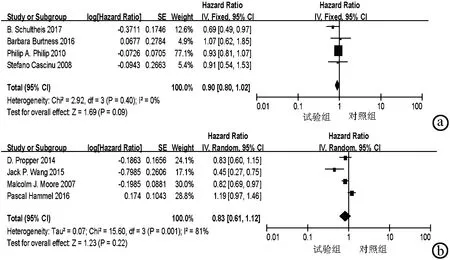
注:a,单克隆抗体组总生存期的Meta分析;b,酪氨酸激酶抑制剂组总生存期的Meta分析。
图4按药物分类亚组总生存期的Meta分析
2.4.1.3 排除敏感性最高研究后亚组分析 排除敏感性最高的研究1项后,合并剩余7项研究,异质性检验提示异质性不显著(P=0.13,I2=40%),采用固定效应模型,结果显示EGFR靶向药物能提高进展期胰腺癌患者的总生存期(HR=0.85,95%CI:0.77~0.94,P<0.05)(图5)。

图5 排除异质性来源亚组总生存期的Meta分析
2.4.1.4 远处转移患者亚组分析 2项研究仅纳入了远处转移患者,其中西妥昔单抗治疗和厄洛替尼治疗各1篇,异质性检验提示异质性显著(P=0.02,I2=81%),采用随机效应模型,结果显示EGFR靶向药物不能提高发生远处转移的胰腺癌患者总生存期(HR=0.69,95%CI:0.30~1.61,P>0.05)(图6)。

图6 远处转移患者亚组总生存期的Meta分析
2.4.1.5 发生皮疹患者亚组分析 2项研究报道了试验组患者发生皮疹,异质性检验提示异质性不显著(P=0.21,I2=37%),采用固定效应模型,结果显示EGFR靶向药物治疗后发生皮疹的患者具有更良好的总生存期(HR=0.70,95%CI:0.54~0.92,P<0.05)(图7)。

图7 发生皮疹患者亚组总生存期的Meta分析
2.4.2 无进展生存期
2.4.2.1 纳入研究的无进展生存期 共有6项研究报道了无进展生存期,其中1篇尼妥珠单抗治疗,1篇西妥昔单抗治疗,4篇厄洛替尼治疗,异质性检验提示异质性显著(P=0.003,I2=72%),采用随机效应模型,结果显示EGFR靶向药物能延长进展期胰腺癌患者的无进展生存期(HR=0.78,95%CI:0.62~0.98,P<0.05)(图8)。

图8 试验组和对照组无进展生存期的Meta分析
2.4.2.2 按药物分类亚组分析 按药物分类做亚组分析,单克隆抗体类纳入2项研究,异质性检验提示异质性不显著(P=0.29,I2=9%),采用固定效应模型,结果显示单克隆抗体类EGFR靶向药物对进展期胰腺癌患者无进展生存期无明显益处(HR=0.78,95%CI:0.60~1.01,P>0.05);酪氨酸激酶抑制剂类纳入4项研究,异质性检验提示异质性显著(P=0.000 9,I2=82%),采用随机效应模型,结果显示酪氨酸激酶抑制剂类EGFR靶向药物不能延长进展期胰腺癌患者无进展生存期(HR=0.76,95%CI:0.56~1.03,P>0.05)(图9)。
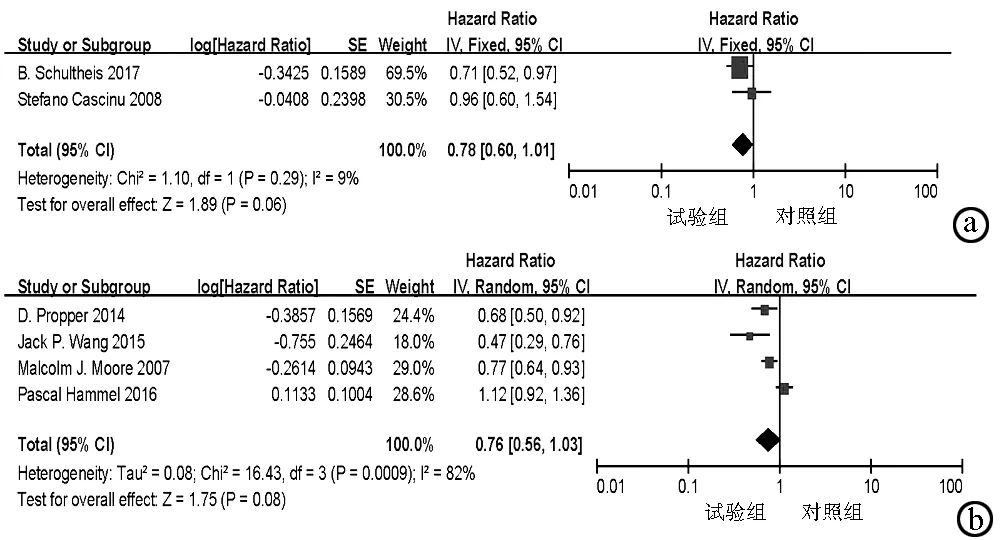
注:a,单克隆抗体组无进展生存期的Meta分析;b,酪氨酸激酶抑制剂组无进展生存期的Meta分析。
2.4.2.3 发生皮疹患者亚组分析 2项研究报道了试验组患者发生皮疹,异质性检验提示异质性显著(P=0.06,I2=72%),采用随机效应模型,结果显示EGFR靶向药物治疗后皮疹的发生与无进展生存期无明显关联(HR=0.51,95%CI:0.22~1.17,P>0.05)(图10)。

图10 发生皮疹患者亚组无进展生存期的Meta分析
2.4.3 疾病控制率 共有6项研究报道了疾病控制率,异质性检验提示异质性显著(P=0.07,I2=51%),采用随机效应模型,结果显示EGFR靶向药物能提高进展期胰腺癌患者的疾病控制率(RR=1.22,95%CI:1.04~1.43,P<0.05)(图11)。

图11 试验组和对照组疾病控制率的Meta分析
2.4.4 客观缓解率 共有6项研究报道了客观缓解率,异质性检验提示无异质性(P=0.57,I2=0%),采用固定效应模型,结果显示EGFR靶向药物对进展期胰腺癌患者客观缓解率无明显益处(RR=1.00,95%CI:0.76~1.32,P>0.05)(图12)。
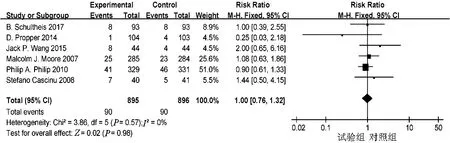
图12 试验组和对照组客观缓解率的Meta分析
2.5 敏感性分析 敏感性分析发现1项研究为异质性主要来源,进行异质性分析发现该研究仅纳入局部进展期患者为研究对象(图13)。

图13 敏感性分析
3 讨论
目前手术切除结合全身化疗是胰腺癌患者治愈或长期生存的唯一希望[23-24],然而只有10%的确诊患者可以接受标准的手术治疗,约60%的患者都因为远处转移或身体状况不佳而无法手术[25]。胰腺癌的肿瘤生物学特性决定了胰腺癌的早期复发和转移,以及对化疗和放疗的耐药性。尸检结果显示,约90%的胰腺癌合并远处转移[26]。胰腺导管腺癌有4个主要的驱动基因(1个癌基因和3个抑癌基因)[27],KRAS是胰腺癌的主要驱动基因之一[28],它编码一个小的GTPase,介导生长因子受体的下游信号,是最常见的突变致癌基因。大多数低级别胰腺上皮内肿瘤存在体细胞KRAS突变,提示KRAS突变是胰腺肿瘤发生的最早的改变之一[29]。而Ardito等[30]进一步研究发现EGFR通路上调也是胰腺肿瘤发生的一个非常早期的事件,且EGFR的上调和激活是由KRAS启动的,因此以EGFR为靶点,找到更有效的辅助化疗方案对于治疗进展期胰腺癌具有临床意义。
EGFR靶向药物自面世以来,已有大量胰腺癌治疗方面的研究,然而部分研究的结果却相互矛盾。就本研究结果来看,与对照组相比,EGFR靶向药物能提高进展期胰腺癌患者的总生存期(P<0.05),但临床效果还不够理想。具体来看,厄洛替尼治疗组使患者中位总生存期延长0.33~2.8个月[15,19];尼妥珠单抗治疗组为2.6个月[22];西妥昔单抗治疗组为0.4~1.2个月[17,20]。有趣的是,亚组分析结果显示治疗中发生皮疹的患者获益更明显(P值均<0.05)。总体上看EGFR靶向药物能延长进展期胰腺癌患者的无进展生存期(P<0.05)。此外,EGFR靶向药物能提高患者的疾病控制率(P<0.05),但对客观缓解率的改善效果不明显(P>0.05)。根据以上结果来看,EGFR靶向药物治疗带来的总生存期和无进展生存期以及疾病控制率的提高或许能一定程度上改善患者的生存质量。最新研究[31]证实,接受厄洛替尼和帕尼单抗2种EGFR靶向药物联合治疗的胰腺癌患者总生存期明显延长,但不良反应也相应增多;Maron等[32]对几种单抗的组合进行比较,发现西妥昔单抗联合曲妥珠单抗具有较好的抑癌效果;而Blasco等[33]则利用基因修饰鼠建立人源肿瘤异种移植模型并证实联合抑制EGFR和c-raf可以使胰腺导管腺癌完全消退。由此可见,多种EGFR靶向药物联合使用,或是针对EGFR相关通路的多个靶点进行联合抑制或将是提高辅助化疗效果的新途径,值得进一步探索。而关于EGFR靶向药物带来的主要不良反应——皮疹,有研究[34]认为这是由于EGFR在皮肤和其他组织中内源性表达所致,其机制亦有待进一步探究。
本文纳入的文献均为高质量临床随机对照试验,具有一定的论证强度,但也有不足:(1)纳入研究仅限于使用一种EGFR靶向药物,没有考虑两种或多种靶向药物联合使用的情况;(2)纳入研究对象以欧美人种为主,缺少亚洲人种的数据;(3)部分指标,如皮疹的发生与总生存期的关系相关文献较少,其临床意义有待进一步研究。
