1-脱氧野尻霉素控释微丸的制备工艺优化及其药动学研究
2020-06-15孙照英赵华南刘志明
孙照英, 赵华南, 刘志明*
(1.东北林业大学 材料科学与工程学院, 黑龙江 哈尔滨 150040; 2.哈药集团技术中心, 黑龙江 哈尔滨 150020)
1-脱氧野尻霉素是一种从桑叶中提取的哌啶生物碱,属于糖的类似物。1-脱氧野尻霉素作为细胞色素P450单加氧酶同种型3A和P-蛋白的抑制剂,具有抗癌、抗炎和抗氧化等多种药理活性,此外,其作为抑制α-葡萄糖苷酶活性的竞争性抑制剂已广泛应用于临床中,用于治疗各种疾病,尤其是治疗非胰岛素依赖型(II型)糖尿病[1-2]。由于1-脱氧野尻霉素还具有半衰期短、首过效应明显、水溶性差、对胃肠道有刺激作用和生物利用度较低等特点[3],实际使用中一般通过增加剂量和使用频次来提高其生物利用度,会导致患者依从性差。目前脂质体和纳米乳剂已被用于溶解1-脱氧野尻霉素以增强口服生物利用度[4-6],但未发现控制微丸剂型的相关报道。由于传统制剂很容易达到过高的血药浓度使血糖下降过快,引起低血糖导致头晕和昏迷,并影响药物的吸收导致低生物利用度。而口服控释制剂通过缓慢释放药物,能够控制稳定的血药浓度并延长作用时间,从而改善口服生物利用度,并减少对胃肠道的刺激[7-8]。因此,口服控释制剂的研究已成为治疗糖尿病新药领域的热点。作为载药系统,微丸具有独特的临床优势,如微丸在胃肠道中自由分散、最大限度地增加药物吸收、减少血药波动和减少潜在的副作用,从而提高药物的生物利用度[9-11]。本研究将1-脱氧野尻霉素与辅料羟丙基甲基纤维素E50、微晶纤维素、异丙醇进行混合,通过挤出滚圆法制备1-脱氧野尻霉素丸芯,再采用羟丙基甲基纳米纤维素邻苯二甲酸酯作为主要控释包衣材料进行包衣,将该微丸装入胶囊后,进行了药物体外溶出和体内控释及相关性的研究,以期为1-脱氧野尻霉素在糖尿病中的临床用药提供基础数据。
1 实 验
1.1 材料与试剂
1-脱氧野尻霉素原料药,哈药集团制药六厂;1-脱氧野尻霉素对照品(纯度99.4%),中检院;羟丙基甲基纳米纤维素邻苯二甲酸酯、羟丙基甲基纤维素E50和聚乙烯吡咯烷酮K30,德国BASF公司;聚乙二醇6000、微晶纤维素和滑石粉,安徽山河制药有限公司;2号羟丙甲纤维素胶囊,苏州胶囊有限公司;乙腈和甲醇,均为色谱级;肝素钠、异丙醇、α-萘酚、磷酸二氢钾、磷酸、乙酸、盐酸,均为分析级。
健康比格犬18只,由黑龙江中医药大学实验动物中心提供,体质量(13±2) kg。
1.2 1-脱氧野尻霉素与辅料相容性分析
将1-脱氧野尻霉素、羟丙基甲基纳米纤维素邻苯二甲酸酯、微晶纤维素、羟丙基甲基纤维素E50、聚乙烯吡咯烷酮K30、聚乙二醇6000和滑石粉按质量比1 ∶1 ∶1 ∶1 ∶1 ∶1 ∶0.5进行混合,将样品放置于温度40 ℃、湿度75%的恒温恒湿箱中1个月。取含1-脱氧野尻霉素25 mg的放置后的样品置于100 mL棕色容量瓶中,加入100 mL纯水、乙醇和异丙醇体积比1 ∶1 ∶1的混合溶液将其溶解,超声波分散处理5 min。将混合液在离心机中以8 000 r/min转速离心10 min。取5 mL上清液用上述混合溶液稀释至50 mL并注入美国Agilent1260高效液相色谱(HPLC)仪中。色谱条件:流动相为甲醇、乙腈和水体积比450 ∶550 ∶2.5的混合液,色谱柱Phenomenex C18(150 mm×4.6 mm,5 μm),柱温为30 ℃,检测波长215 nm,进样量10 μL,流速为1.0 mL/min。以1-脱氧野尻霉素峰面积(A)对标准血药质量浓度(c,mg/L)进行线性回归分析,质量浓度在1~25 mg/L范围内,其方程为c=20.742A-2.437 32(R=0.999 7),检测限为25 μg/L,定量限为70 μg/L。
1.3 1-脱氧野尻霉素控释微丸的制备
1.3.1分散体的制备 将400 g聚乙烯吡咯烷酮K30和800 g 1-脱氧野尻霉素原料药放入2 L乙醇中,使用旋转蒸发仪在65 ℃蒸发混合物直至处于黏性状态。随后,残留的乙醇溶剂在80 ℃下完全挥发,将混合物置于-30 ℃的冰箱中冷冻6 h得到固化物。将固化物在真空干燥箱中干燥12 h,通过小型粉碎机粉碎成粉末,过200 μm筛网,并储存在干燥器中。
1.3.2丸芯的制备 称量分散体粉末1 500 g、微晶纤维素400 g和羟丙基甲基纤维素 E50 200 g,置于Y150挤出滚圆机中,并使用0.8 L异丙醇作为润湿剂均匀混合,搅拌桨转速为75 r/min,剪切刀转速为850 r/min。将湿物料加入挤压滚筒中,通过螺旋钻的旋转将物料转移到网板上,通过挤压装置挤出,材料通过孔径为400 μm的网孔板挤出成条状,挤出速度为50 r/min。将条状物置于圆形转盘中,转盘速度为900 r/min,物料温度为55 ℃,制成丸芯,然后将丸芯通过600 μm筛网。为了研究羟丙基甲基纤维素E50对药物溶出的影响,将2%、 4%和6%的羟丙基甲基纤维素E50(以丸芯质量计)用于制备微丸。
1.3.3隔离层的制备 取200 g聚乙二醇6000和4 g滑石粉加入2 L水中,不断搅拌直至其溶解,使用WBF-2G底喷雾流化床将溶液喷雾到丸芯上,工艺参数为喷雾速率8~9 mL/min,雾化压力100~120 kPa,空气流量60~70 m3/h,蠕动泵转速35~40 mL/min,入口温度50~60 ℃,出口温度50~55 ℃,空气源压力450~500 kPa,隔离层厚度约为80 μm。通过700 μm筛网来筛分颗粒,除去大颗粒。
1.3.4控释微丸的制备 取600 g羟丙基甲基纳米纤维素邻苯二甲酸酯和200 g聚乙二醇6000溶解在2 L纯净水中,使用流化床侧喷1.3.3节中制备的含隔离层丸芯制备控释微丸。工艺参数:喷雾速率7~8 mL/min,雾化压力120~150 kPa,空气流量70~80 m3/h,蠕动泵转速40~45 mL/min,入口温度50~55 ℃,出口温度45~55 ℃,空气源压力500~600 kPa。控释微丸过850 μm筛网来筛分颗粒,除去大颗粒。
1.3.5装胶囊 将制备的控释微丸装入2号羟丙甲纤维素胶囊壳中。装量约为240 mg(含40 mg 1-脱氧野尻霉素),装量差异为3%。
1.4 控释微丸的结构表征与性能测试
1.4.1性质测定 通过HPLC法测定微丸中1-脱氧野尻霉素的量,检测方法同1.2节;使用沉降漏斗法[12]来检测休止角;将20 g 微丸加入脆碎度仪中,以100 r/min的转速旋转4 min,测量质量损失的百分比;采用振实法检测振实密度和松密度[13];采用卡尔费休法检测水含量[14];采用筛分法检测粒度分布[15];通过气相色谱检测残留溶剂,并通过外标法计算异丙醇含量(根据中国药典,微丸的残留溶剂不得超过0.5%)。具体方法为使用5890型气相色谱仪,配有熔融石英毛细管柱(25 m×0.2 mm,0.25 μm),氦气作为载气,流速0.55 mL/min,进样体积3 μL,喷射器温度程序从65 ℃开始(保持2 min),然后以80 ℃/min 的升温速率增加至360 ℃,并在此温度保持10 min。
控释微丸的产率见式(1):
微丸的产率=微丸的实际产率/微丸的理论产率×100%
(1)
1.4.2SEM分析 采用美国485VP型扫描电子显微镜(SEM)观察微丸的表面和横截面。
1.5 控释微丸体外释药试验
1.5.1溶出介质的影响 根据中国药典[16]采用上海天士利仪器有限公司生产的ZRS-8G溶出仪研究释放曲线。选择4种不同pH值的溶液作为溶出介质:pH值1.2盐酸溶液、 pH值4.0醋酸盐溶液、pH值5.5醋酸盐溶液和pH值6.8磷酸盐溶液。将胶囊分别放入以上溶出介质中,桨叶旋转速度为50 r/min,介质体积900 mL,温度为(37±0.5) ℃。以适当的时间间隔(0.5、 1、 2、 4、 6、 8、 12、 18和24 h),分别取出10 mL溶出介质,过0.22 μm的滤膜,每次取出后在相同温度下补充相同体积的溶出介质,采用美国Cary 50 Conc紫外分光光度计检测取出的溶出介质中1-脱氧野尻霉素含量,波长设定为215 nm。对6粒胶囊进行平行溶解实验,并计算每个时间点溶出介质的平均累积溶出度和标准偏差。
1.5.2溶出稳定性研究 取连续3批微丸胶囊样品进行溶出稳定性试验,分别为未放置、长期放置12个月(温度25 ℃和湿度50%)和加速放置6个月(温度40 ℃和湿度75%),检测体外溶出曲线,观察有无变化。
1.5.3释药模型拟合 对1-脱氧野尻霉素控释微丸溶出度进行不同的释放模型的数据拟合,通过WINNNONLIN 5.2版计算机软件计算和确认1-脱氧野尻霉素释放机制。采用零级模型(式(2))、一级模型(式(3))、Ritger-Peppas(式(4))、Higuchi(式(5))、Weibull(式(6))和Baker-Lonsdale模型(式(7))进行回归分析,并且计算相关系数(R),用于评价1-脱氧野尻霉素释放曲线的拟合度的R值应在1~0.99的范围内[17]。
Qt=k0t
(2)
ln(Q0-Qt)=k1t+lnQ0
(3)
(4)
lnQt=nlnt+kH
(5)
(6)
(7)
式中:Qt—释放速率,mg/h;Q0—零级释放速率,mg/h;k0—零级释放参数;k1—一级释放参数;kR—Ritger-Peppas释放参数;kH—Higuchi释放参数;kHC—Weibull释放参数;kBL—Baker-Lonsdale释放参数;n—释放参数;t—释放时间,h。
1.6 比格犬体内药代动力学试验
1.6.1血样的采集 将比格犬随机分成3组(每组6只),比格犬在给药前禁食12 h,但可自由饮水。将1-脱氧野尻霉素原料药、1-脱氧野尻霉素分散体微丸和1-脱氧野尻霉素控释微丸分别口服给药3组比格犬。给药后,在0.5、 1、 2、 3、 4、 6、 8、 10、 12、 18、 24和36 h分别取血5 mL。
1.6.2血浆样品的处理 将全血样品立即转移到涂有抗凝血剂肝素钠的试管中,将样品以5 000 r/min转速离心15 min以分离血浆,加入10 mg/Lα-萘酚异丙醇溶液200 μL混合5 min。将上层有机层转移到试管中,并在氮气流下在40 ℃水浴蒸发溶剂,将残余物溶于100 μL甲醇中,取20 μL溶液注入HPLC中。
1.6.3HPLC分析 经验证的HPLC系统用于检测血浆中1-脱氧野尻霉素浓度[18]。使用色谱柱Sunfire C18柱(250 mm×3.5 mm,5 μm)流动相为甲醇、乙腈和水(体积比450 ∶550 ∶2.5)的混合液,柱温35 ℃,检测波长为215 nm,注射体积为20 μL,流速为1.0 mL/min,定量下限为28 μg/L。方法验证结果显示线性相关质量浓度范围为30~850 μg/L,y=0.037 4x+0.074 3,R=0.998 7(其中,x为质量浓度,y为峰面积)。200、 400和600 μg/L的提取回收率分别为96.43%、 98.38%和97.52%。日内精密度(同一天检测)和日间精密度(不同天检测)的相对标准偏差均小于3.14%。
1.6.4生物利用度分析 通过WINNNONLIN 5.2版计算机软件计算药代动力学参数。将血浆中的1-脱氧野尻霉素质量浓度对时间作图,得到血浆中最大质量浓度(Cmax)和最大质量浓度时间(Tmax),计算0~36 h质量浓度-时间曲线的曲线下面积(AUC),1-脱氧野尻霉素质量浓度下降到一半的时间(t1/2)。通过测定Cmax和Tmax值,进行α=0.05的t检验以确定差异的显著性。相对生物利用度的计算公式见式(8)。相对生物利用度在80%和120%之间认为生物利用度相同,超过120%说明提高了生物利用度[19]。
Fr=AUCT×DR/AUCR×DT×100%
(8)
式中:Fr—相对生物利用度,%; AUCT—测试制剂血药浓度-时间曲线下面积,μg·h/L;DR—参比制剂给药剂量,mg; AUCR—参比制剂血药浓度-时间曲线下面积,μg·h/L;DT—测试制剂给药剂量,mg。
1.6.5体外-体内释药相关性 体外-体内相关性由美国食品药物品管理局定义,是一种预测数学模型,可用于说明体内释放和体外吸收之间的关系[20]。在该研究中,使用WINNNONLIN 5.2版计算机软件进行体外溶出量和体内吸收量之间的线性回归拟合,并计算R2以评估体外-体内相关性。
2 结果与分析
2.1 1-脱氧野尻霉素控释微丸基本结构性质分析
2.1.1与辅料的相容性 根据图1中HPLC结果分析可知,1-脱氧野尻霉素与辅料混合1个月前后其质量分数没有变化,也无其他杂质产生, 说明1-脱氧野尻霉素与所有辅料之间没有发生化学反应,具有良好的相容性。
2.1.2结构特征 图2显示了1-脱氧野尻霉素控释微丸的扫描电子显微镜照片。图2(a)和(b)展现微丸呈球形并具有连续、光滑且均匀的表面。 图2(c)和(d)显示微丸横截面结构包括3层,即从内到外为1-脱氧野尻霉素层丸芯、隔离层和控释层,每层厚度均匀,说明了制备微丸的包衣工艺稳定。
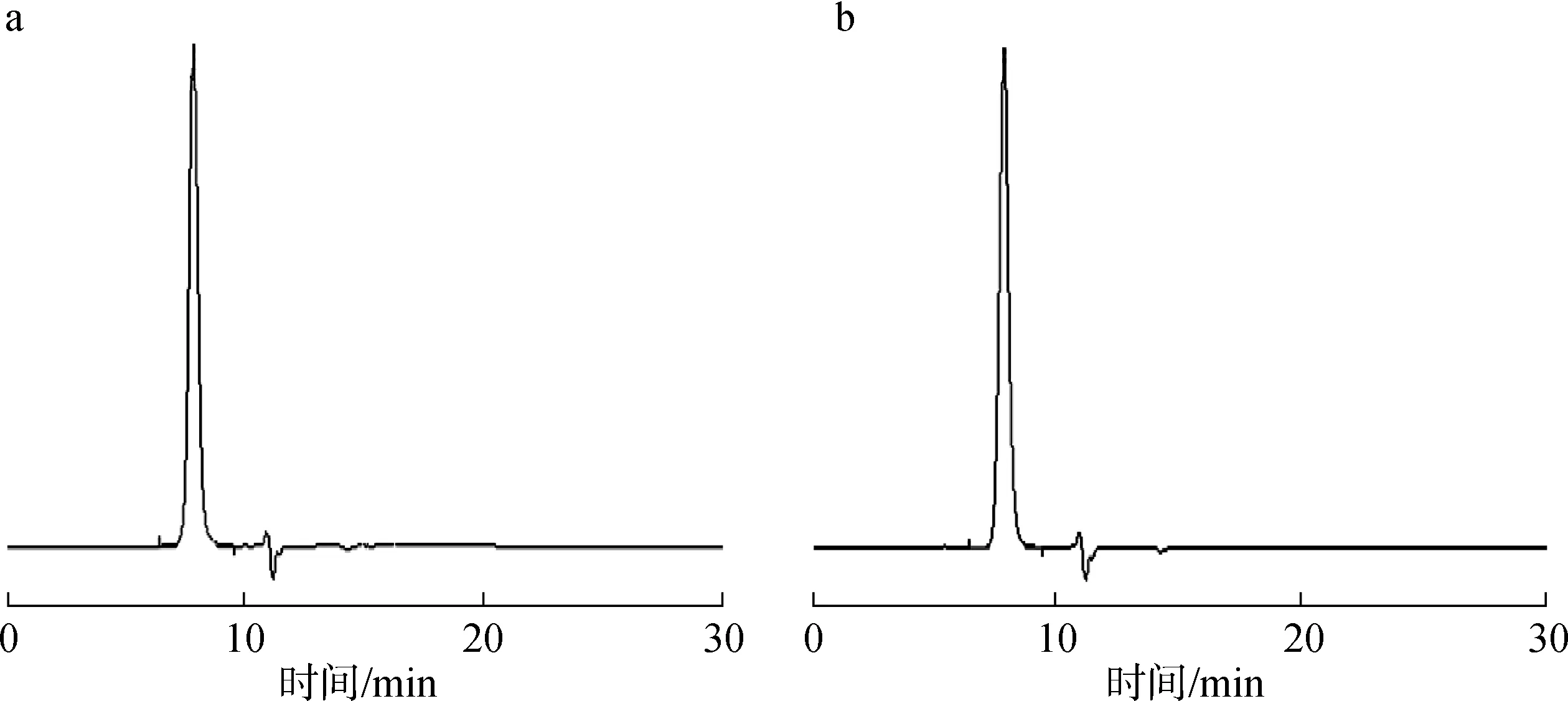
图1 1-脱氧野尻霉素与辅料混合前(a)、后(b)的HPLC色谱图
2.1.3物理性质 经检测,微丸中1-脱氧野尻霉素质量占1-脱氧野尻霉素投料质量的96.7%~98.9%和异丙醇质量分数0.12%;休止角37~42°; 产率89%~94%;脆碎度(0.21±0.05)%;振实密度为(0.83±0.04) g/mL;松密度为(0.91±0.06) g/mL;水质量分数为(2.8±0.4)%;粒径分布为600~850 μm,以上均符合中国药典标准规定。
2.2 控释微丸体外释药分析
2.2.1不同条件对体外释药的影响 图3为不同处理的1-脱氧野尻霉素在不同溶出介质中的溶出曲线。由图3可知,1-脱氧野尻霉素在4种不同的溶出介质中均呈现缓慢接近匀速地释放,释放过程没有显著差异,说明释药过程不受pH值影响。未放置、加速放置6个月和长期放置12个月释放1-脱氧野尻霉素没有显著差异,说明控释微丸溶出稳定性良好,适合长期存放。
质量分数2%、 4%和6%的羟丙基甲基纤维素 E50对药物溶出的影响见图4。由图可知,药物溶出不受溶出介质影响,当羟丙基甲基纤维素 E50质量分数为2%时,1-脱氧野尻霉素的溶出最快,当质量分数为6%时的溶出最慢,当其为4%时溶出速率较为理想,因为羟丙基甲基纤维素 E50为黏合剂,用量少时微丸较松散,药物溶出较快;用量多时微丸较坚硬,药物溶出较慢。
2.2.2体外释药机理探究 将药物释放数据应用于不同模型以阐明释放机理,选取零级模型、一级模型、Ritger-Peppas、Higuchi、Weibull和Baker-Lonsdale释放模型,以确定回归方程中参数的最佳值。与各种模型参数相比,Baker-Lonsdale模型具有最佳拟合方程。如表1所示,在不同溶出介质pH 值1.2、4.0、 5.5和6.8中R值分别为0.997 7、 0.992 2、 0.990 1和0.997 3,均符合Baker-Lonsdale模型(1>R>0.99)。
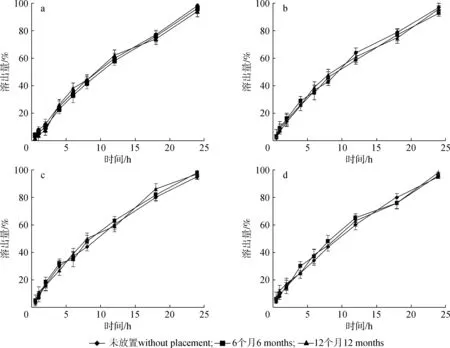
pH值pH value: a.1.2; b.4.0; c.5.5; d.6.8
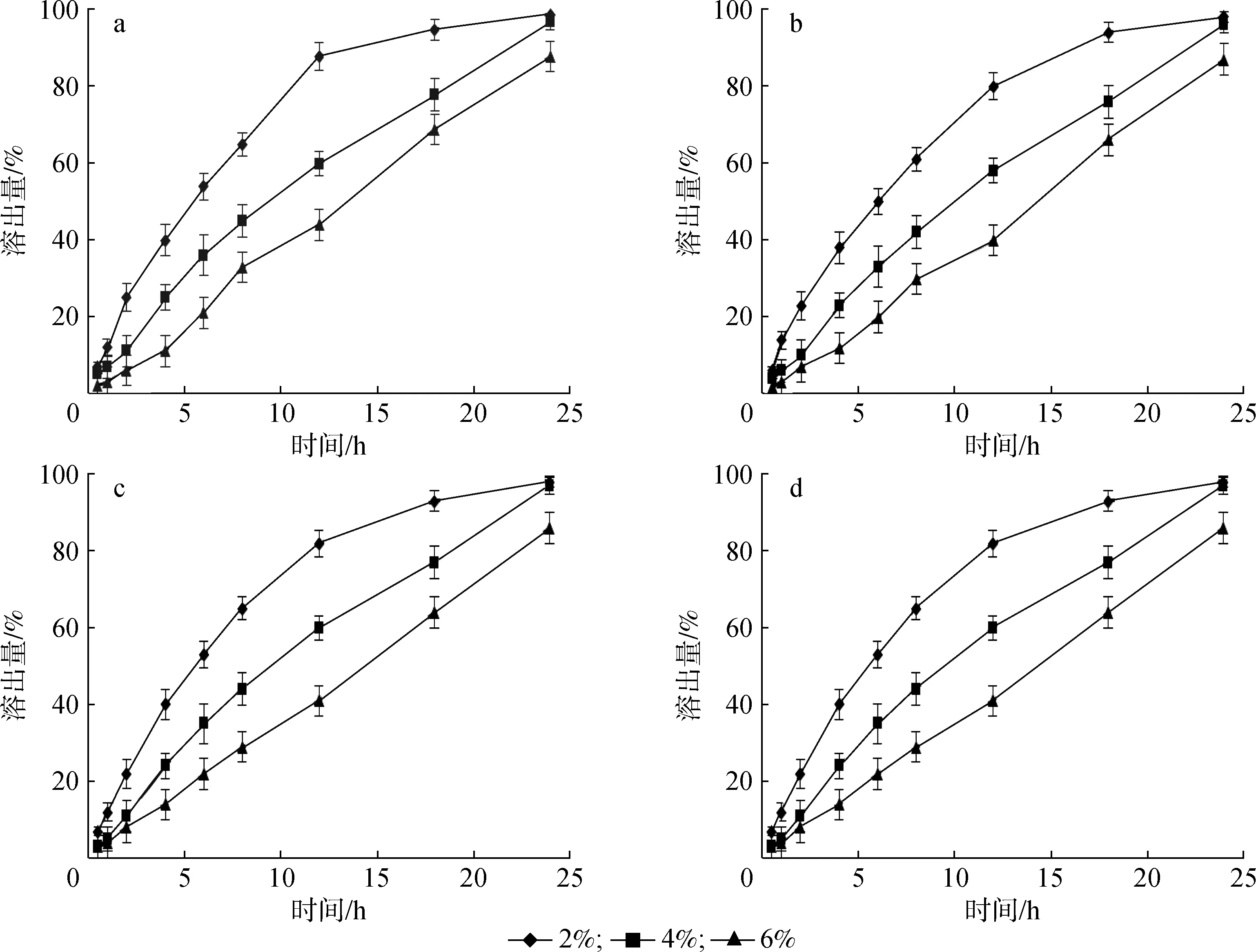
pH值pH value: a.1.2; b.4.0; c.5.5; d.6.8

表1 1-脱氧野尻霉素控释微丸释放模型以及相关系数
2.3 控释微丸在比格犬体内药代动力学分析
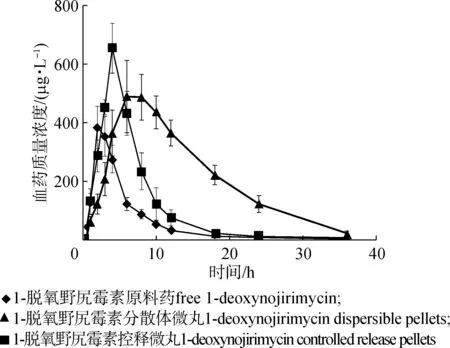
图5 1-脱氧野尻霉素的血药浓度-时间曲线Fig.5 Plasma concentration-time profile of 1-deoxynojirimycin matrix pellet
2.3.1药动学数据分析 目前,尚未报道使用比格犬作为1-脱氧野尻霉素研究的动物模型,但有研究报道了使用比格犬来研究微丸在体内的药代动力学[21]。因此,选择比格犬进行口服给药。在给18只健康比格犬口服40 mg 1-脱氧野尻霉素后,研究了1-脱氧野尻霉素原料药、1-脱氧野尻霉素分散体微丸和1-脱氧野尻霉素控释微丸的药代动力学,结果见图5,参数见表2。给药1-脱氧野尻霉素原料药后,1-脱氧野尻霉素的血浆水平非常低:Cmax为(384.79±33.64) μg/L,AUC0-t为(964.82±79.36) μg·h/L。与1-脱氧野尻霉素原料药相比,分散体微丸显示较高的1-脱氧野尻霉素血药浓度水平(Cmax为(677.63±76.98) μg/L,AUC0-t为(1 797.49±126.79) μg·h/L),分别为1-脱氧野尻霉素原料的1.76倍和183.37%。 而给药1-脱氧野尻霉素控释微丸后Cmax在6.65 h内缓慢增加至(487.94±36.83) μg/L,之后缓慢稳定下降,AUC0-t为(2 254.83±253.54) μg·h/L。与1-脱氧野尻霉素原料药相比,峰质量浓度和相对生物利用度分别为1.56倍和243.87%,Tmax2.34 h延长至6.65 h,t1/2为(7.82±0.74) h。1-脱氧野尻霉素原料药和1-脱氧野尻霉素分散体微丸的t1/2分别为(3.75±0.31)和(4.43±0.62) h。延长的Tmax和t1/2表明1-脱氧野尻霉素控释微丸中的1-脱氧野尻霉素缓慢释放。结果表明,1-脱氧野尻霉素控释微丸具有比1-脱氧野尻霉素分散体微丸更好的缓释特性。延迟的Tmax有助于维持血药浓度,从而增加了1-脱氧野尻霉素的相对生物利用度,有利于药物的临床应用。

表2 比格犬口服不同药物后药动学参数
2.3.2体外-体内相关性分析 体外-体内相关性分析是基于体外数据来预测体内的结果。对于相关性分析是将体内吸收的1-脱氧野尻霉素相对于在相同时间点体外释放1-脱氧野尻霉素进行线性回归分析,1-脱氧野尻霉素控释微丸在4种pH值1.2、 4.0、 5.5和6.8溶出介质中体外溶出量与在比格犬的体内吸收量之间的线性回归方程分别为:y=0.991 1x+0.018 9,y=0.964 7x+0.020 1,y=0.977 5x+0.010 9,y=1.001 9x-0.012 4(其中,y表示体外累积释放速率,μg/L;x表示体内吸收,μg/L)。相关系数R2分别为0.998 2, 0.998 8, 0.994 1和0.997 6。数据表明1-脱氧野尻霉素微丸体内吸收和体外释放在4种不同pH值溶出介质中均呈现良好的相关性。
3 结 论
3.11-脱氧野尻霉素与所有辅料之间具有良好的相容性。控释微丸呈球形并具有连续、光滑且均匀的表面。从内到外为1-脱氧野尻霉素层丸芯、隔离层和控释层,每层厚度均匀,说明了制备微丸的包衣工艺稳定。微丸的物理性质符合中国药典标准规定。
3.2在4种不同的溶出介质中1-脱氧野尻霉素均呈现缓慢接近匀速地释放,在4种介质(pH值1.2、4.0、 5.5和6.8)中释放1-脱氧野尻霉素没有显著差异,说明释药不受pH值影响。未放置、加速放置6个月和长期放置12个月释放1-脱氧野尻霉素没有显著差异,说明控释微丸溶出稳定性良好,适合长期存放。将药物释放数据应用于不同模型以阐明释放机理,结果表明,药物释放符合Baker-Lonsdale模型。
3.31-脱氧野尻霉素控释微丸具有控释特性。延迟的Tmax有助于维持血药浓度,从而增加了1-脱氧野尻霉素的相对生物利用度,提高药物临床应用的适用性。
3.4体外-体内相关性分析是基于体外数据来预测体内的结果。1-脱氧野尻霉素控释微丸在4种pH值(1.2、 4.0、 5.5和6.8)溶出介质中与在比格犬的体内吸收之间的线性回归方程的相关系数(R2)分别为0.998 2、 0.998 8、 0.994 1和0.997 6。表明1-脱氧野尻霉素微丸体内吸收和体外释放在4种不同pH值溶出介质中均呈现良好的相关性。
