贵州省新型冠状病毒核酸检测质量现场考核结果分析
2020-06-15冯勤颖王济林孙建超陶永德
吴 娴,冯勤颖,向 丽,黄 山,王济林,孙建超,陶永德
贵州省临床检验中心,贵州贵阳 550002
新型冠状病毒肺炎(COVID-19)是由新型冠状病毒(SARS-CoV-2)感染引起的,确诊的金标准是可在患者体内检测到SARS-CoV-2,而核酸检测是检测病毒基因中的某些特定核酸序列,因此从方法学层面考虑可将其作为实验室诊断金标准[1]。ZHU等[2]在2020年1月通过高通量测序已证实SARS-CoV-2为一种β属冠状病毒,其基因组约含29 000个碱基,有12个蛋白编码区/开放读码框(ORF),包括1ab、S、3、E、M、7、8、9、10b、N、13、14;其中ORF 1ab编码RNA聚合酶,可参与病毒核酸复制;N区编码核壳蛋白,其与病毒基因组宿主RNA互相识别;E区编码囊膜蛋白,与病毒包膜及病毒颗粒的形成相关[3-4]。
近期,SARS-CoV-2核酸检测阳性率问题备受社会关注。贵州省为了切实做好“外防输入、内防扩散”工作,及时有效发现和控制传染源,规定了对五类人员(疑似病例、确诊病例的密切接触者、每天发热门诊就诊的发热患者、湖北省武汉市等地返黔的居家隔离和集中隔离人员、每天由湖北省武汉市等地新来黔或返黔人员)开展全面核酸检测。贵州省卫生健康委员会在原来的10家疾控中心检测实验室的基础上,新增21家医疗机构和3家第三方检验机构实验室,作为全省SARS-CoV-2核酸检测指定实验室,共计34家。为保证检测结果,了解各实验室检测能力以及检测试剂的质量状况,贵州省临床检验中心针对省内34家SARS-CoV-2核酸检测实验室进行了技术考核,现将相关结果汇报如下。
1 材料和方法
1.1材料 本次考核品定制于相关生物制品公司,共有10批考核品,包括阴性、弱阳性和阳性样品。阴性样品为稀释液;阳性样品采用装甲RNA技术,将3个目标RNA序列(含ORF 1ab、N和E基因)用噬菌体蛋白外壳加以包裹形成,其结构类似于天然病毒,以还原真实的样品,然后进行培养,获得培养液,对收获的假病毒培养液进行初步定值,然后用阴性稀释液稀释至所需水平;弱阳性样品病毒拷贝数为所用6种试剂盒检测限均值的3~5倍。阳性样品大约为105拷贝/毫升,规格:1.0 毫升/管。所用考核样品由专人按照冷藏条件送到各检测实验室,在事先不通知的情况下,在规定时间进行检测和回报。
1.2方法
1.2.1试剂盒 本次考核一共涉及6个不同厂家生产的国产试剂盒,分为A~F 6组,其中A~E组检测位点为ORF 1ab和N基因,F组除这2个基因外,还检测E基因,6种试剂中,除一种使用一步法外,其余均用磁珠法进行病毒核酸提取,且6种试剂均采用荧光定量PCR法对靶基因进行检测。
1.2.2检测方法 各实验室严格按照《新型冠状病毒感染的肺炎实验室检测技术指南(第二版)》[5]和《国家卫生健康委办公厅关于印发新型冠状病毒实验室生物安全指南(第二版)的通知》[6]相关文件进行生物安全防护和实验操作,并严格按照试剂说明书进行RNA的提取及扩增检测。
1.3统计学处理 采用SPSS23.0进行统计学分析。
2 结 果
2.1各检测机构考核品检测结果与预期结果的符合程度 本次考核发放考核样品34份,每份含10个样品(3个阴性样品,2个弱阳性样品,5个阳性样品),规定时间内回收结果30份。在完成考核的30家检测机构中,有22家使用试剂A,4家使用试剂B,试剂C、D、E和F各有1家实验室选用。结果共涉及6个厂家试剂,且使用各试剂厂家检测的结果均与预期结果100%相符。这30家检测机构的检测结果总符合率为100%,其中阳性样品符合率、阴性样品符合率、全省疾控机构总符合率、全省医疗机构总符合率、第三方机构总符合率均为100%。考核结果见表1。
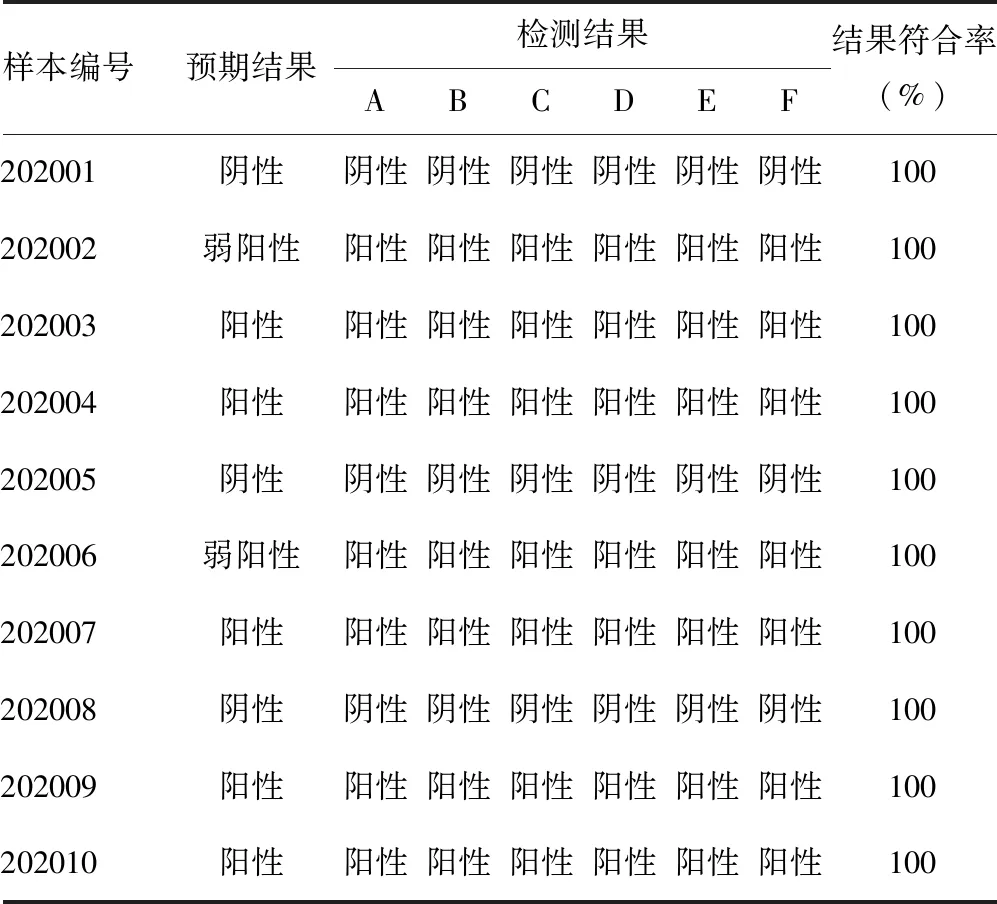
表1 各试剂检测结果
2.26组试剂检测结果 本次完成考核的实验室中,22家使用试剂A,4家使用试剂B,其余实验室均只涉及一个厂家试剂,所用考核品10批,且每家实验室均完成了这10批考核品的检测,其检出结果见表2。由表可知,除1组试剂检测ORF 1ab、N和E基因外,其余5组均检测ORF 1ab和N基因,且各组试剂对靶基因的检出率均为100%。
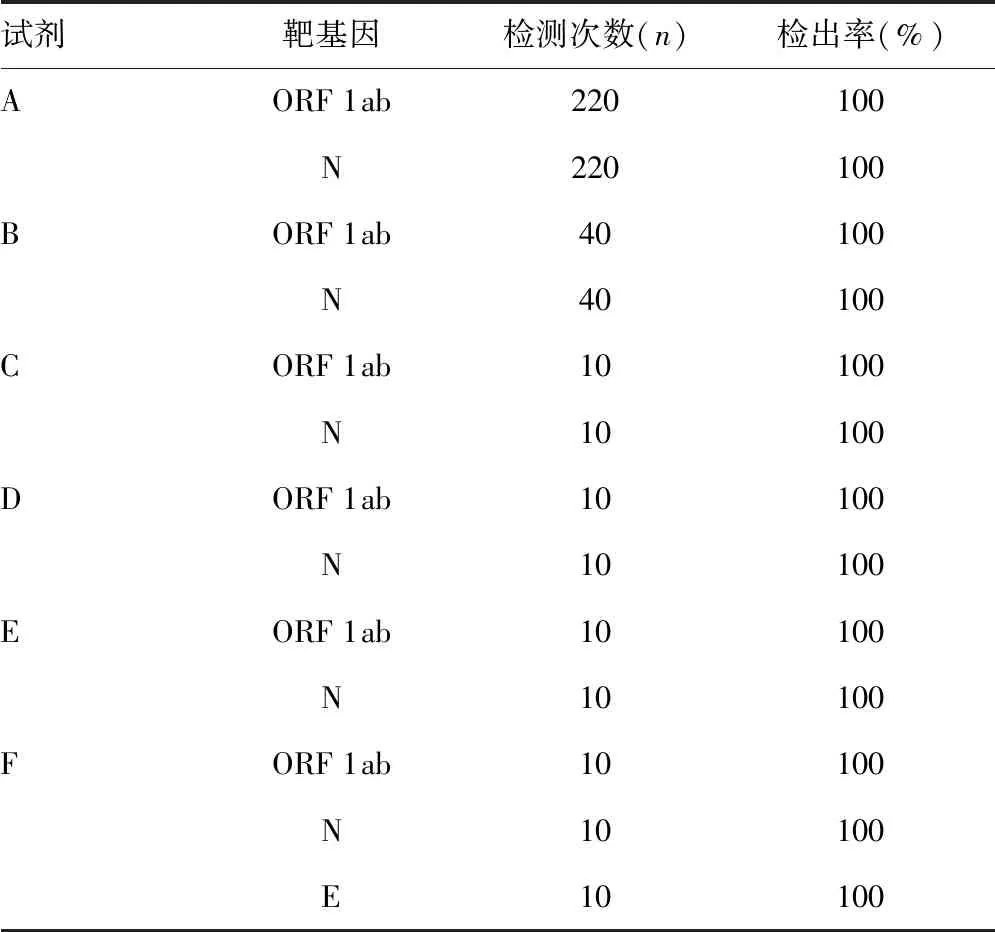
表2 6组试剂检测结果
注:检测次数为使用该试剂的实验室数与考核品批数(10)的乘积。
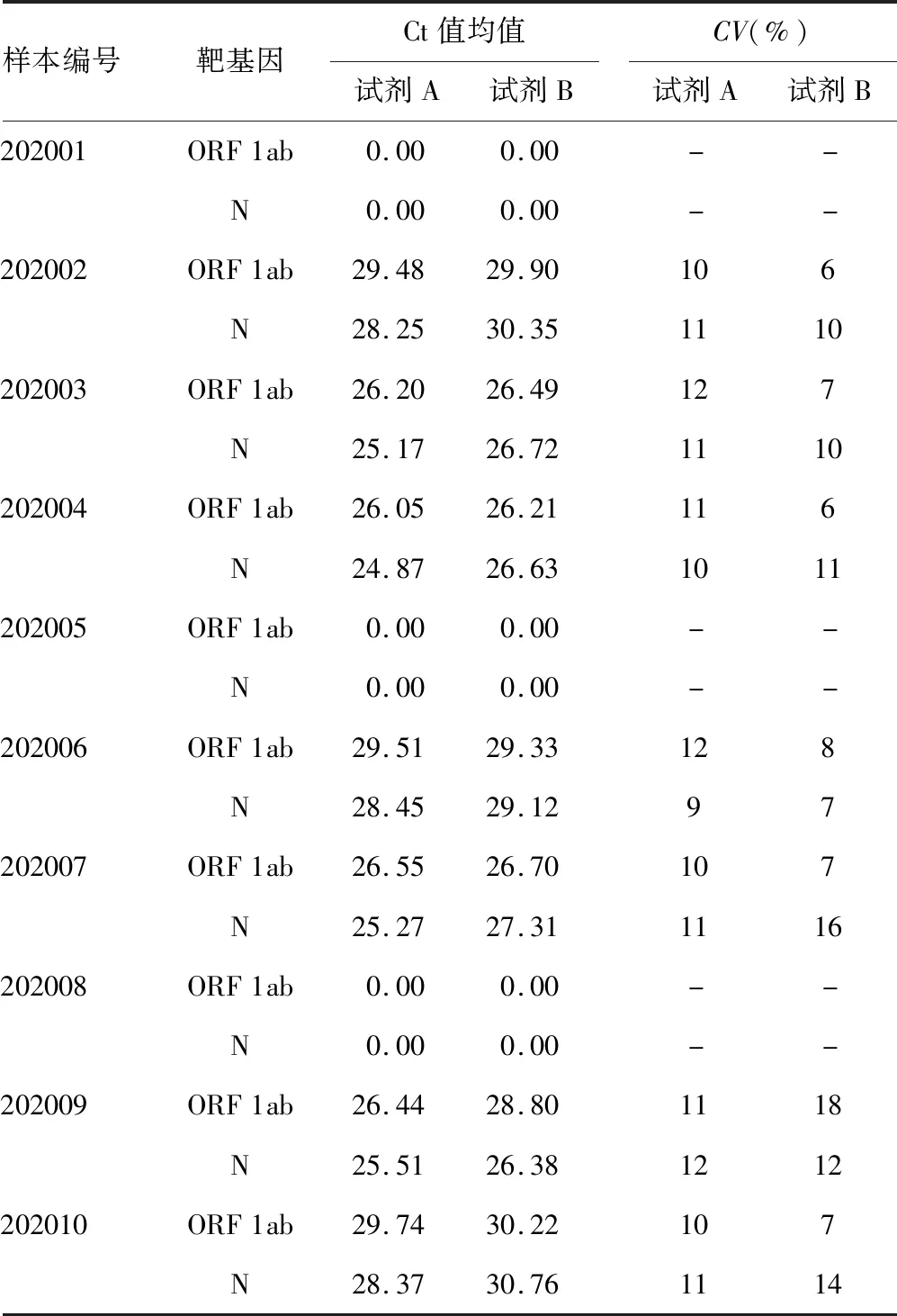
表3 试剂A、B检测结果平均Ct值均值及CV
注:-为无数据。
2.3不同试剂检测结果平均循环阈值(Ct)值及Ct值变异系数(CV) 本次完成考核的实验室中,22家使用试剂A,4家使用试剂B,其余实验室均只涉及一个厂家试剂,故本次考核只对试剂A和试剂B进行统计分析。试剂A和试剂B的检测结果Ct值均值及Ct值CV见表3。结果显示,试剂A、B检测结果的Ct值均值相差不大,但试剂A检测结果的CV值波动较小,在9%~12%之间,而试剂B检测结果的CV值波动较大,在6%~18%之间,由此可见,试剂A的批间重复性较试剂B要好。在弱阳性样品202002和202006的检测中,试剂B的重复性均较试剂A好。
3 讨 论
近期在湖北省武汉市出现的COVID-19,有极强的传染性,引起了全国乃至世界的广泛关注[7-8]。确诊COVID-19的金标准是SARS-CoV-2核酸检测。
核酸检测结果的准确性涉及患者疾病发展过程、标本采集、标本保存与运输、样品检测等多过程。本次考核,只针对样品检测,包括核酸提取、扩增体系、人员操作、室内质控等因素,即检验中的质量管理。本次考核所涉及的34家SARS-CoV-2核酸检测实验室,是由省级卫生健康委员会指定,有5家医疗机构实验室通过了ISO15189认可,1家疾控实验室通过了ISO17025认可。这些医疗机构实验室,包括第三方实验室,经过多年的实践,在质量管理方面均有丰富的经验,一些没有通过认可的实验室,基本也是参照相关质量管理体系进行质量管理。同时,对于国家或者省级临床检验中心开展了室间质评的项目,几乎所有的实验室都参加了相关项目的室间质评,保障了检验质量。
本次考核的考核品包括阴性、弱阳性和阳性样品。阴性样品为稀释液,阳性样品采用装甲RNA技术,将3个目标RNA序列(含ORF 1ab、N和E基因)用噬菌体蛋白外壳加以包裹,其结构类似于天然病毒,以还原真实的样品,本文所用的阳性或弱阳性考核品具有蛋白外壳,因此可作为抑制质控品,与临床标本相似,可直接作为待测样本进行检测,全程模拟病毒裂解、RNA提取、逆转录以及扩增的整个过程,这是采用裸露的质粒DNA或RNA片段作为质控品所无法比拟的。且采用装甲RNA技术制备的考核品具有稳定、不易被RNA酶降解、无生物安全问题、无传染危险性、可准确定量等优点。
21家医疗机构中,其中20家为三甲医院,1家为三级医院。参与的30家检测实验室,均建立了完整的质量管理体系,严格按照操作规程和室内质控规则进行实验室检测。所以在这次的SARS-CoV-2核酸检测中,才能够出现100%的符合率。
在回报的30家检测实验室中,用于考核样品检测的试剂一共来自6个厂家,并且主要集中在传统的2家基因试剂厂家上,占87%左右,说明我国传统试剂生产厂家的产品质量是过硬的。本次完成考核的实验室中,22家使用试剂A,4家使用试剂B,其余实验室均只涉及一个厂家试剂,每家实验室均完成了这10批考核品的检测,所使用的6个厂家试剂中,除1家试剂的检测位点为ORF 1ab、N和E基因外,其余5家检测位点均为ORF 1ab和N基因,且各组试剂对各基因的检出率均为100%。专家认为,理论上SARS-CoV-2的mRNA转录模式与SARS类似,细胞中SARS-CoV-2的mRNA是病毒基因组RNA的数倍,且在转录时会形成不同长度的mRNA片段,这些mRNA片段均含有N基因,而只有少数mRNA片段含有ORF 1ab基因,因此临床样本中N基因的拷贝数远远高于ORF 1ab,而目前的试剂盒主要检测细胞内的病毒mRNA,因此N基因的检测阳性率要高于ORF 1ab基因;再者,N基因保守程度不及ORF 1ab基因,故少数样本可能与其他类型冠状病毒的核酸序列存在交叉而导致N基因扩增阳性而ORF 1ab基因阴性[9]。本次考核中,各试剂对ORF 1ab基因和N基因的检出率均为100%,这可能与阳性样品中这2个基因的水平相当及其稳定性较临床标本高有关。
本次考核发现,与试剂B相比,试剂A具有较好的批间重复性。而6种试剂的检出率均为100%,说明目前临床关注的SARS-CoV-2核酸检出率低的问题,与试剂盒检出率大小关系不大,但部分试剂的稳定性较差,因而各厂家试剂盒检测性能有待进一步优化。临床检验全面质量管理,其中的分析前质量管理极其重要,患者疾病发展过程、标本采集、标本保存与运输等,对检测阳性率有着决定性作用。笔者认为,对于社会关注的SARS-CoV-2核酸检测阳性率低的问题,主要是由患者疾病发展过程、标本采集、标本保存与运输等问题引起。加强与临床和疾控采样人员的沟通和联系,共同对分析前进行质量管理,以保障检验质量,其意义非常重要。
对于贵州省临床检验中心组织的这次现场考核,由于时间紧,任务重,还存在许多不足之处,比如未对考核样品的一致性和稳定性进行验证,对于考核品的定值是采用本实验室仪器进行的,其准确性可能存在一定的误差。各检测实验室对这次考核非常重视,有的实验室进行了2次及以上的检测,未能体现其真实检测水平,也是造成全部符合的原因之一。尽管在研究中采取了装甲RNA技术制备考核样品,但是假病毒中只包含了ORF 1ab、N和E 3个目标RNA序列,与真实病毒有着很大的差别,相对于真实病毒的核酸提取要容易得多。由于考核样品是无感染性的,在检测过程中没有要求灭活,所以对于临床标本检测过程中的灭活过程,是否会对检测结果产生影响,还有待验证。
