曲美他嗪对急性脑梗死患者的临床疗效及相关机制探讨
2020-06-15刘宏坤郑芝欣顾亮亮
龚 瑜 刘宏坤 郑芝欣 顾亮亮
南阳市中心医院,河南 南阳 473000
急性脑梗死(acute cerebral infarction,ACI)多好发于中老年人群,属于神经系统常见的急危重症之一,致死率、致残率均较高,且部分患者常留有神经系统相关后遗症[1-4]。ACI病理生理过程较为复杂,既往研究显示[5-8],血管内皮功能损伤、大脑神经元及氧自由基损伤等多种因素均在ACI的发病机制中扮演了重要作用。但近年来研究认为,Th17、Treg及其相关细胞因子介导的免疫炎性反应在其发病机制中作用显著[9-11]。国外大量研究显示,[12-14],ACI患者Th17细胞比值显著升高,而Treg细胞比值显著下降,即患者存在Th17/Treg细胞比值失衡现象。
曲美他嗪属于一种口服代谢类药物,因其具有扩张血管及减少血小板聚集等作用而常用于急性冠脉综合征的治疗[15-16]。由于血小板聚集也参与了ACI病理生理过程[17],提示曲美他嗪对ACI也可能具有潜在的治疗效果。为进一步探讨曲美他嗪辅助治疗ACI的临床疗效及其相关机制,本研究选取南阳市中心医院神经内科84例ACI患者为研究对象,观察曲美他嗪辅助治疗ACI的临床疗效、不良反应,以及Th17、Treg细胞及其相关细胞因子水平的变化。
1 资料与方法
1.1一般资料选取2018-01—2019-06在南阳市中心医院神经内科住院的84例ACI患者为研究对象,随机分为对照组(n=42)和观察组(n=42)。2组患者性别和年龄比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组一般资料比较Table 1 Comparison of clinical characteristicsbetween two groups
1.2纳入与排除标准纳入标准:(1)ACI诊断通过头颅CT或MRI影像学诊断;(2)无溶栓指征;(3)患者临床资料完整。排除标准:(1)合并出血性疾病、肝肾功能不全、急性或慢性感染性疾病、自身免疫性疾病及恶性肿瘤者;(2)对曲美他嗪过敏及有禁忌证者;(3)中断治疗者。
1.3治疗方法对照组给予辛伐他汀调脂、阿司匹林抗凝、血栓通改善脑循环、奥拉西坦营养脑细胞、水电解质维持平衡等常规综合对症治疗。观察组在对照组的基础上给予盐酸曲美他嗪片[施维雅,(天津)制药有限公司生产,规格20 mg/片,国药准字H20055465,产品批号180503]口服,20 mg/次,3次/d。2组患者治疗2周后进行对比分析。
1.4疗效评价2周后采用美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)对2组ACI患者进行评估[18]。NIHSS评分减少>90%、>45%~90%、18%~45%及<18%分别为治愈、显效、有效和无效。总有效率=(治愈+显效+有效)/总例数×100%。ACI患者入院时NIHSS量表得分在0~9分、10~20分及21分以上分别视为轻度、重度和极重度。
1.5观察指标
1.5.1 ACI患者NIHSS改善程度:详细记录2组患者入院时NIHSS评分情况,经2周治疗后,NIHSS改善程度=(入院时NIHSS评分—2周后NIHSS评分)/入院时NIHSS评分×100%。
1.5.2 Th17和Treg比例:于治疗前和治疗2周后抽取患者外周静脉血5 mL,采用流式细胞仪(BD公司,美国)检测Th17比例和Treg比例,并计算Th17/Treg比值。
1.5.3 血清学指标:于治疗前和2周后分别抽取ACI患者外周静脉血3 mL于4 ℃离心机离心,收集上层血清置于-80 ℃冰箱中保存备用。Th17细胞相关细胞因子IL-17A和Treg细胞相关细胞因子TGF-β表达水平采用ELISA检测试剂盒检测,ELISA试剂盒购于R&D公司(美国),具体操作步骤按照ELISA试剂盒内说明书进行。
1.5.4 不良反应情况:记录2组患者入院治疗期间出现的各种不适症状,如头痛、恶心呕吐、腹痛腹泻、皮肤皮疹、肾功能及肝酶改变等情况。
1.6统计学分析采用SPSS 22.0 统计学软件处理数据。计量资料经正态检验后符合正态分布,以均数±标准差表示,2组间比较采用独立样本t检验;计数资料采用频数或百分比(%)表示,采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.12组临床疗效比较治疗2周后,对照组和观察组总有效率分别为83.33%和97.62%,与对照组相比,观察组总有效率显著升高,差异有统计学意义(P=0.026)。见表2。
2.22组治疗前后Th17比例、Treg比例、Th17/Treg比值及IL-17A和TGF-β水平比较治疗前,2组患者Th17比例、Treg比例、Th17/Treg比值、血清IL-17A和TGF-β水平相比,差异均无统计学意义(P>0.05);2周后,观察组Th17比例、Th17/Treg比值和血清IL-17A水平显著低于对照组,差异均有统计学意义(P<0.05),Treg比例及血清TGF-β水平显著升高,差异均有统计学意义(P<0.05)。见表3。

表2 2组患者治疗2周后临床疗效比较 [n(%)]Table 2 Comparison of the clinical efficacy of two groupspatients after two weeks’ treatment [n(%)]
注:与对照组比较,*P<0.05
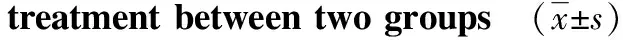

组别nTh17比例/%Treg比例/%Th17/Treg比值/%IL17A(pg/mL)TGFβ(pg/mL)治疗前2周后治疗前2周后治疗前2周后治疗前2周后治疗前2周后对照组425.35±0.923.75±0.635.74±0.817.24±0.891.49±0.320.67±0.19535.24±66.36396.36±27.7496.34±20.01163.89±35.22观察组425.41±0.783.11±0.435.68±0.767.98±0.861.52±0.380.50±0.12542.17±59.25145.27±30.02103.27±22.56269.79±40.13t值0.3225.4380.3503.8750.3914.9030.50539.8111.48912.854P值0.7480.0000.7270.0000.6970.0000.6150.0000.1400.000
2.32组不良反应比较对照组发生不良反应4例,其中恶性呕吐2例,腹泻1例,荨麻疹1例,不良反应发生率为9.52%(4/42);观察组发生不良反应5例,其中恶心呕吐3例,腹痛2例,不良反应发生率为11.90%(5/42),2组不良反应发生率比较差异无统计学意义(P=0.724)。
3 讨论
传统研究认为[5-8,17,19-20],血管内皮细胞、大脑神经元、氧自由基、血小板、一氧化氮(nitric oxide,NO)等均参与了ACI的病理生理过程中,多种因素导致脑血管血流急剧减少及脑组织缺血缺氧性改变,部分患者治疗后可发生机体神经功能缺损,严重影响生活质量。然而,近年来研究认为,免疫炎性反应,尤其Th17/Treg细胞比值失衡在ACI的发病机制中扮演了重要作用[12-14]。Th17和Treg细胞均属于CD4+T淋巴细胞亚群,Th17细胞及其分泌的主要细胞因子IL-17A在ACI的发病机制及缺血-再灌注损伤中起主要作用,主要机制可能与IL-17A可通过增加钙蛋白酶介导的瞬时感受器电位通道3,6,7(transient receptor potential channel 3,6,7,TRPC 3,6,7)水解、抑制迷走神经电刺激引起的小胶质细胞向M2极化、增加血清中Toll样受体2的表达等有关[21-23]。而Treg细胞及其分泌的细胞因子TGF-β在ACI诱导的炎性损伤及缺血再灌注损伤中发挥显著抑制作用[24-25],因此,Th17和Treg在细胞数量和功能上相互拮抗,从而共同维持机体的免疫平衡,Th17/Treg细胞及其分泌的细胞因子水平失衡则在ACI的发病机制中扮演了重要作用[9,11-14]。刘冲等[26]研究显示,急性脑梗死患者血清IL-17A水平显著升高,当经过治疗且病情缓解后IL-17A水平显著降低,提示IL-17A可能与ACI的病理生理过程有关。GELDERBLOM等[27]在脑梗死小鼠模型中进一步发现,在采用IL-17抗体阻断IL-17A的功能后,能通过减弱中性粒细胞的聚集从而减少模型小鼠脑梗死的面积。作为能减轻炎性反应的Treg细胞,DOLATI等[12]研究发现,ACI患者外周血Treg细胞比值同健康对照组相比显著降低,作为Treg细胞分泌的抗炎细胞因子之一的IL-10水平也随之降低,而IL-10具有显著减轻ACI患者外周和脑组织炎症状态的功能[28]。苏建等[29]研究发现,当ACI患者经乌司他丁辅助治疗后,血清TGF-β水平显著升高且与剂量呈现正相关性。同时,蛋白网络富集分析显示[30],TGF-β在恶性大脑中动脉梗死患者血清中表达显著下调,可作为诊断恶性大脑中动脉梗死的一项血清分子标志物。此外,动物实验研究证实,Treg细胞在ACI诱导的缺血再灌注损伤中的作用较为显著。研究发现[31],ACI后诱导的缺血再灌注损伤的小鼠模型经脂多糖预处理后,其病理损伤、运动功能障碍、认知功能障碍和炎症反应均明显减轻,主要与ACI后小鼠脾脏组织中Treg细胞数量增加并发挥显著的抗炎保护机制有关。因此,Th17/Treg细胞及其相关细胞因子在ACI的发病机制中意义重大。
曲美他嗪是临床上常用于治疗心肌梗死的药物之一。近年来研究认为[32-34],曲美他嗪能有效减轻血管内皮细胞损伤、扩张脑血管、抑制血小板聚集,从而减少动脉斑块的形成,减少炎症因子的释放,而动脉斑块、炎症状态、脑血管内皮细胞功能的损伤等均是ACI发生发展的重要因素。本研究发现,ACI患者在采用曲美他嗪辅助治疗后,与对照组相比,观察组总体有效率显著升高,Th17比例及血清IL-17A水平显著降低,而Treg比例和血清TGF-β水平显著升高,因此推测曲美他嗪对ACI治疗机制可能与改善Th17/Treg细胞平衡及降低了机体炎性状态有关。BAJNOK等[13]同样证实,ACI患者病情缓解后Th17/Treg细胞平衡得到有效改善,这与我们推测的结果一致。观察组治疗期间发生的不良反应与对照组相比几乎无显著差异,也提示曲美他嗪临床耐受性和安全性较高。
曲美他嗪辅助治疗能显著提高ACI患者常规治疗的临床效果,且能缓解机体的炎症状态,可能与平衡Th17/Treg细胞比值有关,因此,曲美他嗪在神经疾病中的临床应用具有重要意义,值得临床推广。
