血管内超声用于肾动脉狭窄病因鉴别2 例
2020-06-15熊洪亮杨娇董一飞程晓曙
熊洪亮 杨娇 董一飞 程晓曙
作者单位:330006 江西南昌,南昌大学第二附属医院心内科
1 临床资料
病例1 患者 女,37岁。2018年10月8日以“高血压病10年,反复心悸半个月”入南昌大学第二附属医院。自诉10年前体检时发现血压升高,最高达190/100 mmHg(1 mmHg=0.133 kPa),规律服用氨氯地平降压,血压控制不佳。半个月前患者在无明显诱因下突发心悸,自测血压高达170/88 mmHg,服用氨氯地平后,降压及心悸症状改善不明显。否认特殊疾病史。入院查体:右上肢血压152/72 mmHg,四肢血压及踝臂指数未见异常,其余查体无明显异常。实验室检查示:红细胞计数4.02×1012/L,血红蛋白121 g/L;血肌酐57.35 μmol/L,尿素氮2.72 mmol/L,血钾3.45 mmol/L,血钠137.33 mmol/L,血氯102.93 mmol/L;尿微量白蛋白11.47 mg/L;醛固酮(卧位)24.03 ng/dl,肾素(卧位)4.34 ng/(ml · h),醛固酮(立位)111.96 ng/dl,肾素(立位)>20.8 ng/(ml · h);皮质醇节律正常,甲氧基肾上腺素、甲氧基去甲肾上腺素、红细胞沉降率及C-反应蛋白正常,其余化验未见异常。超声心动图示:室间隔厚度8 mm,左心室后壁厚度8 mm,三尖瓣、主动脉瓣微量反流,其余指标未见明显异常。腹部、颈动脉及肾动脉超声未见异常。胸腹部CT血管造影(computed tomography angiography, CTA)示:左肾动脉近端狭窄90%,腹主动脉外膜钙化,无主动脉缩窄。肾上腺CT示:双侧肾上腺未见明显异常。入院后给予氨氯地平5 mg、每日1次,缬沙坦80 mg、每日1次及美托洛尔25 mg、每日1次。2018年10月11日行肾动脉造影术及肾动脉成形术。造影示:左侧肾动脉近段90%狭窄,右肾动脉未见异常。血管内超声(intravascular ultrasound , IVUS)示:左肾动脉内膜光滑,中膜结构消失,外膜组织增生明显(图1)。分别使用3.5 mm×20 mm、4.0 mm×20 mm、5.0 mm×20 mm及6.0 mm×20 mm的球囊(雅培,美国)依次以20 atm(1 atm=101.325 kPa)、18 atm、18 atm及15 atm扩张病变处,扩张后残余狭窄约40%,无明显夹层。术后在未调整降压药的情况下,诊室血压可维持在120/90 mmHg左右。患者术后1年在未服用降压药物的情况下血压可维持在130/80 mmHg左右。
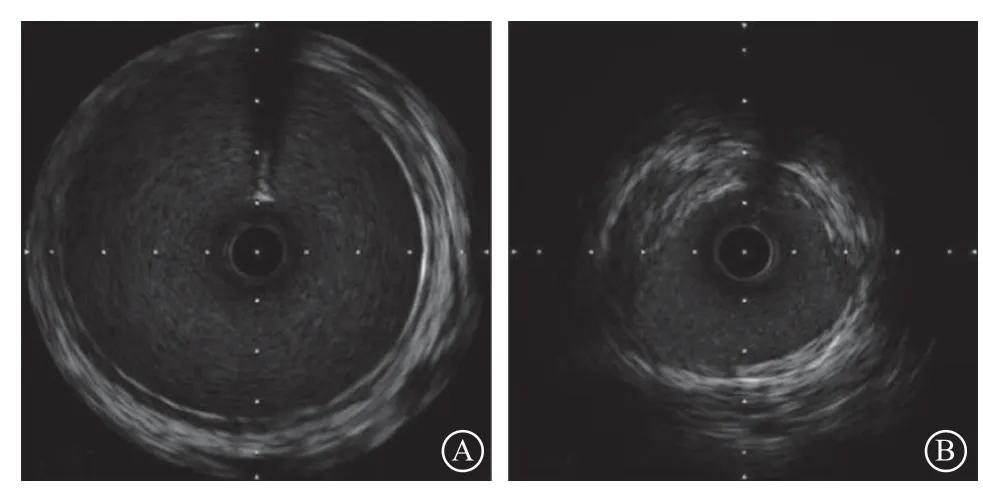
图 1 病例1血管内超声图像 A.狭窄远端正常肾动脉表现,内膜、中膜及外膜结构完整,层次分明;B.狭窄病变处中膜层结构消失,外膜组织增生明显,呈现高密度影,提示病因为非动脉粥样硬化因素
病例2 患者 男,43岁。2019年4月1日以“高血压病2年,血压控制不佳5 d”入南昌大学第二附属医院。患者2年前体检时发现血压升高,具体血压值不详,当时未予以重视,未服用降压药物。5 d前在无明显诱因下出现头晕、头痛,就诊于当地医院,测血压高达220/175 mmHg,肾动脉超声提示右肾动脉狭窄(狭窄率>60%),予硝苯地平及氨氯地平,血压下降不明显。否认特殊疾病及高血压病家族史。入院查体:右上肢血压155/98 mmHg,四肢血压及踝臂指数未见异常,其余查体无明显异常。实验室检查示:红细胞计数5.45×1012/L,血红蛋白173 g/L;血肌酐65.91 μmol/L,尿素氮5.16 mmol/L,血钾3.82 mmol/L,血钠139.99 mmol/L,血氯106.12 mmol/L;总胆固醇7.06 mmol/L,三酰甘油1.19 mmol/L;红细胞沉降率20 mm/h;醛固酮(卧位)15.29 ng/dl,肾素(卧位)>22.58 ng/(ml · h),醛固酮(立位)21.06 ng/dl,肾素(立位)>19.74 ng/(ml · h),其余化验未见异常。超声心动图、腹部及颈动脉超声未见异常。胸腹部CTA示:左肾动脉近端狭窄80%。肾上腺CT示:双侧肾上腺未见明显异常。入院后给予厄贝沙坦150 mg、每日1次。2019年4月4日行肾动脉造影术及支架置入术。肾动脉造影示:左侧肾动脉近端狭窄80%,右肾动脉未见异常。IVUS示:左肾动脉内膜光滑,中膜结构完整,内膜下可见一密度稍低于外膜的偏心斑块(图2),病变管腔最小面积6.58 mm2,正常血管管腔面积为36.09 mm2,斑块负荷74%。使用4.0 mm×20 mm球囊(雅培,美国)预扩张后,置入6.0 mm×18 mm支架1枚(雅培,美国)。支架置入后复查造影支架通畅,无明显残余狭窄和夹层。术后继续口服厄贝沙坦150 mg、每日1次,血压可维持在120~130/80~90 mmHg。术后3个月随访患者服用厄贝沙坦75 mg、每日1次,血压控制在正常范围内。
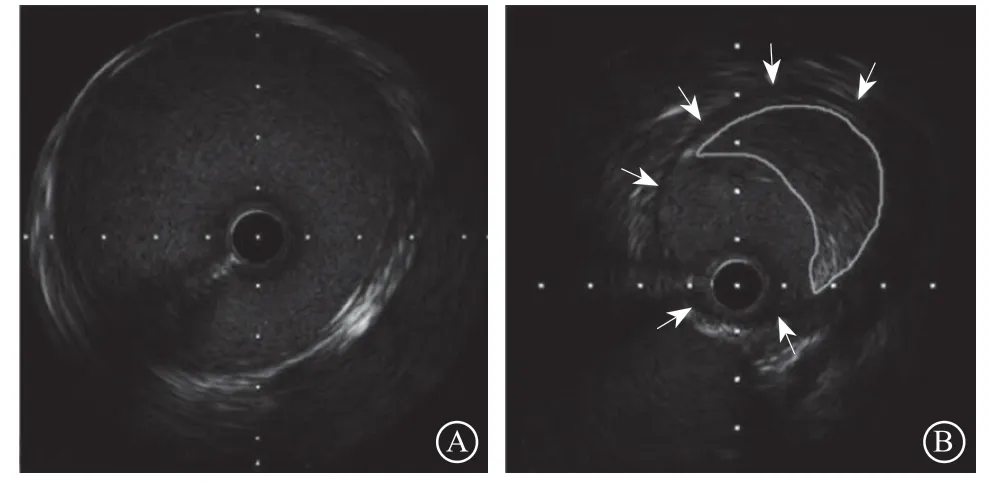
图 2 病例2血管内超声图像 A.狭窄远端正常肾动脉表现,内膜、中膜及外膜结构完整,层次分明;B.狭窄病变处内膜、中膜(箭头所示)及外膜结构均完整,内膜下偏心性低密度影斑块,提示病变为动脉粥样硬化
2 讨论
肾动脉狭窄(renal artery stenosis , RAS)在高血压人群中所占的比例为1%~5%,是常见的继发性高血压原因之一[1]。造成RAS常见原因有动脉粥样硬化(atherosclerosis, AS)、大动脉炎(Takayasu arteritis, TA)和纤维肌性发育不良(fibromuscular dysplasia, FMD),不同病因的RAS其血运重建策略不同。对于AS所致的RAS,一般采用支架置入术,而对TA和FMD等非AS所致的RAS,则建议采用球囊成形[2]。40岁以下的RAS患者,病因一般考虑为TA或FMD等非AS因素;而55岁以上的RAS患者,病因则一般考虑为AS。随着超声、CTA及数字减影血管造影在临床工作中越来越广泛的使用,RAS的检出率在不断地提高,这其中包括许多40~50岁的RAS患者。这部分患者由于年龄介于AS和非AS诊断年龄界限之间,如果缺乏AS相关危险因素,则会使得其病因诊断模棱两可。本文报道的两例患者年龄处于40岁左右,相关AS危险因素不多,使得对其病因的判断产生了一定的困难[3]。
IVUS是一项有创的断层成像技术,可以清楚地呈现血管各个断面影像信息[4]。其成像具有以下特点:(1)可呈现血管全程结构的高分辨率图像,能够精确测量血管不同断面的直径及面积;(2)能够敏感地探查到斑块并分析其类型及组成成分,并可以定量评价斑块的厚度及判断斑块的稳定性;(3)可识别动脉夹层、血栓及内膜撕裂等;(4)发现血管早期病变及指导介入治疗。目前IVUS主要用于冠状动脉,而在外周血管中的运用比较少,这方面积累的经验也比较匮乏[3]。
AS是在血管内膜受损之后出现的炎症和纤维增生反应导致的结果,主要表现为内膜下脂质的沉积,最终形成斑块,其内膜、中膜及外膜结构通常是完整的[5]。IVUS能够十分敏感地检测到斑块,并判断斑块的大小及性质,精确地提供血管内径及截面积等信息。FMD可累及内膜、中膜及外膜,造成各层不同程度的纤维增生[6]。TA累及动脉后,由于炎性细胞的浸润及平滑肌细胞的迁移,会造成动脉中膜发生弹力纤维降解及纤维化瘢痕形成[7]。由于AS以内膜下斑块为主,而TA和FMD则以血管各层结构破坏、血管壁纤维化改变为主,基于以上特点,笔者认为IVUS可用于鉴别AS和非AS性病变。本文中的病例1 IVUS表现为外膜组织增生明显,中膜结构消失,提示RAS病因为FMD或者TA,因此仅对病变采取了球囊扩张的策略,尽管管腔残余狭窄明显,但未置入支架。病例2患者IVUS发现血管内膜下明显的动脉粥样斑块,血管各层结构完整,病因考虑为AS,因此对该患者进行了支架置入。
总之,遇到年纪较轻的RAS患者,特别是在AS相关危险因素缺乏或者不多的情况下,需要对病因进行仔细的鉴别。但有时病史、危险因素和病变形态学并不能充分地指导诊断,这种情况下IVUS可能有用武之地,能为临床诊断及治疗提供重要的参考信息。
