血浆miRNA-21和miRNA-126与心肌缺血再灌注损伤的相关性研究
2020-06-15李童米小龙李学文
李童 米小龙 李学文
急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)在我国发病率和死亡率均较高。目前经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)已成为STEMI首选的治疗方法,早期及时有效地开通梗死相关血管能明显减少梗死心肌的面积,降低病死率,另一方面不可避免带来心肌再灌注损伤(myocardial ischemia reperfusion injury,MIRI)使患者预后不良[1]。有研究发现,约30%患者行PCI时血管已自发再通,这部分患者由于早期闭塞血管自行再通能够较早地恢复血流,PCI术后临床预后优于血管仍闭塞患者,其原因可能与再灌注损伤程度相关[2]。如何减轻PCI术后再灌注损伤意义重大,以往减轻再灌注损伤的药物和机械手段在临床转化的过程中大部分都失败了,因此从基因分子水平研究再灌注损伤,可能为临床上减轻再灌注损伤提供新方向。
微小核糖核酸(microRNA,miRNA)是近年来发现的体内一类小分子非编码RNA,可在血液循环中稳定存在。miRNA在心肌细胞中表达丰富,与心肌梗死、心律失常、心肌肥厚和再灌注损伤等疾病密切相关,其中miRNA-1、miRNA-21、miRNA-126、miRNA-133、miRNA-208、miRNA-499等已被证明是心肌特异性较好的miRNA[3-5]。另有研究表明,miRNA-21能抑制再灌注损伤时的细胞凋亡,miRNA-126具有维持血管结构、抑制血管炎性反应的作用,且与再灌注损伤严重程度相关[6-7]。本研究旨在通过观察STEMI患者PCI术前后miRNA-21、miRNA-126表达水平的差异,探讨二者与MIRI的关系。
1 对象与方法
1.1 研究对象
本研究为前瞻性研究,选取2017年6月至2018年12月在山西白求恩医院心内科住院治疗的急性STEMI患者100例。入选标准:(1) 首次发病伴持续性胸痛症状,缺血性胸痛发作<12 h;(2)心电图显示相邻2个及以上导联ST段抬高>0.1 mV或新出现左束支传导阻滞伴心肌坏死标志物升高[8]。排除标准:(1)既往接受过溶栓、PCI或冠状动脉旁路移植术治疗;(2)合并急慢性感染性疾病、血液系统疾病、肿瘤、周围血管疾病、严重肝肾功能不全、全身免疫性疾病、慢性肺疾病、脑梗死、脑出血、肾动脉狭窄等其他动脉狭窄相关疾病。所有入选患者冠状动脉造影时根据心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分为血管自发再通(spontaneous reperfusion,SR)组(即SR组,39例)和非SR组(61例)。SR组为TIMI血流分级Ⅱ~Ⅲ级,非SR组为TIMI血流分级 0~Ⅰ级。TIMI血流分级:0级,无血流灌注,闭塞血管远端无血流;Ⅰ级,对比剂能部分通过,冠状动脉远端不能完全显影;Ⅱ级,经过3个以上心动周期病变远端血管才能完全充盈,显影较慢;Ⅲ级,冠状动脉狭窄远端对比剂完全通过且迅速充盈[9]。所有患者均无精神异常或语言交流障碍,且本人及家属知情同意。本研究方案经山西白求恩医院伦理委员会批准。
1.2 临床资料收集
收集患者一般资料,包括性别、年龄、血压、糖尿病史、吸烟史,记录患者入院时血糖、肾功能等一般化验指标;于PCI术前、术后12 h抽取静脉血测定心肌肌钙蛋白I(cardiac troponin I,cTnI)、肌酸激酶同工酶(creatine kinase MB,CK-MB)及高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)等指标。
1.3 实时荧光定量反转录聚合酶链反应测定miRNA-21、miRNA-126表达水平
所有患者于行急诊PCI术前及术后12 h,抽取2 ml静脉血于乙二胺四乙酸管中,静置于4℃冷藏30 min后,室温下3000 r/min离心15 min,留取上层血浆于无RNA酶的1.5 ml微量离心管(EP管)中,置于-80℃冰箱储存备用。采用天津生化科技公司的总RNA提取试剂盒提取血浆总RNA。采用TaKaRa公司逆转录试剂盒进行逆转录。采用TaKaRa公司的荧光定量聚合酶链反应试剂盒检测miRNA-21与miRNA-126。采用美国ABI公司的7500 PCR仪,每个样本均设置三个重复孔,运用2-△△CT法测定两种miRNA的相对表达水平[6]。引物购自美国Invitrogen公司,引物序列见表1。
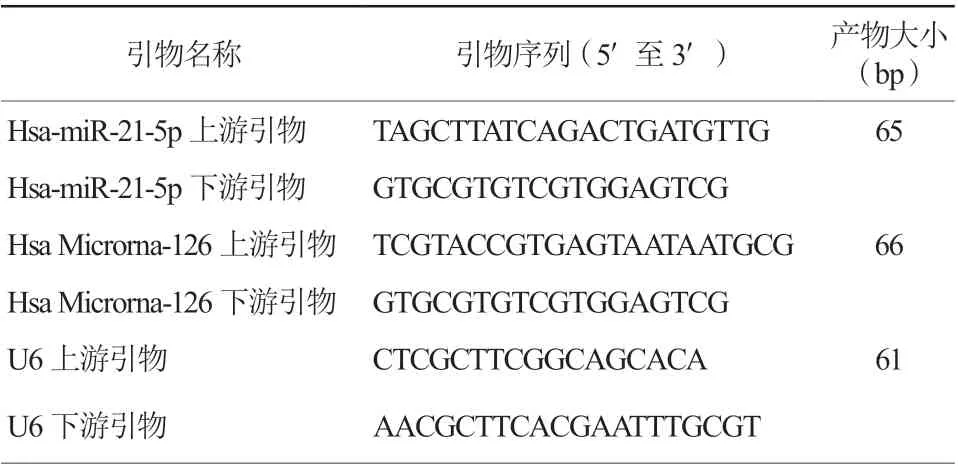
表1 引物序列
1.4 统计学分析
应用SPSS21.0软件对数据进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验,同组数据比较采用配对样本t检验;不符合正态分布的计量资料采用中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料采用频数(%)表示,组间比较采用卡方检验。采用 Pearson检验对miRNA-21、miRNA-126与cTnI、CKMB、hs-CRP的表达进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料情况比较
两组患者性别、年龄、吸烟史、糖尿病史、收缩压、舒张压、血脂水平、血糖、肌酐、发病至PCI时间、梗死相关血管等比较,差异均无统计学意义(均P>0.05,表2)。
2.2 两组患者手术前后cTnI、CK-MB及hs-CRP比较
两组患者PCI术前cTnI、CK-MB及hs-CRP表达水平比较,差异均无统计学意义(均P>0.05);非SR组PCI术后cTnI、CK-MB、hs-CRP表达水平较SR组更高,差异均有统计学意义(均P<0.05,表3)。
2.3 miRNA-21、miRNA-126相对表达水平的比较
两组患者PCI术前miRNA-21和miRNA-126的表达水平比较,差异均无统计学意义(均P>0.05);非SR组患者PCI术后miRNA-21、miRNA-126表达水平较SR组更高,差异均有统计学意义(均P<0.001,表4,图1~2)。
2.4 miRNA-21、miRNA-126与cTnI、CK-MB及hs-CRP的相关性
Pearson相关性分析显示,miRNA-21表达水平与cTnI(r=0.557,P<0.001)、CK-MB(r=0.625,P<0.001)、hs-CRP(r=0.606,P=0.001)呈正相关,miRNA-126 表达水平与cTnI(r=0.543,P=0.004)、CK-MB(r=0.669,P<0.001)、hs-CRP(r=0.558,P=0.002)呈正相关(图3)。
3 讨论
早在1960年,Jennings等[10]就观察到缺血再灌注时心肌组织出现细胞肿胀、细胞外皮破裂、肌原纤维挛缩等改变,并将此称为MIRI。目前认为再灌注损伤可能存在两个阶段:(1)再灌注后早期阶段,由氧化应激、炎性因子、钙超载等造成心肌细胞急性损伤,如凋亡或坏死;(2)再灌注晚期阶段,由于纤维组织再生引起心室重塑造成不可逆心功能损伤。通过对再灌注损伤机制的更深入认识,人们发现脑、心脏、肾等脏器缺血再灌注后不同时间段,多种miRNA表达发生显著变化。
miRNA-21是miRNA家族中的一个亚型,定位于17号染色体,在多种心脏疾病中过表达[11-12]。Dong等[13]建立大鼠心肌梗死模型,发现在心肌梗死发生后6 h左右相比于梗死区周围组织,miRNA-21在心肌梗死区组织中表达明显下降,而通过缺血预处理可以减轻这种差别,表明miRNA-21表达的增加并不是缺血导致的。该研究在心肌梗死发生24 h后用腺病毒转染过表达的miRNA-21能观察到大鼠心肌梗死面积明显减少,说明miRNA-21能对缺血诱发的细胞损伤发挥保护作用;运用蛋白质印迹法及荧光素酶进一步分析,揭示其保护机制主要通过负性调控其靶基因程序性细胞凋亡因子4(programmed cell death 4,PDCD4)和下游靶点活化蛋白-l。缺血心肌再灌注早期时活性氧自由基爆发式增长可诱发细胞凋亡。Cheng等[6]发现活性氧自由基处理后心肌细胞miRNA-21表达增强,同时PDCD4表达降低,miRNA-21通过特异性抑制PDCD4表达,降低活性氧自由基诱发的细胞死亡,提高细胞存活率,印证了Dong等[13]的研究。此外,miRNA-21还能通过抑制弹力蛋白同工异构体的表达激活蛋白激酶B信号途径从而发挥抗细胞凋亡作用,诱导miRNA-21表达能减轻心肌缺血再灌注损伤[14]。

表2 两组患者一般临床资料比较
表3 两组患者PCI 术前后cTnI、CK-MB 及hs-CRP情况比较(±s)

表3 两组患者PCI 术前后cTnI、CK-MB 及hs-CRP情况比较(±s)
注:PCI,经皮冠状动脉介入治疗;SR,自发再通;cTnI,心肌肌钙蛋白I;CK-MB,肌酸激酶同工酶;hs-CRP,高敏C 反应蛋白;a,与非SR 组术后比较,P <0.05
SR 组(39 例)术前 术后 术前 术后cTnI(ng/ml) 6.24± 4.41 58.43±39.11 6.20± 4.49 39.66±21.19a CK-MB(ng/ml) 76.71±38.08 138.94±69.77 68.95±29.93 92.78±37.01a hs-CRP(mg/L) 13.01± 6.90 21.33±10.74 11.75± 6.32 16.50± 7.64a项目非SR 组(61 例)
表4 两组患者PCI 术前后miRNA-21、miRNA-126相对表达水平(±s)
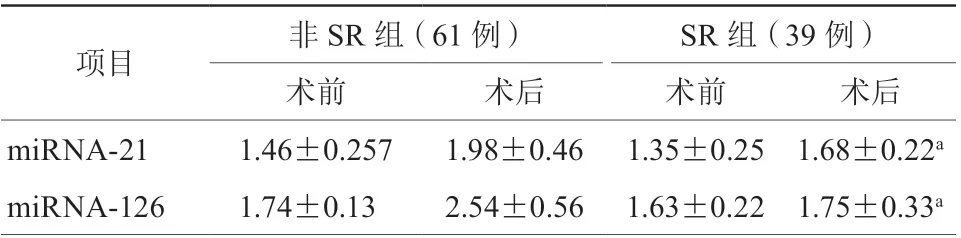
表4 两组患者PCI 术前后miRNA-21、miRNA-126相对表达水平(±s)
注:PCI,经皮冠状动脉介入治疗;SR,自发再通;a,与非SR 组比较,P <0.001
项目 非SR 组(61 例) SR 组(39 例)术前 术后 术前 术后miRNA-21 1.46±0.257 1.98±0.46 1.35±0.25 1.68±0.22a miRNA-126 1.74±0.13 2.54±0.56 1.63±0.22 1.75±0.33a
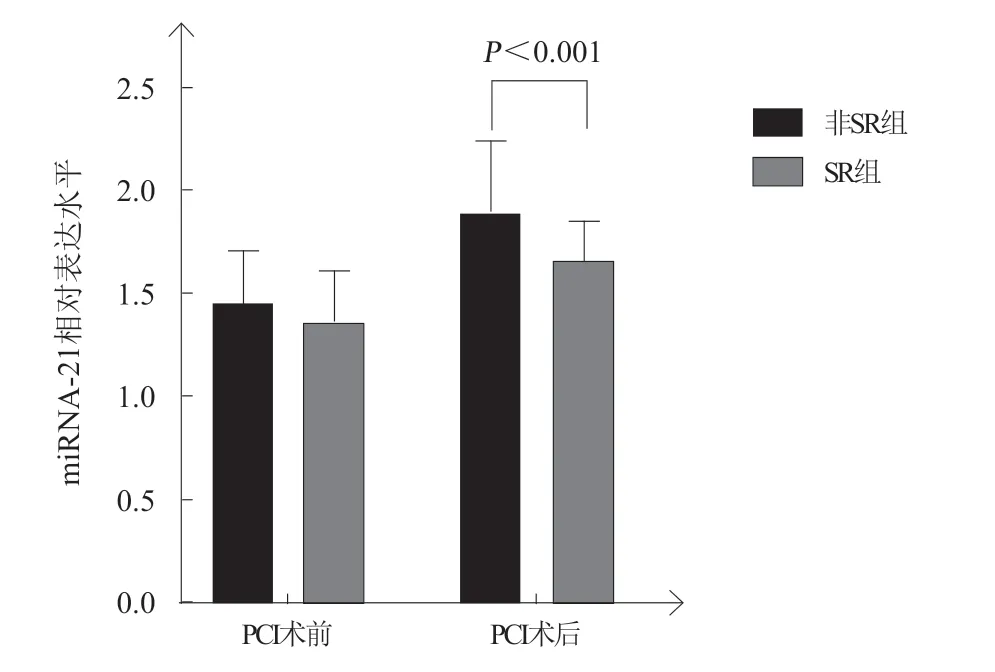
图 1 两组PCI术前、后miRNA-21的相对表达水平
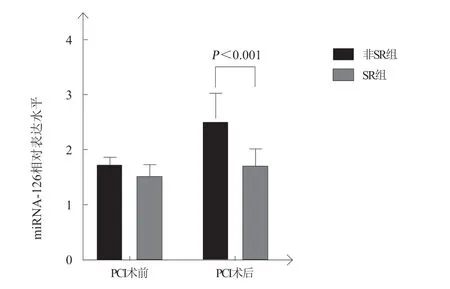
图 2 两组PCI术前、后miRNA-126的相对表达水平

图 3 miRNA-21、miRNA-126与cTnI、CK-MB及hs-CRP相关性散点图 A.miRNA-21与cTnI相关性散点图;B.miRNA-126与cTnI相关性散点图;C.miRNA-21与CK-MB相关性散点图;D.miRNA-126与CK-MB相关性散点图;E.miRNA-21与hs-CRP相关性散点图;F.miRNA-126与hs-CRP相关性散点图
miRNA-126在血管内皮细胞中高度表达,在维持血管完整性、新生血管形成和损伤修复等方面发挥着重要的作用[15]。既往在糖尿病大鼠模型上发现miRNA-126通过SPRED1基因表达,改善血管内皮的修复功能,抵御高血糖对血管内皮破坏,该研究显示血管细胞黏附分子(vascular cell adhesion molecule,VCAM)-1是miRNA-126的靶基因。VCAM-1作为细胞黏附分子超家族的成员之一,可以募集炎性细胞,促进炎性反应的发展。而miRNA-126 能够通过抑制VCAM-1表达,减弱白细胞的黏附,减轻血管内皮炎症反应,从而减轻血管损伤[16]。Zernecke等[17]研究证实,miRNA-126可通过激活基质细胞衍生因子-1的趋化因子受体4抑制细胞凋亡。以上研究对象均为动物、细胞模型,临床上是否与实验室具有相似的结果尚缺乏研究证据。本研究发现所有患者PCI术后miRNA-21、miRNA-126表达水平较术前上调,与上述研究结果一致,说明二者参与PCI术后再灌注损伤。
氧化应激、炎性反应一直被认为是再灌注损伤的关键机制,通过激活体内多种细胞信号通路,使大量的超氧离子、炎性因子集聚在组织间扩大损伤效应,诱导细胞发生凋亡或坏死。本研究选取能较好反应再灌注时心肌损伤和炎性反应相关的指标,心肌损伤或坏死时细胞膜通透性增高,心肌酶释放入血液中, cTnI、CK-MB作为心肌特异性标志物,是目前公认的急性心肌梗死诊断的金标准。炎症反应是再灌注损伤机制的重要一环,hs-CRP是一种非特异性急性时相蛋白,可精确反映体内炎症程度,其持续升高常常提示体内损伤和炎症反应程度较重。本研究发现,PCI术后cTnI、CK-MB、hs-CRP较术前明显上升,非SR组患者术后血中cTnI、CK-MB、hs-CRP浓度高于SR组,表明非SR组再灌注损伤程度较SR组严重;除此之外本研究还发现miRNA-21、miRNA-126也有类似趋势,造成这一结果的原因可能是两组发生再灌注损伤程度不同,非SR组患者梗死血管支配区域血供差,心肌缺血时间较长,再灌注造成的心肌损伤更重引起miRNA-21、miRNA-126表达水平明显上升。为了进一步验证二者与心肌损伤关系,本研究通过相关性分析发现miRNA-21、miRNA-126与cTnI、CK-MB、hs-CRP呈正相关,说明二者水平越高,再灌注后心肌损伤程度越重。
综上所述,本研究表明心肌缺血再灌注损伤同样会使人体内miRNA-21,miRNA-126表达水平上调,二者与心肌损伤程度呈正相关。本研究为单中心研究,存在样本量不足、样品收集及储存方式等原因对研究结果造成偏倚,另外本研究仅观察到再灌注前后miRNA-21、miRNA-126表达的变化,由于miRNAs调控网络复杂,一种miRNA能作用于多个靶基因,二者参与早期再灌注损伤具体调控机制未来需要更多相关研究来证实。
