原肌球蛋白的重组表达、鉴定及与免疫球蛋白E 结合能力分析
2020-06-15刘甫李军普李绍深李智伟孔德玉白虹李会强
刘甫,李军普,李绍深,李智伟,孔德玉,白虹,李会强
(1.天津医科大学医学技术学院,天津300203;2.天津市中医药研究院附属长征医院检验科,天津300120;3.天津市港口医院检验科,天津300456;4.天津医科大学基础医学院免疫学系,天津300070)
贝类是导致食物过敏的主要原因之一,在食物过敏患者中的流行率为2.8%~8.0%[1]。随着近些年来贝类消费量的不断增加,免疫球蛋白E(IgE)介导的贝类过敏对儿童和成人造成的健康威胁日益严重。
目前关于贝类过敏的实验室血清学诊断包括基于食物粗提物(包括过敏原组分与非过敏原组分)作为抗原的检测和基于纯化或者重组过敏原作为已知抗原的分子诊断[2]。分子诊断可以明确致敏蛋白,提高诊断特异性,并且某些过敏原与临床过敏症状的严重性相关,因此,这种诊断方法具有显著优势[3]。目前已明确的贝类过敏原有15 种[4]。由于部分过敏原组分在其来源中含量降低,并且纯化过程易受其他组分的干扰,通过提取纯化的方式获得单个过敏原蛋白往往难以实现。而过敏原重组表达技术可以高效的获取足量的单一目的蛋白,已被广泛应用[5-6]。
此外,一些贝类过敏人群仅对单一过敏原组分敏感,而另一些患者则对多种组分同时敏感[7]。这些不同的过敏原识别模式对贝类提取物在过敏原特异性免疫治疗(allergen-specific immunotherapy,AIT)中的安全性和有效性产生了一些限制。重组过敏原与其天然组分类似,但具有稳定的质量和无限量的产量等优点,便于选择符合条件的患者和适合的过敏原进行AIT 脱敏治疗,从而使这一领域朝着更有效的治疗效果、更少的不良反应的方向发展[5]。
原肌球蛋白(Pen a 1)是贝类动物中的主要过敏原组分。本研究中笔者成功表达、纯化出有良好免疫学活性的重组Pen a 1,为进一步研究Pen a 1在贝类动物过敏的诊断和治疗中作用奠定基础。
1 材料与方法
1.1 实验材料 限制性内切酶Bam HⅠ和HindⅢ(美国 NEB 公司),DNA 连接酶(美国 NEB 公司),质粒提取试剂盒、PCR 凝胶回收试剂盒(北京天根生化科技有限公司)LB 培养基(上海生工生物工程有限公司),Ni-NTA 纯化系统、长臂生物素(美国ThermoFisher Scientific 公司),抗人 IgE 抗体(美国Sigma-Aldrich 公司),链霉素标记的感光球、裸的发光球(北京科美生物公司)。
1.2 血清样本 收集天津市中医药研究院附属长征医院和天津市港口医院 2018 年1 月-9 月共63例临床血清样本,分别来自35 例贝类过敏患者和28 名健康志愿者。IgE 介导的贝类过敏的诊断按照欧洲变态反应与临床免疫学学会(European Academy of Allergy and Clinical Immunology, EAACI)指南推荐的以下诊断标准做出, 即基于与贝类摄入相关的严重和/或急性过敏反应等明确的临床病史,以及血清贝类特异性IgE>0.35 kUA/L(ImmunoCAP 系统,Phadia)。如果无临床贝类过敏病史且血清贝类特异性IgE<0.35 kUA/L,则为阴性血清样本,作为对照。患者入组前均获得书面知情同意。本研究经天津医科大学伦理委员(TMUHMEC2017008)批准,按照《赫尔辛基宣言》的原则进行。
1.3 Pen a 1 基因的合成 由于Pen a 1 序列(GenB ank No.DQ 151457)已知,委托通用生物系统(安徽)有限公司人工合成目的基因。目的基因合成后,通过PCR 扩增初步验证其片段大小。根据Pen a 1序列设计合成特异性引物,上游引物为5′-ACTGGTGGACAGCAAATGGGTCGCGGATCCATGG CCAT CAAGAAGAAGAT-3′,下游引物为 5′-CTCAGTGGTGGTGGTGGTGGTGCTCGAGTGCGGCCGCAAGC TTTTAGTAGCCAGACAGTTCGCTG-3′。将合成的引物和目的基因配制成混合液作为反应模板,加入DNA 聚合酶、dNTP 配制成PCR 反应体系,进行PCR 扩增并鉴定PCR 扩增结果。
1.4 重组表达质粒pET-28a (+)-Pen a 1 的构建 首先目的基因Pen a 1 与载体pET-28a(+)分别用限制性内切酶Bam HⅠ和Hind Ⅲ双酶切;然后进行核酸电泳,凝胶回收;最后在DNA 连接酶的作用下,目的基因Pen a 1 与载体pET-28a (+)进行连接,从而构建重组表达质粒pET-28a(+)-Pen a 1。将构建好的重组质粒转化至感受态Top10 中,涂布相应抗性琼脂平板。培养过夜后,平板挑菌,37℃250 r/min 摇菌16 h,用菌液进行PCR 鉴定,并将阳性克隆菌液送测序。测序比对正确的质粒,进一步进行Bam HⅠ-Hind Ⅲ双酶切验证。
1.5 重组过敏原蛋白Pen a 1 的表达、纯化 通过热休克转化法,将获得含Pen a 1 编码区和组氨酸亲和纯化标签(6His)的重组质粒转化到大肠杆菌BL 21(DE3)中,并涂布含卡那霉素琼脂平板。培养过夜后,平板挑菌至LB 菌液培养基。当培养基在600 nm 处的光密度值(OD)达到 0.4~0.6 时,添加终浓度为 1 mmol/L 的 IPTG,在 37℃,220 r/min 的条件下诱导表达3 h。4℃环境中4 000×g 离心5 min,收集菌液沉淀,PBS(pH 7.4,0.01 mol/L)重悬,超声裂解菌体,离心取上清进行蛋白电泳。根据Ni+-NTA 亲和层析说明书,对裂解液上清进行纯化,获得单一的重组蛋白。为进一步验证该蛋白,蛋白电泳、切胶回收后,送至上海生工生物工程有限公司进行质谱鉴定。
1.6 重组过敏原蛋白Pen a 1 的免疫学活性评估 血清过敏原特异性IgE(sIgE)检测采用光激化学发光均相法(light-initiated chemiluminescent assay,LICA)。LICA 基于纳米粒子对的形成和发光氧通道免疫分析技术。研究表明,该方法具有灵敏度高、分析范围广、周期快、无需洗涤等优点,适用于血清过敏原sIgE 的检测[8]。首先参照生物素试剂说明书中的标准程序,将重组过敏原Pen a 1 标记生物素。同时依据已有文献中的标记流程[8],将抗人IgE 与发光球表面带有的化学基团共价连接,制备抗人IgE标记的发光球。
然后在96 孔板中依次加入25 μL 用含有1%人血清白蛋白(HSA)的 PBS(pH 7.4,0.01 mol/L)稀释(1:20)的血清样品,50 μL(1:1 000,稀释液:PBS/HSA)抗人IgE 抗体标记的发光球和1 μg/L 的生物素化Pen a 1 溶液,37℃震荡孵育30 min。随后,加入150 μL 链霉亲和素标记的感光球,反应混合物在37℃避光条件下震荡孵育10 min。最后,在LICA仪器上检测化学发光信号(chemiluminescence,CL),信号值单位用相对光单位(relative light units, RLU)表示。同时将健康人血清平行处理作为阴性对照。每份血清样本复孔检测。
2 结果
2.1 Pen a 1 基因的PCR 扩增鉴定 根据Pen a 1已知序列,设计上下游引物,将合成的目的基因经PCR 扩增、琼脂糖凝胶电泳后,如图1 所示,所得目的片段的大小约为930 bp(加上保护碱基及酶切位点),与理论预测值相符。
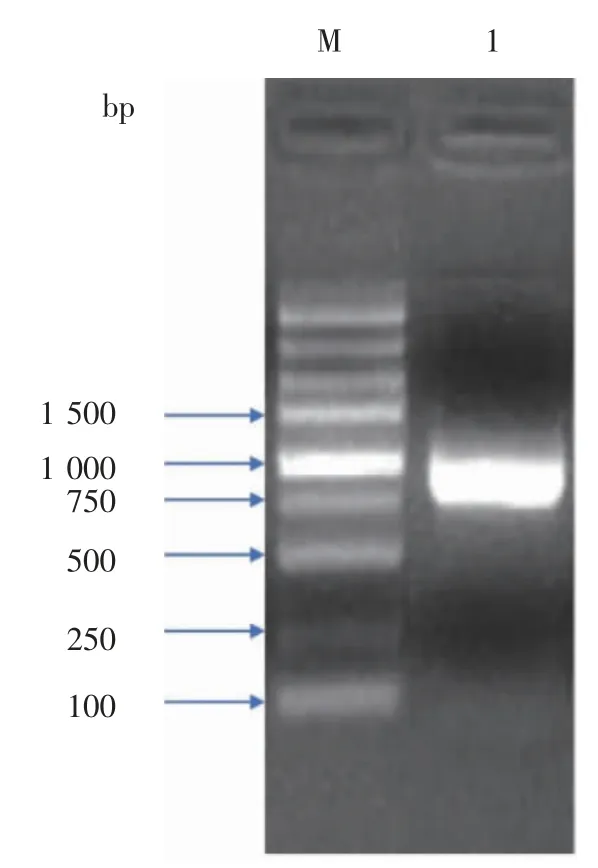
图1 原肌球蛋白(Pen a 1)PCR 扩增Fig 1 PCR amplification of the tropomyosin Pen a 1
2.2 重组表达质粒pET-28a (+)-Pen a 1 的验证 将目的基因与质粒载体酶切连接后,构建重组表达质粒pET-28a (+)-Pen a 1。部分样品的菌落PCR 结果如图2A 所示,PCR 扩增出的目的基因大小约为930 bp,与预测的片段大小930 bp 相符,说明目的基因成功连接到质粒载体上。同时阳性克隆菌的正向与反向测序结果显示所得序列与NCBI 上所公布的Pen a 1 序列一致。此外将测序正确的菌落摇菌培养,提取质粒并进行双酶切,获得的条带约 867 bp、5 400 bp 与预期 867 bp、5 400 bp 的大小一致,见图2B。酶切结果表明获得了含Pen a 1基因的重组质粒。
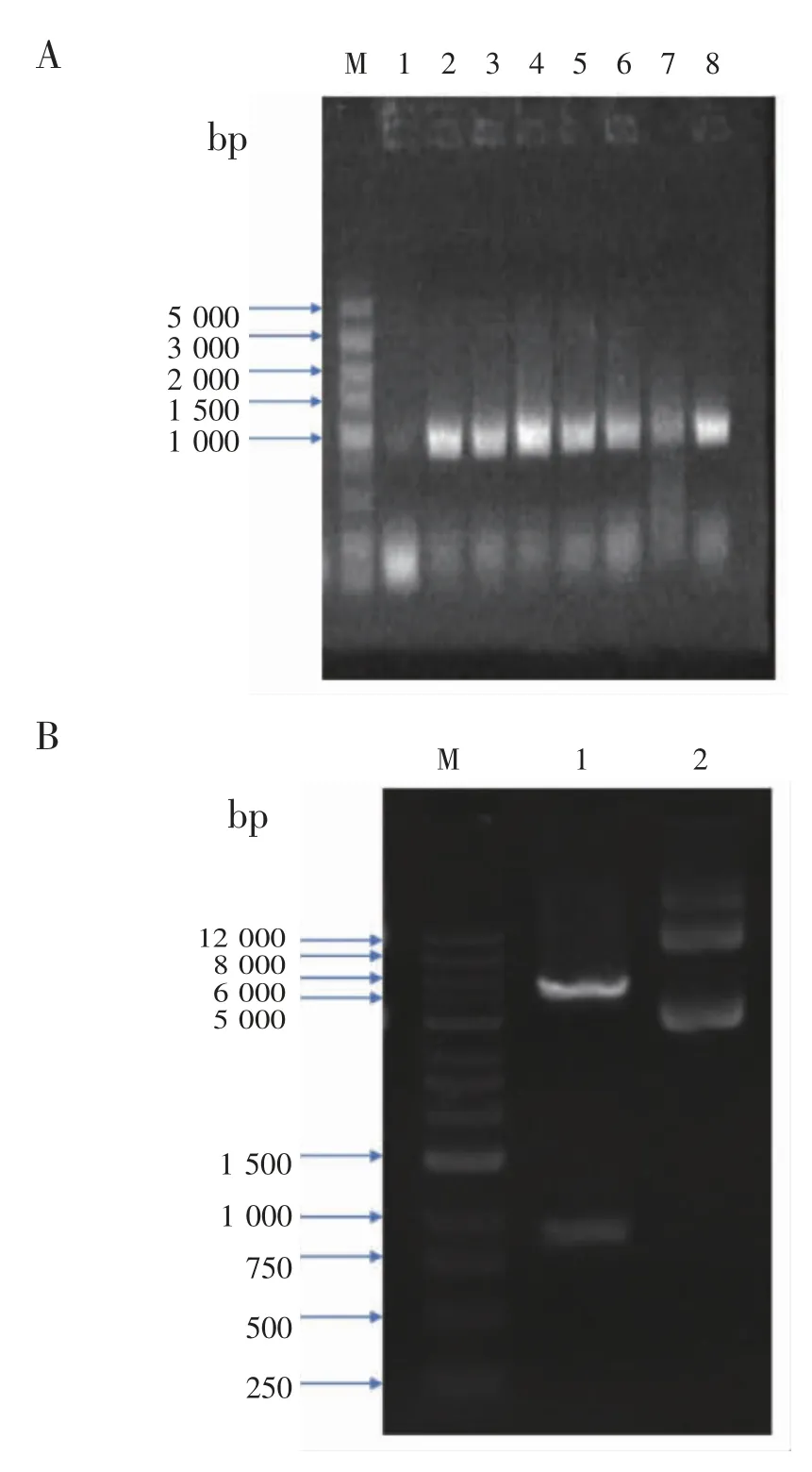
图2 重组表达质粒pET-28a(+)-Pen a 1 的验证Fig 2 Verification of recombinant expression plasmid pET-28a(+)-Pen a 1
2.3 目的蛋白的表达、纯化及及鉴定用1 mmol/L IPTG诱导培养,在37℃,220 r/min 条件下表达3 h,SDSPAGE 电泳结果显示(图3A)在36 kD 处出现一条明显增多的蛋白条带,分子量与预测值相符,且未诱导的菌体中未明显出现该条带。该目的蛋白主要出现在超声波处理后的上清液中产生,所以为可溶性表达。镍柱纯化后,SDS-PAGE 电泳结果显示(图3B)获得了单一纯化的目的蛋白。此外经进一步质谱鉴定(表1),该目的蛋白为原肌球蛋白。
2.4 血清IgE 抗体与原核表达产物Pen a 1 的结合能力 采用LICA 技术检测重组Pen a 1 过敏原结合贝类过敏患者血清IgE 抗体的结合能力。如图4 所示,71.4%(25/35)的患者血清sIgE 抗体对重组Pen a 1 过敏原敏感,与已有的文献报道类似,说明该重组过敏原具有来良好的过敏原性。
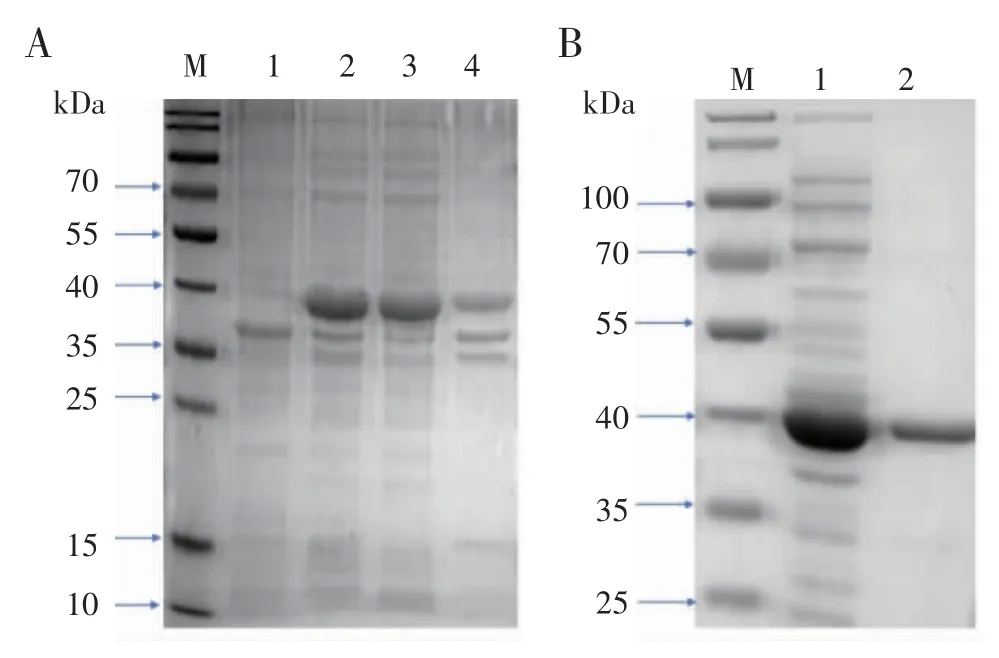
图3 目的蛋白的表达、纯化Fig 3 Expression and purification of the Pen a 1 allergen

表1 重组过敏原Pen a 1 质谱鉴定Tab 1 Identification of recombinant tropomyosin Pen a 1 by MS/MS and Mascot database searches
用LICA 检测贝类过敏血清抗体与 Pen a 1 结合反应性(n=35)。作为阴性对照,健康人血清同时也被检测(n=28)。如果过敏血清的CL 值高于以水平线表示的通过将两个标准偏差(SD)与阴性对照的平均CL 值相加而确定的截断值(Cutoff Value =Mean+2SD),则被认为反应阳性。
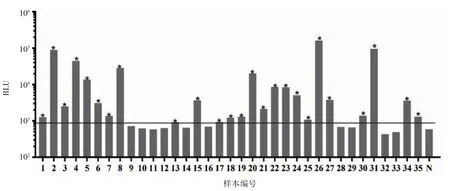
图4 重组过敏原Pen a 1 与血清sIgE 结合能力Fig 4 The ability of recombinant tropomyosin Pen a 1 binding to serum sIgE
3 讨论
由于重组过敏原有可能克服天然过敏原提取物在诊断与脱敏免疫治疗中的缺点,目前许多过敏原已蛋白已被克隆、测序和表达[9-12]。本研究中,根据Pen a 1 已知序列,笔者人工合成了其目的基因,然后与载体pET-28a(+)酶切连接,构建重组表达质粒pET-28a(+)-Pen a 1。用IPTG 处理诱导转化的大肠杆菌BL21 表达该重组蛋白。通过SDS-PAGE 检测目的蛋白质表达,得到与预计的分子量匹配的单一特异性条带。进一步的质谱分析鉴定结果证实了重组融合蛋白与Pen a 1 过敏原一致。因此,笔者成功构建了pET-28a(+)-Pen a 1 融合表达载体,并在大肠杆菌中成功表达。
Pen a 1 是贝类动物中被发现的第一个主要的过敏原,并且在13 个不同物种中被WHO/IUIS 确定和登记为过敏原[2]。同时Pen a 1 也被认为是主要的泛过敏原,介导甲壳类与其他节肢动物如尘螨或者蟑螂之间的交叉反应性[13-14]。研究表明,在虾摄入后的相关过敏反应诊断中,虾原肌球蛋白sIgE 的检测优于基于商业粗提物的皮肤点刺试验和虾sIgE 的测定[15]。目前过敏原单组分Pen a 1-sIgE 的测定以重组过敏原Pen a 1 作为已知抗原,采用荧光免疫分析(ImmunoCAP system; Phadia, Uppsala, Sweden)[16],但相关试剂及设备尚未被国内引进。因此本次研究所得的目的蛋白可以作为检测原料,依托国产检测平台(LICA 技术)将有助于本地区过敏人群的精准诊断。
目前对海鲜过敏的治疗策略在本质上大多是姑息性的,即避免摄入致敏食物,强调了对食物进行标签和检测海鲜过敏原的必要性[2]。研究认为AIT是唯一能改变过敏性疾病(如过敏性鼻结膜炎和哮喘)自然病程的病因治疗[17]。但是天然的过敏原提取物在过敏原含量上往往表现出很大的差异,可能缺乏重要的过敏原,并且可能被其他来源的过敏原污染。相反,重组技术可以生产生物活性充分表征的、纯度高、未污染的疫苗组分。此外,基因工程技术可以对野生型过敏原进行修饰,以产生具有低IgE 反应性的过敏原衍生物(“低过敏原”),降低在AIT 过程中引发不良过敏反应的风险,并保留免疫原活性[18]。同时在研究贝类过敏的免疫学机制以及加热对过敏原蛋白的影响中,也常常利用重组过敏原[19-20]。原肌球蛋白作为贝类过敏人群的主要致敏原,其重组表达形式优于有天然提取物,有助于贝类过敏人群的AIT 治疗及其他机制研究。
综上,本次研究为进一步研究重组Pen a 1 在变态反应诊断和治疗中的应用提供了基础。
