11株乳酸杆菌胆汁耐受性、耐酸性及降胆固醇能力研究
2020-06-13王欢
王 欢
(广州城市职业学院食品系,广东 广州 510405)
研究表明,血清胆固醇的升高与冠心病风险增加有关,每高于正常胆固醇水平1 mmol,冠心病的风险增加35%[1],冠状动脉死亡风险增加45%;血清胆固醇降低1%[2-3],冠心病风险将降低2%~3%[4]。含有益生菌的乳制品可降低血清胆固醇水平,但其机制尚不明晰[5]。一些乳酸杆菌可降低总胆固醇、胆固醇和低密度脂蛋白胆固醇[6-7]。
嗜酸乳杆菌菌株可分泌胆盐(胆碱甘氨酸水解酶,酶代码EC3.5.1.24),催化甘氨酸或牛磺酸结合胆盐水解为氨基酸残基和游离胆盐[8],游离胆盐的可溶性低于结合胆盐,导致肠腔吸收率降低。胆汁酸的解聚可通过增加新的胆汁酸来降低血清胆甾醇—萜醇的水平[9],这些新的胆汁酸取代了肠肝循环的胆汁酸。嗜酸乳杆菌在生长过程中可将培养基中的一些胆固醇合并到细胞膜中,被合并的胆固醇从肠道进入到血液中的可能性较小[10],说明嗜酸乳杆菌细胞中的胆固醇可以改变机体的细胞膜或细胞壁。研究[11-12]显示,只有一部分革兰氏阳性细胞在有胆固醇染色的情况下生长,而所有未经胆固醇染色的革兰氏阳性细胞都实现了生长。体外试验[13-14]表明,能吸收胆固醇的乳酸杆菌菌株在体内也能降低胆固醇。胆固醇同化与胆汁盐的存在有关,并且随着胆汁盐浓度的增加,从培养基中去除的胆固醇水平增加。然而,嗜酸乳杆菌的耐胆汁菌株没有表现出良好的吸收胆固醇的能力;具有最小胆汁耐受性的菌株实际上吸收了更多的胆固醇。非发酵冷藏期间,嗜酸乳杆菌菌株的胆固醇摄取与细菌的生长和生存能力有关,且其胆固醇同化能力依赖于生长[15-17]。
试验拟对11株乳酸杆菌的抗菌特性(耐酸性和胆汁耐受性)进行研究,并分析其去除胆固醇的能力,以期对胆固醇去除的可能机制有所裨益,为开发能在体内降低血清胆固醇的膳食添加剂提供依据。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌(Lactobacilluscasei):生物实验室;
干酪乳杆菌CSCC 2607(LactobacilluscaseiCSCC 2607):澳大利亚Highett公司;
干酪乳杆菌ASCC 1520(L.caseiASCC 1520)、干酪乳杆菌ASCC 1521(L.caseiASCC 1521)、干酪乳杆菌ASCC 279(L.caseiASCC 279)、干酪乳杆菌ASCC 290(L.caseiASCC 290)、干酪乳杆菌ASCC 292(L.caseiASCC 292)和干酪乳杆菌ATCC 15820(L.caseiATCC 15820):生物实验室发酵剂培养中心;
蛋白胨水稀释剂:上海江莱生物科技有限公司;
氢氧化钾、无水乙醇、邻苯二甲醛:分析纯,南京安伦化工科技有限公司;
厌氧罐:TU-190Z型,美国Sparks公司;
气体生成试剂盒:英国West Heidelberg公司;
分光光度计:GN-12A型,上海谷宁仪器有限公司;
离心机:L-8900型,日立高新科技公司。
1.2 试验方法
1.2.1 培养方法 将培养物储存于-80 ℃, 40%的甘油中。使用1%的接种物在无菌的De-Man、Rogosa、Sharpe(MRS)肉汤中培养3次,并于37 ℃下培养20 h。
1.2.2 耐酸性 11株嗜酸乳杆菌和干酪乳杆菌在试验前至少进行3次传代,最后一次传代后离心,按10%接种到含0.30%牛肝糖的MRS肉汤中,用盐酸将pH调至2.0,37 ℃下培养,并使用平板计数法[18]进行生长监测。连续稀释前,对含有益生菌培养物的发酵液进行5 s的超声波处理以破坏乳酸杆菌丛,连续稀释的空白组单独旋涡处理30 s。每隔30 min取1 mL样品,持续2 h,用蛋白胨水稀释剂连续稀释10倍。将样品电镀到MRS琼脂上,37 ℃,厌氧罐和气体生成试剂盒中培养24 h,通过最终平板计数与初始平板计数确定耐酸性,所有试验重复两次。
1.2.3 胆汁耐受性 每种菌株接种含有质量分数0.30%的牛肝胆、胆酸或牛磺胆酸的MRS肉汤,并于37 ℃下培养,对照组为不含胆盐的MRS肉汤。使用分光光度计于620 nm处测定培养7~8 h的吸光度。每个菌株的胆汁耐受性基于吸光度值增加0.3个单位所需时间。测定所有发酵液的初始pH值,并在吸光度增加0.3个单位后再次测量。所有试验重复两次。
1.2.4 胆固醇去除 新制备的MRS肉汤添加0.30%的牛肝糖作为胆汁盐。将水溶性胆固醇(聚氧乙烷基胆固醇酯癸酸酯)过滤灭菌,以70~100 μg/mL的最终浓度添加到肉汤中,按1%接种每种菌株,并于37 ℃下厌氧培养20 h,离心细胞。向1 mL等分试样中加入1 mL 33%的氢氧化钾和2 mL无水乙醇,旋转1 min,37 ℃下加热15 min。冷却后,加入2 mL脱分水和3 mL己烷,将1 mL己烷层转移到玻璃管中,氮气环境下蒸发,残渣立即溶解于2 mL邻苯二甲醛试剂中,混合均匀后,添加0.5 mL浓硫酸,并将混合物旋转1 min。10 min后测定550 nm处吸光度。所有试验重复两次。
1.2.5 死细胞和静息细胞清除胆固醇能力 将新制备的含0.30%牛胆汁的MRS肉汤接种到每一株乳酸杆菌中,并于37 ℃下培养20 h,4 ℃下离心10 min,培育期后收获细胞。用无菌蒸馏水洗涤细胞两次。将细胞颗粒悬浮于10 mL无菌蒸馏水中,121 ℃下蒸压15 min制备热灭细胞[19]。将热灭细胞悬浮于含0.30%的牛胆汁和水溶性胆固醇的MRS肉汤中。将细胞颗粒悬浮于10 mL无菌0.05 mol/L磷酸盐缓冲液(pH 6.8,含有水溶性胆固醇)中制备静息细胞。所有菌株于37 ℃下培养20 h,并测定肉汤中的胆固醇含量,所有试验重复两次。生长、静息和热灭细胞的胆固醇同化以干重的形式表达,并按式(1)进行计算[20-21]。
S=(C1-C2)/(W2-W1),
(1)
式中:
S——胆固醇同化量;
C1、C2——发酵液中0,20 h时的胆固醇含量,g;
W1、W2——个体培养物在0,20 h时的干重,g。
1.2.6 统计分析 使用SPSS软件进行数据分析,采用单因素方差分析显著性。使用Tukey检验对平均值进行多次比较,结果以(平均值±标准误差)表示。
2 结果与讨论
2.1 耐酸性
由表1可知,所有菌株对pH 2.0的耐受时间均为2 h。嗜酸乳杆菌ATCC 4962、干酪乳杆菌ASCC 290和干酪乳杆菌ASCC 292为最耐酸的菌株,在pH 2.0下培养2 h后,其耐酸性超过107CFU/mL;而干酪乳杆菌ASCC 1520、干酪乳杆菌ASCC 1521、干酪乳杆菌ASCC 279、干酪乳杆菌ATCC 15820和干酪乳杆菌CSC 2607是酸敏感的菌株,培养2 h后,其总耐酸性为104CFU/mL。嗜酸乳杆菌的菌落形成单位在培养的第1 h减少了2.41~2.79个对数值,而干酪乳杆菌减少了1.58~2.26个对数值。嗜酸乳杆菌菌株在整个培养期间表现出更大的耐酸性,活菌数减少了2.66~4.38个对数值,而干酪乳杆菌的减少了3.16~6.20个对数值。干酪乳杆菌CSCC 2607是最不耐酸性的菌株,培养期间,活菌数减少了6.31个对数值,其中培养的第2 h减少了4.20个对数值。
2.2 胆汁耐受性
由表2可知,培养基pH值下降最大幅度出现在干酪乳杆菌ASCC 290和CSCC 2607,添加了胆酸的培养基的初始pH值最低,但添加了牛胆汁的培养基的平均还原率最高,而最低的pH值来自于添加了牛磺胆酸的培养基(0.11)。说明不同胆汁来源培养基的初始酸碱度对培养物的后续生长和胆汁耐受性以及胆汁盐的酸碱抑制作用影响较小。多数嗜酸乳杆菌菌株在无胆汁的MRS肉汤中的生长均优于干酪乳菌株。嗜酸乳杆菌ATCC 4356在胆汁盐(牛胆汁和胆酸)和不含胆汁的情况下表现出相似的生长特性,而在含牛胆汁的MRS肉汤中,干酪乳杆菌ASCC 290的生长受到抑制(相较于对照组)。所有菌株在含有胆酸的MRS肉汤中生长速度更快;在含牛磺胆酸的MRS肉汤中生长速度较慢。在胆酸存在下,干酪乳杆菌ASCC 1520、干酪乳杆菌ASCC 1521、干酪乳杆菌ASCC 290、干酪乳杆菌ATCC 15820和嗜酸乳杆菌ATCC 4357对胆汁的耐受性最强,而嗜酸乳杆菌ATCC 4356和干酪乳杆菌CSC 2607的耐受性最低,大多数干酪乳杆菌菌株对胆酸的耐受性均优于嗜酸乳杆菌。牛磺胆酸存在下干酪乳杆菌的缓慢生长可能受其在MRS中缓慢生长的影响,而不是受结合胆汁的抑制作用[24]。嗜酸乳杆菌ATCC 33200、嗜酸乳杆菌ATCC 4357、嗜酸乳杆菌ATCC 4962和干酪乳杆菌ASCC 1521对牛磺胆酸的耐受性最强,干酪乳杆菌ASCC 279的耐受性最低(P<0.05)。干酪乳杆菌ASCC 1520、干酪乳杆菌ASCC 292、干酪乳杆菌ATCC 15820和嗜酸乳杆菌ATCC 33200的耐受性要优于干酪乳杆菌ASCC 1521、干酪乳杆菌ASCC 279和干酪乳杆菌ASCC 290。
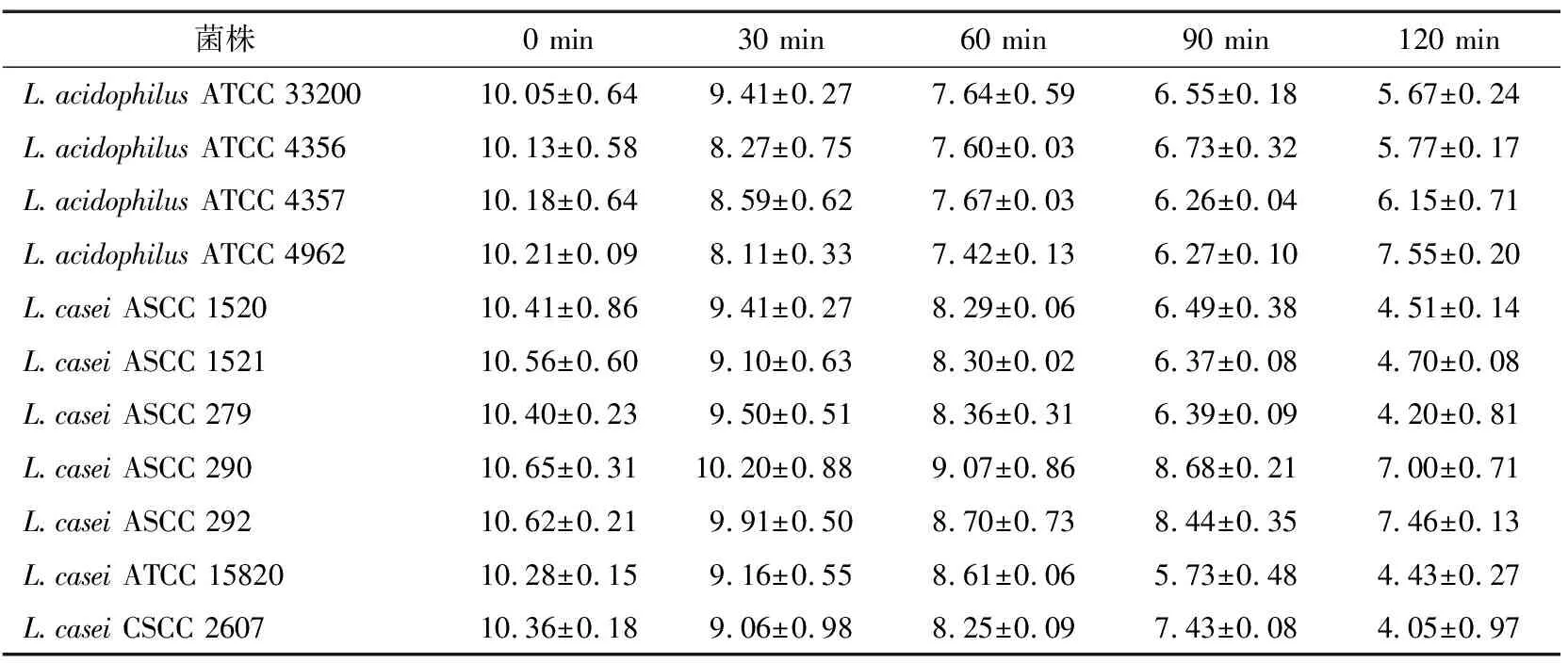
表1 嗜酸乳杆菌和干酪乳杆菌对活菌数的影响Table 1 Viability of Lactobacillus acidophilus and L. casei (pH 2.0) lg CFU/mL

表2 嗜酸乳杆菌和干酪乳杆菌的胆汁耐受性†Table 2 Bile Tolerance of Lactobacillus acidophilus and L. casei in media min
†T表示每种介质在620 nm处增加0.3个吸光度单位所需的时间;T1、T2分别表示初始时间及吸光度增加0.3单位的时间。
2.3 乳酸杆菌对胆固醇的同化作用
由表3可知,不同菌株的胆固醇去除能力不同(P<0.05),为3.76~34.69 μg/mL。与对照组相比,干酪乳杆菌在胆酸存在下吸收了更多的胆固醇。在胆酸存在下,干酪乳杆菌的总胆固醇去除能力高于嗜酸乳杆菌的,干酪乳杆菌ASCC 1520、干酪乳杆菌ASCC 1521、干酪乳杆菌ASCC 292、干酪乳杆菌ATCC 15820和嗜酸乳杆菌ATCC 4962吸收了25 μg/mL以上的胆固醇,并优于嗜酸乳杆菌ATCC 4356、嗜酸乳杆菌ATCC 4357和干酪乳杆菌CSC 2607吸收的胆固醇(≤15 μg/mL)。在牛磺胆酸存在下,多数乳酸杆菌菌株的胆固醇含量较低(相较于对照组),嗜酸乳杆菌L.acidophilusATCC 33200和干酪乳杆菌L.caseiASCC 1521的胆固醇去除能力最大(>20 μg/mL),但低于其胆汁盐。嗜酸乳杆菌的胆固醇去除能力明显高于干酪乳杆菌的。在牛胆汁存在下,胆固醇去除能力为12.03~32.25 μg/mL。除嗜酸乳杆菌ATCC 4357、干酪乳杆菌ASCC 279和干酪乳杆菌ASCC 290菌外,大多数菌株的胆固醇去除能力高于对照组,而不同处理生物量水平可能对胆固醇浓度有影响[15]。因此,后续进一步研究胆固醇同化模式及生长、热灭和休眠细胞去除胆固醇的能力。
由图1、2可知,除嗜酸乳杆菌ATCC 4962、酪蛋白1520和酪蛋白1521外,大多数菌株在胆固醇存在的情况下表现出较高的生长速度,而在无胆固醇的情况下表现出较缓慢的生长速度。在不含胆固醇的情况下,大多数菌株在培养第9~15 h内生长较快,随后生长较慢直到培养结束;在胆固醇存在的情况下,大多数菌株在培养第12~18 h内生长缓慢,随后迅速生长。不同菌株的胆固醇同化模式不同,其去除胆固醇的能力与生长相关。

表3 不同胆汁中乳酸杆菌的胆固醇去除能力Table 3 Cholesterol assimilation level of Lactobacillus in different biles μg/mL

图1 嗜酸乳杆菌在含/不含胆固醇的培养基中的生长概况Figure 1 Growth and cholesterol assimilation patterns of Lactobacillus acidophilus in media with and without cholesterol
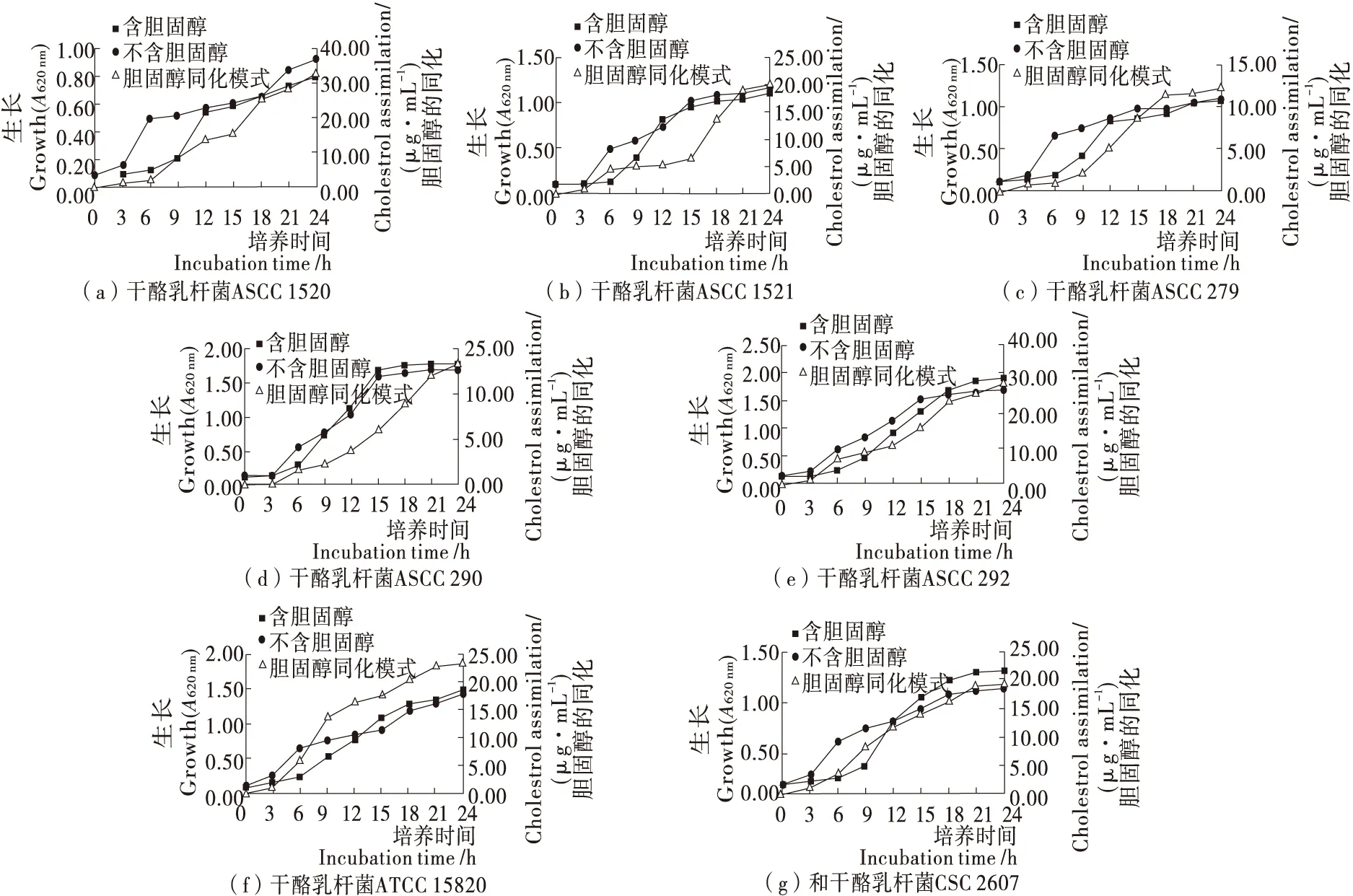
图2 干酪乳杆菌在含/不含胆固醇的培养基中的生长概况Figure 2 Growths and cholesterol assimilation pattems of Lactobacillus casei in media with and without cholesterol
2.4 生长、热灭和休眠细胞的胆固醇去除能力
由图3可知,热灭细胞和静息细胞的胆固醇去除能力较小,为0.79~3.82 mg/g,而生长细胞的为4.53~16.03 mg/g。大多数菌株在细胞悬浮于磷酸盐缓冲液(pH 6.8)中时,其胆固醇去除能力高于热灭细胞的,且在细胞热灭时,干酪乳杆菌ASCC 1520的胆固醇去除能力高于静息细胞。这是由于干酪乳杆菌ASCC 292、干酪乳杆菌 ATCC 15820和干酪乳杆菌 ASCC 1520在生长过程中吸收了更多的胆固醇,但在休息或热灭时不吸收。嗜酸乳杆菌ATCC 4357和干酪乳杆菌ASCC 1521在生长过程中吸收的胆固醇较少,但在细胞静息和热灭时表现出相对较高的胆固醇去除能力;而干酪乳杆菌ASCC 279和干酪乳杆菌ASCC 290在生长过程中吸收了最低水平的胆固醇。

图3 生长、休眠和热灭细胞的胆固醇去除能力Figure 3 Cholesterol removal by growing, resting,and heat-killed cells
3 结论
对11株乳酸杆菌的胆汁耐受性、耐酸性和降胆固醇能力进行了研究。结果表明,所有乳酸杆菌菌株在不同的酸性条件和胆汁浓度下均能存活;所有乳酸杆菌菌株均能在12.03~32.25 μg/mL的水平同化胆固醇,且其去除能力与培养物的生长有关;热灭和休眠细胞清除胆固醇的能力为0.79~3.82 mg/g,生长细胞的为4.53~16.03 mg/g。综上,干酪乳杆菌ASCC 292和嗜酸乳杆菌ATCC 4962菌株表现出良好的耐酸性和耐胆汁性,且其胆固醇去除能力最强。研究进一步说明了乳酸杆菌菌株可通过多种机制去除胆固醇,可作为降低血清胆固醇的膳食添加剂应用于食品工业。后续将继续探究乳酸杆菌去除胆固醇的具体作用机理。
