致病性粪肠球菌YN771 的分离鉴定及其生物学特性
2020-06-13向盈盈于鸿滨杨向红魏云林季秀玲
向盈盈 ,于鸿滨,周 静,杨向红,宋 飞,魏云林,季秀玲
(1) 昆明市延安医院口腔科,云南昆明 650031;2) 昆明医科大学第三附属医院微创介入科,云南昆明 650106;3) 昆明理工大学生命科学与技术学院,云南昆明 650500)
在临床中,粪肠球菌(Enterococcus faecalis)是院内感染的常见和主要条件致病菌,可引起泌尿道[1]、生殖道、腹腔、盆腔、手术伤口、血液感染及口腔感染[2]。
口腔感染性疾病中的难治性根尖周炎(Refractory periapical periodontitis) 又称顽固性根尖周炎,是指经反复多次规范根管治疗仍迁延不愈的疾病,它是口腔医师面临的棘手问题,也是牙髓病临床治疗的难题。该病可以造成患者复发性根尖周脓肿和进行性骨质破坏,并导致牙齿丧失和牙槽骨缺损,严重影响患者的治疗效果和生存质量。研究证实粪肠球菌(E.faecalis) 是根管治疗后再感染和难治性根尖周炎的主要病原菌[3-4],粪肠球菌的检出率与根尖周破坏呈正相关[5]。在根管治疗后持续性感染的根尖周粪肠球菌检出率明显增高,最高达77%[6],粪肠球菌甚至成为根管治疗后根管再次感染的唯一检出细菌。因此,控制粪肠球菌感染在根管治疗中十分重要,彻底清除粪肠球菌是提高难治性根尖炎治愈率的关键。
本研究从昆明市延安医院口腔科再治疗根管中采集根管内细菌样本,分离样本中的致病性粪肠球菌,对其进行鉴定,并研究其生物学特性,为临床治疗难治性根尖周炎提供研究材料。
1 材料与方法
1.1 实验试剂
心脑培养基(Brain Heart Infusion):简称BHI培养基,OXOID,英国贝星斯托克。
1.2 样本采集对象
自2016 年1 月至12 月就诊于昆明市延安医院口腔科门诊的患者中选取需进行根管再治疗的21 名人员,其中男性9 名,女性12 名,年龄18~50 岁。所有患牙均因患牙根管治疗后疼痛前来就诊,需要进行根管再治疗。
排除标准:口内龋齿、根尖窦道或瘘管、牙周病(牙周探诊深度>5 mm)、怀孕及本次治疗前6 个月内局部或者全身性使用过抗生素的患者。所有受试者均知情同意并签署知情同意书。
1.3 方法
1.3.1 抗生素抗性平板的配制 将青霉素G、克林霉素、氨苄西林加无菌蒸馏水溶解后,过滤除菌后备用。四环素加入乙醇溶解,四种抗生素贮存液的浓度均调整为10 mg/mL。将已灭菌的四瓶BHI 琼脂培养基冷却到50℃左右,分别加入上述四种抗生素(终浓度为10 μg/mL),摇匀后倒平板。
1.3.2 样本的采集 在患者治疗过程中完成再治疗根管内粪肠球菌样本的采集工作,采集方法参照Pinheiro[7]文献报道的方法并加以改进。整个操作过程保证严格无菌操作。首先用橡皮障隔离患牙,去除患牙冠部的充填体、去尽龋坏组织、暴露根管口,用3%过氧化氢液和25 g/L 次氯酸钠液交替清洁牙面,然后用GG 钻和不锈钢K 锉去除原根充物(注意:这一过程不使用任何化学溶剂)。再用根管测量仪测定根管工作长度,接着用生理盐水冲洗根管去除残留的根充物并使根管保持湿润状态,最后将干燥无菌纸尖插入根管并达到工作长度,停留60 s 后将纸尖转至BHI 液体培养基内。
1.3.3 致病菌的分离及培养 37℃,150 r/min,有氧条件下孵育24 h 后观察。如果培养基变浑浊,证明培养基中有细菌生长;如果培养基清亮或者颜色无变化则认为培养基中无细菌生长,阴性结果。
取培养基变浑浊的阳性结果样本,用接种环蘸取少量液体在四种抗生素抗性固体培养基上划线,37℃,150 r/min 恒温培养24 h。然后将初步认为是类肠球菌的菌株利用16S rRNA 基因序列分析法鉴定细菌。
1.3.4 致病菌的革兰氏染色 培养菌液至对数生长期(OD600=1) 时,用接菌环蘸取菌悬液均匀涂抹于干净的载玻片上,采用经典革兰氏染色法进行染色后镜检。于油镜下观察致病菌的菌体形态特征,确定革兰氏染色结果。
1.3.5 致病菌的透射电镜观察 取新分离菌的培养液(OD600=1) 25 μL 加入50 μL 浓度为0.5%的戊二醛,取混合液滴在一枚有碳膜的铜网中间,静止30 min,用吸水纸吸取多余液体,小心不要弄破铜网,取2%磷钨酸滴在铜网上,室温下对混合液进行染色2 min,后用吸水纸吸取多余染液,室温下待铜网晾干,然后进行透射电镜观察。
1.3.6 16S rRNA 基因序列分析 利用细菌基因组提取试剂盒提取所有口腔临床分离菌株的基因组DNA,严格遵从产品说明书的方法和步骤。
利用细菌16S rRNA 基因通用引物(27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-G GTTACCTTGTTACGACTT-3') 进行PCR 扩增。PCR 反应体系为50 μL:2 μL 因组模板、引物各1 μL,2.5 mM dNTP 4 μL、Ex-TaqDNA 聚合酶0.5 μL,10×Ex-Taqbuffer 5 μL,加灭菌蒸馏水补足至50 μL。PCR 反应程序如下:98℃变性30 s,50℃退火45 s,72℃延长90 s,以上过程循环30次。PCR 产物通过1%琼脂糖凝胶电泳进行检测。PCR 产物与pMD18-T 载体连接,并转化粪肠球菌DH5,阳性克隆进行序列测定,最后将测序的16S rRNA 基因序列提交NCBI 数据库,并与数据库中的其他相关基因组序列进行比对,建立同源系统发育进化,初步确定分离物的分类地位。
1.3.7 同源系统发育进化的构建 把测序获得的序列在NCBI 网站进行比对分析,挑选相似度高的序列,利用Mega 5.1 进行分析并构建系统发育树。利用Neighbor-joining 方法,即N-J 法进行分析。
1.3.8E.faecalisYN771 的生物学特性研究(1)E.faecalisYN771 的生长温度范围:将保存在4℃粪肠球菌菌悬液作为菌种,接种到新鲜BHI 固体平板上,分别倒置于4℃、10℃、15℃、20℃、25℃、37℃、42℃和55℃不同温度的恒温培养箱中,培养24 h,观察记录粪肠球菌生长状况,实验平行重复3 次。(2)E.faecalisYN771 的生长曲线:紫外分光光度仪测定生长曲线中零时读数的OD600吸光度值,之后从60 min 开始取样,一直观察到310 min。每次取2 mL 测定OD600值。以培养时间为横坐标,各时间OD600数值为纵坐标,绘制粪肠球菌的一步生长曲线。实验平行重复3 次。(3)E.faecalisYN771 的代时测定。代时是指分裂一代所用的是时间,单位为分钟。在最适条件(营养、pH 和温度) 下,培养至对数期,在不同时间后计数单位体积中的细菌个数,计算细菌数目增大一倍所需要的平均时间。E.faecalisYN771 培养2 h 取出100 μL 菌悬液,梯度稀释后做活菌计数,3.8 h 时取出100 μL 菌悬液,梯度稀释后再次做活菌计数。实验平行重复3 次;(4)E.faecalisYN771 的耐药性:取对数期E.faecalis YN771 5mL送至昆明市延安医院检验科进行耐药性检测,包含12 种抗生素,分别为:青霉素G、氨苄西林、环丙沙星、红霉素、左氧氟沙星、替加环素、利奈唑胺、莫西沙星、万古霉素、奎奴普丁、克林霉素、四环素。
2 结果
2.1 致病菌的鉴定结果
2.1.1 致病菌的形态观察 经抗生素抗性平板培养,在青霉素G、氨苄西林和四环素平皿上均无细菌生长,仅在克林霉素抗性培养基上发现6 个菌落,各菌落的形态均一致,每个菌落直径约0.5~1.0 mm,呈圆形,菌落不透明,灰白色、表面光滑。将6 个菌落分别经三次划线纯化后转接至新的抗性平皿上均能生长,随机挑取其中的一个单菌落接种至液体培养基中振荡培养,待菌液处于对数生长期时,取100 μL 梯度稀释后涂板,37℃恒温孵育24 h 后,菌落形态见图1A。光学显微镜下经革兰氏染色的菌体形态如图1B 所示,圆形或椭圆形,呈链状排列,为G+菌。透射电镜观察到细菌无芽胞,无鞭毛,直径0.9~1.1 μm(图1C、D)。

图1 细菌的形态Fig.1 Morphology of bacteria
2.1.2 16S rRNA 基因序列分析 PCR 成功扩增出大小约1,500 bp 的目的片段。16S rRNA 基因测序获得长为1,466 bp 的有效片段。
2.1.3 构建致病菌的同源系统发育进化树 同源序列比对表明:YN771 菌株与粪肠球菌的同源性最高,达到99%,将其命名为粪肠球菌YN771(Enterococcus faecalis YN771),序列提交NCBI 数据库,GenBank 登录号为MH919370。
以芽孢杆菌16S rRNA 基因作为外群,构建的系统发育进化树见图2,可以看出,YN771 菌株与粪肠球菌的相似度最高。

图2 E.faecalis YN771 系统发育进化关系Fig.2 Phylogenetic analysis of E.faecalis YN771
2.2 E.faecalis YN771 生物学特性
E.faecalisYN771 生长温度范围E.faecalisYN771 生长温度范围结果见表1,生长温度范围在20~42℃,最适温度约为37℃。

表1 E.faecalis YN771 在不同温度下的生长情况Tab.1 Growth of E.faecalis YN771 at different temperatures
2.3 E.faecalis YN771 生长曲线
通过吸光度法测定E.faecalisYN771 的生长情况,并根据吸光度绘制了该菌的生长曲线,如图3所示。E.faecalisYN771 的吸光度值随着时间的延长而不断上升。宿主菌按1%的接种量,在37℃培养箱中培养160 min 进入对数生长期,对数生长期维持时间较短,大约有80 min,培养240 min 进入到平台期。
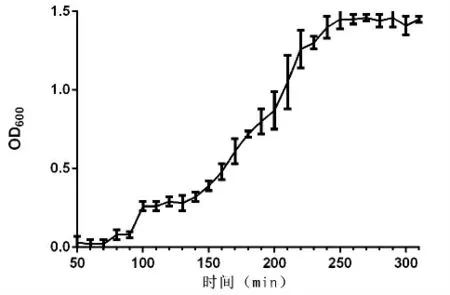
图3 E.faecalis YN771 的生长曲线Fig.3 The growth curves of E.faecalis YN771
2.4 E.faecalis YN771 的代时
在最适生长条件:BHI 培养基,37℃,pH 7条件下培养,E.faecalisYN771 培养1 h 时的活菌计数为9×107cfu/mL,培养至2.8 h 的活菌计数为6×109cfu/mL。
将数值代入公式G=1/R=(t2-t1)/3.322(lgx2-lgx1) 计算,G=18 min,代时确定为18 min。
2.5 E.faecalis YN771 的耐药性
E.faecalisYN771 耐药性实验结果见表2,可以看出,E.faecalis YN771 对青霉素G、氨苄西林、环丙沙星、红霉素、左氧氟沙星、替加环素、利奈唑胺、莫西沙星、万古霉素、四环素表现出敏感性,对奎奴普丁药敏性不高,但对克林霉素表现耐药性。

表2 E.faecalis YN771 耐药性检测Tab.2 Antibiotics-resistance of E.faecalis YN771
3 讨论
粪肠球菌是根管治疗后根尖周炎的主要检出菌[8],本实验从临床再治疗根管中分离得到一株粪肠球菌。在平皿上观察该菌的菌落直径约0.5~1.0 mm,菌落不透明,灰白色、表面光滑。光学显微镜下观察细菌为G+菌,圆形或椭圆形,呈链状排列,透射电镜观察到细菌无芽胞,无鞭毛,直径0.9~1.1 μm,完全符合粪肠球菌的形态学特点,但是链球菌在琼脂培养基也可以形成圆形、表面光滑、针尖大小的菌落,这些特征与粪肠球菌很相似[9],单凭观察其染色特性和形态特性难于把两者完全区分。为了进一步鉴别细菌种属,我们通过16S rRNA 基因序列分析和构建系统发育进化树,结果显示再治疗根管分离株与收录的粪肠球菌序列同源性最高,综合以上几个方面的鉴定,确定该分离菌株为粪肠球菌,并将其命名为粪肠球菌YN771。
本实验得出E.faecalisYN771 生长温度范围在20~42℃,最适温度约为37℃,这一结果与Erika等人所报道的研究结果一致[10],Erika 认为粪肠球菌在BHI 培养基上生长温度为6.5~47.8℃。37℃与人体及动物的口腔内的温度相适应,为后续动物实验的开展提供了数据支持,研究结果也表明E.faecalis YN771 可以在动物口腔内正常生长。温度是细菌生长的最重要影响因素,对数期的热耐受性最弱,从稳定期开始到饥饿期,细菌表现出越来越强的热耐受性[11-12]。粪肠球菌热耐受性主要与两个重要的因素有关,一是与细胞膜中脂质与脂肪酸的含量有关,越靠近细菌生长的最低温度,细胞膜的结构越稳定[12]。随着外界温度的升高,膜内饱和脂肪酸含量逐渐增加,而不饱和脂肪酸含量下降,则粪肠球菌活力减弱[13]。二是与细菌的生长阶段有关,到饥饿期,周围环境营养匮乏或低温光照的环境下达到较低的代谢水平,即进入粪肠球菌饥饿状态或活的非可培养(viable but nonculturable,VBNC) 状态,但仍保持良好的外膜完整性、黏附能力、侵入力、基因合成和表达能力,同时其外膜发生特异性变化。当外界环境适宜后,其繁殖能力可迅速恢复[14-15]。
E.faecalisYN771 对青霉素G 等10 中抗生素敏感,而对克林霉素具有耐药性。由于实验中使用的抗生素种类少,不排除其仍会对其他抗生素耐药。该菌之所以能够导致难治性根尖周炎的形成,除本身具有部分抗生素抗性外,一个更主要的原因是在根尖周微环境中有效形成了生物膜的结构,这方面的研究也值得关注。微生物形成的生物膜能使细菌耐药性提高100~1 000 倍[16]。在临床口腔治疗中,根管消毒剂氢氧化钙液pH 只有达11.5 时,才能杀死99.99%的粪肠球菌[17],提高次氯酸钠、氯己定、洗必泰及钾络合物(iodinepotassiumiodide,IKI) 的浓度也无法完全清除粪肠球菌[18-20],仍能在预备后的根管内存活。粪肠球菌可以单独形成生物膜,提高了细菌之间的能量交换、信号传递以及对恶劣环境的抵抗力量。粪肠球菌主要利用口腔食物中的碳水化合物、氨基酸、甘油、乳酸和许多酮酸等[21]产生能量。当营养匮乏、周围环境恶劣时,生物膜中的粪肠球菌的侵袭性增加,不断改变膜蛋白的表达,特别是表面毒力蛋白明胶酶E(Gelatinase E,GelE)、Ebp (Endocarditis and Biofilm Associated pili) R 和分选酶(Sortase,Srt)等在粪肠球菌生物膜形成过程中表达明显增加[22-26]。细菌会自发躲避恶劣的环境,通过丝氨酸蛋白酶,明胶酶,结合胶原蛋白粘附到牙本质小管深层、分叉区、三角区、不规则区等[27]。研究证实其侵袭能力与细菌中含有的被称为“毒力岛”的DNA 片段[28]有关。
本研究从临床再治疗根管中分离得到一株致病性粪肠球菌,通过生理生化特性及分子生物学方法对其进行鉴定,为临床治疗难治性根尖周炎提供研究材料和研究基础。
