小鼠股骨缺损模型的构建及SDF-1 表达的检测
2020-06-13李彩霞驼晓宇
董 苑,李彩霞,赵 娴,驼晓宇,刘 流,马 芸
(1) 昆明医科大学附属第一医院乳腺外科,云南昆明 650032;2) 昆明医科大学学报编辑部,云南 昆明 650500)
临床上多种疾病可能造成人体骨组织的缺损,小范围的骨缺损可以自行修复,但大范围的骨缺损并不能完全自行修复[1]。骨缺损的研究在组织工程研究领域的地位非常重要,在从动物试验通向临床研究的过程中,需要建立标准化的动物模型,笔者对标准化动物模型的要求是制作的骨缺损范围一致性,可重复性好,以达到研究结果严谨的目的[2]。骨损伤发生后,局部微环境发生变化,局部会产生多种细胞因子,这些细胞因子对各种细胞尤其是间充质干细胞的迁移、趋化、黏附、增殖和分化起到了尤为重要的作用[3]。其中,基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1) 是其中尤为重要的一员,SDF-1 是一种分泌型蛋白,属于CXC 趋化因子亚家族成员,在骨缺损修复过程中起到重要作用[4]。骨损伤出现后,局部SDF-1 分泌迅速增加,SDF-1 促使周围CXCR4+干细胞向骨损伤部位趋化迁移。因此,深入研究SDF-1 在骨缺损修复中的动态变化为研究干细胞趋化促进骨再生修复提供重要的依据。本实验为求探寻更优的小鼠骨缺损模型制作方法,动态监测骨缺损局部SDF-1 表达,了解其动态变化的趋势及特点。为求进一步了解SDF-1 在骨损伤修复过程中的作用及对间充质干细胞趋化作用的影响。
1 材料与方法
1.1 试验动物与材料
健康成年昆明鼠35 只,雄性,体重(19~25)g 普通饮食,实验动物均饲养于昆明医科大学实验动物中心。打磨机(SAEYANG MARATHON-3),SDF-1 抗体(Abcam,编号:ab25117,稀释比例1:100),EnvisionTM 试剂盒,抗体稀释液,DAB显色剂(Dako)。光学显微镜(OLYMPUS)。
1.2 实验方法
1.2.1 小鼠股骨缺损模型的构建 麻醉:0.5%戊巴比妥钠,5 mg/kg 腹腔注射麻醉。显露:右膝关节上方偏外侧平行股骨切口,显露股骨中段。制造骨缺损:使用SAEYANG MARATHON-3 打磨机,制造骨缺损范围约2 mm×2 mm,使用打磨机过程中局部滴注生理盐水以避免局部热损伤产生局部炎症。术毕缝合肌膜和皮肤。术后管理:口服抗生素,局部固定,正常喂养(见图1)。
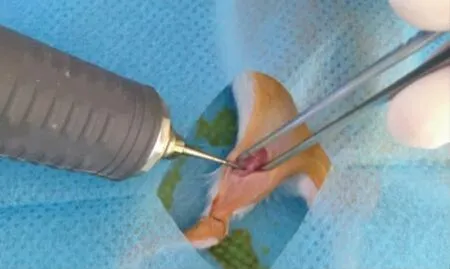
图1 小鼠股骨缺损建立过程Fig.1 Establishment of mouse femoral defect
1.2.2 小鼠骨缺损部位SDF-1 动态表达的检测(免疫组化法) 模型制作成功后的小鼠正常喂养,定期处死小鼠(术后第1、2、4、7、14 天,每次处死7 只),分别对骨缺损侧股骨及对侧股骨取材,常规固定,石蜡包埋,切片。SDF-1 免疫组化染色。
SDF-1 阳性表达定位于细胞浆,呈棕黄色颗粒状。我们将小鼠脾脏进行染色,已知B 细胞作为阳性对照,同时设置PBS 代替一抗作为阴性对照。
结果判读:采用半定量计分方式。按着色强度及阳性细胞数两种评分结合。(1) 按染色强度来分,3 分,棕褐色;2 分,棕黄色或金黄色;1分,淡黄色;0 分,无着色。(2) 按阳性细胞数:选择染色比较均匀的阳性表达区域,选取5 个HP计数阳性细胞占比。4 分,阳性细胞率>75%;3分,阳性细胞率51%~75%;2 分,阳性细胞率26%~50%;1 分,阳性细胞率5%~25%;0 分,阳性细胞率<5%。最后评分由强度及阳性细胞数两种评分相加而得,6~7 分为强阳性(+++),4~5 分为阳性(++),2-3 分为弱阳性(+),0-1 为阴性(-),所有结果判读均由两名病理医师独立完成,若出现评分不一致情况则重复观察后再进行结果确定[5]。
1.3 统计学处理
使用SPSS 统计软件,对不同时间段处死小鼠骨缺损侧和未手术侧SDF-1 表达评分之间结果比较采用配对秩和检验。P<0.05 为差异有统计学意义。
2 结果
骨缺损制作过程顺利,耗时短,制作过程中骨缺损断面光滑,无不规则断裂面及碎骨形成。实验动物除一只在术中意外死亡外,其余均存活至正常处死,局部创面未出现感染及血肿形成等情况。
SDF-1 术后动态检测结果表明,骨缺损模型建立后,骨缺损区域局部SDF-1 表达评分明显增高,并在不同时间点均呈现持续高表达,且局部阳性程度较健康无骨缺损侧明显增高(见图2,图3)。二者之间差异有统计学意义(P<0.05)。表明在骨缺损发生后,局部SDF-1 分泌明显增多,且能在骨缺损后的不同时间点持续分泌。

图2 SDF-1 免疫组化染色(×400)Fig.2 Immunohistochemical staining of SDF-1(×400)
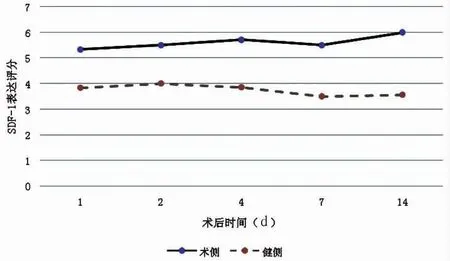
图3 SDF-1 骨缺损侧和未手术侧表达评分结果Fig.3 SDF-1 expression scores on the defect side and the non-operation side
3 讨论
骨缺损研究是组织工程修复中的重要研究领域,在此研究领域中,构建标准化的动物模型可以保证实验结果的一致性及可重复性,只有这样,才能更好地从实验研究向临床研究转化[3],因此,在骨缺损修复的研究过程中,对骨缺损模型的要求是简便易行、可重复性好、一致性好,因此选择何种方式建立骨缺损是需要思考的问题。而骨缺损模型中,骨缺损范围大小建多大也至关重要,笔者知道,骨缺损的大小和愈合率呈负相关。Van Steenberghe D[6]曾经指出,在小鼠中<2 mm 的骨缺损不作处理即可获得良好的修复。传统构建骨缺损模型常用的方法是使用骨钳,但骨钳的力度和范围较难掌握,容易出现骨质碎片及不规则断面而造成骨缺损模型的不一致性。在本实验中构建的骨缺损模型位于股骨,范围约2 mm×2 mm,制作过程中未使用传统骨钳而使用打磨机对局部骨质进行打磨发现,打磨机对于骨缺损制作的大小范围较传统骨钳可控制性好,制作过程快速,不易造成骨折及不规则缺损面,动物模型一致性强。因此,笔者通过打磨机制作的小鼠骨缺损动物模型为组织工程骨缺损的领域的研究提供了较好的动物模型。
机体发生骨缺损或者骨折后,局部出现出血及血肿形成,局部可产生一系列的炎症反应、细胞因子的释放及炎症细胞的浸润,在局部组织修复的过程中,血肿逐渐由肉芽组织替代,血肿机化进而进行局部修复。因此,笔者知道细胞因子的释放在骨缺损修复过程中起到了非常关键的作用。SDF-1 就是以上细胞因子中非常重要的一员。SDF-1 是一种分泌型蛋白,相对分子质量高度保守,是CXC 趋化因子亚家族的成员。SDF-1 在许多正常组织都有表达。SDF-1 特异性受体为CXCR4,SDF-1 与CXCR4 特异性结合发挥生物学功能。体内许多细胞表面都表达CXCR4 受体,包括所有CD34+细胞、单核细胞、淋巴细胞等。SDF-1 与其特异性受体CXCR4 结合可以参与体内许多生物学过程,其中调控及参与干细胞归巢方面的研究最为受到重视。Ali 等[7]通过SDF-1/CXCR4 轴水平的调节,可影响间充实干细胞在大鼠模型中的归巢。Yu Y 等[8]发现炎症及缺氧刺激导致的SDF-1 变化可增加骨髓间充质干细胞归巢。研究表明[9-10],当局部组织损伤后,SDF-1分泌明显增加,通过SDF-1/CXCR4 轴的作用,可促使CXCR4+的干细胞向损伤的部位发生定向迁移,干细胞发生趋化及分化,参与组织的修复和再生。于此同时,笔者研究组也曾发现外周血内皮祖细胞可以促进骨缺损部位SDF-1 分泌从而促进骨髓间充质干细胞等归巢而加强骨缺损修复过程[11]。因此,通过对SDF-1 在组织缺损修复过程中的研究,可以为SDF-1 在局部骨再生修复的研究中提供新的思路。
本实验通过探讨使用打磨机方法制造小鼠骨缺损模型,同时,对骨缺损局部SDF-1 进行的持续的检测,通过免疫组化的方法,获得骨缺损发生后SDF-1 分泌动态变化的过程。笔者发现,骨缺损发生后,缺损侧局部的SDF-1 表达所有时相对比健侧均有持续性的增高。说明骨缺损发生后,局部SDF-1 出现持续高水平分泌。由此可见,SDF-1 作为重要的趋化因子,在骨缺损修复过程中起到了非常重要的作用。
综上所述,使用打磨机方法制造骨缺损,过程快速,可重复性好,大小范围较传统骨钳易掌握且安全有效,为下一步研究提供了较好的动物模型。在骨缺损发生后,局部SDF-1 分泌增加。SDF-1 在骨缺损修复过程的各时相点,均呈现较高表达,提示SDF-1 作为干细胞重要的趋化因子,在骨缺损修复中可能发挥着重要的作用。
