Ac-SDKP 抑制SiO2 介导的肺泡Ⅱ型上皮MLE-12 细胞向间质转化的作用及机制
2020-06-13张桂珍张诗汇
张桂珍,张 乙,张诗汇,李 丹,杨 方,徐 洪
(华北理工大学基础医学院,河北唐山 063000)
课题组前期研究发现,二氧化硅(SiO2) 能够在体外激活内质网应激信号,从而促进肺泡上皮细胞的凋亡[1],并诱导肺泡II 型上皮细胞向间质细胞转化,即上皮-间质转化(epithelial-mesenchymal transition,EMT)[2]。目前多认为,EMT 可以导致肺泡II 型上皮细胞获得间质细胞表型,能够引起促炎信号、胶原合成信号的活化与释放,参与肺纤维化进程[3]。最近研究显示,刺猬信号(hedgehog,HH) 信号与矽肺纤维化进程关系密切,课题组前期研究也发现N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸(N-acetyl seryl aspartyl lysyl proline,Ac-SDKP) 能够通过对肾素血管紧张素系统和HH 信号的调节,进而抑制染尘大鼠肺纤维化病变程度,并能够在体外抑制血管紧张素II介导的HH 信号的活化和肌成纤维细胞分化[4]。因此,拟通过体外SiO2诱导的肺泡II 型上皮MLE-12 细胞的EMT 模型,并给予Ac-SDKP 预处理,探讨Ac-SDKP 能否通过调控HH 信号从而拮抗SiO2介导的肺泡II 型上皮细胞EMT 进程。
1 材料与方法
1.1 主要试剂与材料
小鼠MLE-12 肺泡II 型上皮细胞(中科院上海细胞库);达尔伯克(氏) 改良伊格尔(氏) 培养基(dulbecco modified eagle medium,DMEM)(10099141,美 国GIBCO 公 司);胎牛血清(BI-SH0019,以色列BI 公司);SiO2(S5631,美国 sigma 公 司);Ac-SDKP(H-1164,瑞典Bachem 公司);GDC-0449(S1082,中国Selleck公司);GANT61(S8075,中国Selleck 公司);I 型胶原(ab34710,英国Abcam 公司);α-SMA(ab32575);I 型胶原(北京博奥森);E-钙粘蛋白(E-cadherin,E-cad,北京博奥森);音刺猬因子(sonic hedgehog,SHH)、Smoothened(SMO)、胶质瘤相关癌基因同源蛋白(glioma-associated oncogene homolog,GLI) 1(A7726,A3274,A14675,武汉爱博泰克生物科技有限公司);GLI 2、α 微管蛋白(Tublin,Tub) (DF7541,AF7010,美国Affinity 生物科技有限公司)。
1.2 细胞培养
MLE-12 细胞使用含体积分数为10 %胎牛血清的DMEM/F12 培养基,在37 ℃、5%CO2孵育箱中培养,取3~5 代进行实验。细胞密度为70%左右时进行实验,无血清同步化过夜。实验分组为:(1) ①对照组:无血清DMEM/F12;②SiO2诱导组:无血清DMEM/F12 条件下给予终浓度50 μg/mL 的SiO2诱导;③Ac-SDKP 组:无血清DMEM/F12 条件下给予终浓度为 10-8mol/L Ac-SDKP[5-8];④SiO2+Ac-SDKP 组: 无血清DMEM/F12 条件下先给予Ac-SDKP 预处理1 h 后再给予SiO2共诱导;(2) ①溶剂对照组:无血清含0.1%DMSO 的DMEM/F12;②SiO2诱导组:无血清含0.1%DMSO 的DMEM/F12 条件下给予终浓度50 μg/mL 的SiO2诱导;③GDC-0449 组:无血清DMEM/F12 条件下给予终浓度为2×10-5mol/L的 GDC-449(含终浓度 为 0.1% DMSO)[7];SiO2+GDC-0449 组:④无血清DMEM/F12 条件下先给予GDC-0449(含终浓度为0.1%DMSO) 预处理1 h 后再给予SiO2共诱导;(3) ①溶剂对照组:无血清含0.1%乙醇的DMEM/F12;②SiO2诱导组:无血清含0.1%乙醇的DMEM/F12 条件下给予终浓度50 μg/mL 的SiO2诱导;③GANT61 组:无血清DMEM/F12 条件下给予5×10-6mol/L 的GANT61(含终浓度为0.1%的乙醇)[7];④SiO2+GANT61 组:无血清DMEM/F12 条件下先给予GANT61(含终浓度为0.1%的乙醇) 预处理1 h 后再给予SiO2共诱导。
1.3 免疫印迹
每25 cm2细胞培养瓶加入RIPA 裂解液100 μL,刮取细胞冰上孵育15 min,12 000×g 离心15 min,收集上清。经考马斯亮蓝法测定蛋白浓度后上样(20 μg/泳道),常规电泳及电转。一抗(1:1 000 稀释) 4℃过夜;二抗(1:5 000) 37℃孵育30 min,ECL 发光试剂显色。采用Image-Pro-plus 6.0 图像处理软件对条带进行分析,以目的蛋白光密度值与内参蛋白光密度值的比值作为该蛋白的相对表达量。
1.4 统计学处理
采用SPSS 统计分析软件进行统计分析。计量资料服从正态分布用描述,多组间比较用完全随机设计的单因素方差分析,有差异时两两比较方差齐采用LSD 检验,方差不齐采用Tamhane’s 检验。P<0.05 为差异有统计学意义。
2 结果
免疫印迹结果显示(图1~2,表1~2),予以SMO 抑制剂GDC-0449 或Gli1 抑制剂GANT61,均能够有效抑制SiO2介导的E-cadherin 蛋白表达的下调,并抑制Col I 和α-SMA 蛋白表达水平的上调。
免疫细胞化学染色结果显示(图3),与对照组相比,SiO2诱导组中SMO 及Gli 1 强阳性表达,给予Ac-SDKP 处理后,阳性表达减弱。免疫印迹结果显示(图4、表3),与对照组相比,SiO2诱导组中Col I、α-SMA、SHH、SMO、Gli1 及Gli2 蛋白表达上调,E-cadherin 表达下调。与SiO2诱导组相比,Ac-SDKP 预处理组Col I、α-SMA、SHH、SMO、Gli1 及Gli 2 蛋白表达下调,E-cadherin 的表达上调,以上结果经方差分析,差异具有统计学意义(P<0.05)。
3 讨论
尘肺(包括矽肺) 病是我国最严重的职业病,以矽结节的形成和弥漫性间质肺纤维化作为主要特征。课题组前期研究也发现,EMT 在矽肺发生、发展中起到了重要的调节作用[2],部分间质纤维化区域存在肺泡上皮细胞向间质细胞转化的过程,上皮细胞失去原有的紧密连接,变得易于迁移,并释放促炎因子从而加速的纤维化进程[3,5]。因此,抑制肺泡II 型上皮发生EMT 可能是潜在的抗肺纤维化治疗的策略之一[6]。在本研究中也发现,50 μg/mL SiO2诱导MLE-12 细胞24 h 时E-cadherin 表达水平显着降低,而间充质细胞标记物α-SMA,以及HH 信号关键调节因子SMO、SHH、GLI1 和GLI2表达上调,表明SiO2诱导MLE-12 细胞上皮间质转化的过程伴随着HH 信号的激活。
表1 GDC-0449 对SiO2 介导的MLE-12 细胞EMT 的调节作用()Tab.1 Effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells()

表1 GDC-0449 对SiO2 介导的MLE-12 细胞EMT 的调节作用()Tab.1 Effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells()
与对照组比较,*P <0.05;与SiO2 诱导组比较,#P <0.05。
表2 GANT61 对SiO2 介导的MLE-12 细胞EMT 的调节作用()Tab.2 Effect of GANT61 on SiO2 induced EMT of MLE-12 cells()

表2 GANT61 对SiO2 介导的MLE-12 细胞EMT 的调节作用()Tab.2 Effect of GANT61 on SiO2 induced EMT of MLE-12 cells()
与对照组比较,*P <0.05;与SiO2 诱导组比较,#P <0.05。
表3 Ac-SDKP 对SiO2 诱导的MLE-12 细胞Col I、α-SMA、E-cadherin 及HH 信号分子的影响()Tab.3 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2()
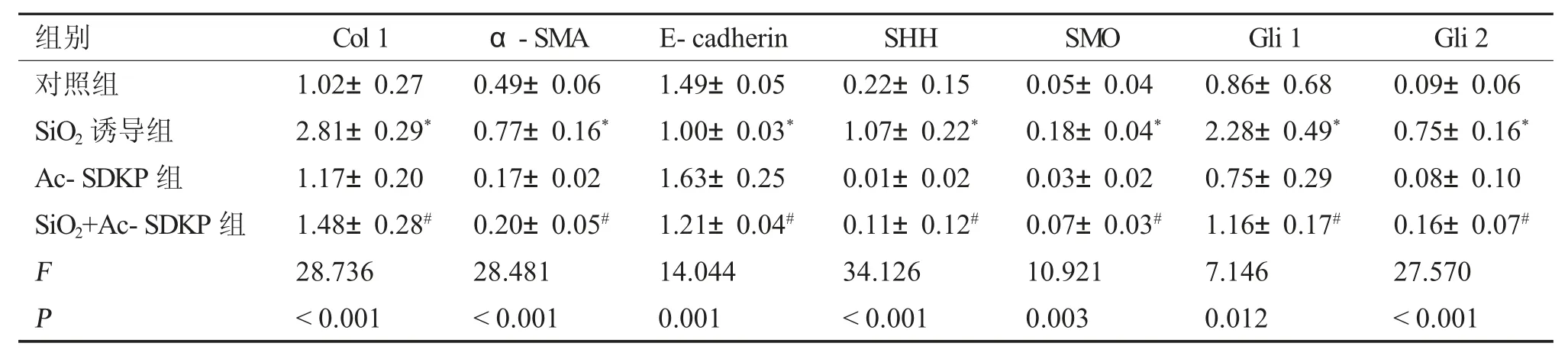
表3 Ac-SDKP 对SiO2 诱导的MLE-12 细胞Col I、α-SMA、E-cadherin 及HH 信号分子的影响()Tab.3 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2()
与对照组比较,*P <0.05;与SiO2 诱导组比较,#P <0.05。
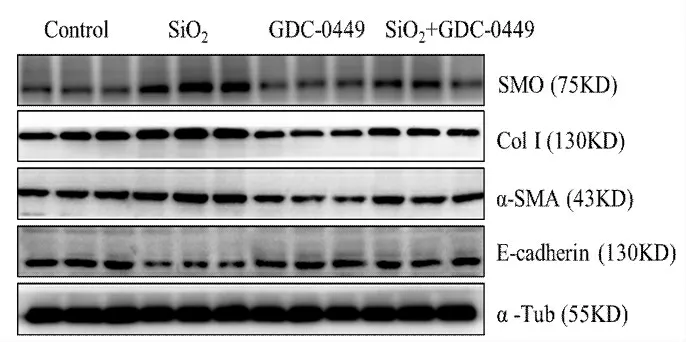
图1 GDC-0449 对SiO2 介导的MLE-12 细胞EMT 的调节作用Fig.1 The effect of GDC-0449 on SiO2 induced EMT of MLE-12 cells

图2 GANT61 对SiO2 介导的MLE-12 细胞EMT 的调节作用Fig.2 The effect of GANT61 on SiO2 induced EMT of MLE-12 cells
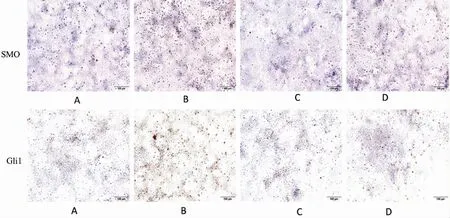
图3 免疫组织化学检测MLE-12 细胞中SMO 和Gli1 蛋白表达(×200)Fig.3 Expressions of SMO and Gli1 in MLE-12 cells were detected by immunohistochemistry (×200)

图4 Ac-SDKP 对SiO2 诱导的MLE-12 细胞Col I、α-SMA、E-cadherin 及HH 信号分子的影响Fig.4 Effect of Ac-SDKP on the expression of Col I,α-SMA,E-cadherin and HH signaling molecules in MLE-12 cells induced by SiO2
近来研究也显示,HH 信号在肺再生和维持中起到重要的调节作用[7],对HH 信号的阻断也被发现具有拮抗肺纤维化形成的作用[8-9]。在本研究中,利用HH 信号SMO 受体抑制剂GDC-0449 和GLI转录因子抑制剂GANT61 来观察对SiO2诱导的上皮间质转化的影响,发现阻断HH 信号能够显著抑制SiO2介导的MLE-12 的EMT 进程。有研究表明,GANT61 可以通过靶向性抑制Gli1 的表达上调E-cadherin,下调Vimentin,进而调控肺癌细胞的EMT 进程[10],在非小细胞肺癌中,采用针对Hedgehog 信号通路SMO 的特异性抑制剂能够有效地逆转肺癌细胞的EMT 现象[11]。落新妇苷被发现能够通过对HH 信号的调节,抑制TGF-β1 诱导的肺泡II 型上皮细胞和L929 细胞的EMT 进程,上调E-cadherin、肺泡表面活性物质C 的表达,同时抑制α-SMA 和Snail 蛋白的表达,体内研究也发现能够拮抗博来霉素小鼠的肺间质纤维化病变程度[8]。HH 信号的激活,能够诱导肺常驻间质干细胞向肌成纤维细胞分化,从而加速的肺纤维化进程[9]。在本研究中,也发现SiO2能够激活HH 信号,从而促进了MLE-12 细胞发生EMT,结合课题组前期研究结果[4],提示HH 信号的激活在矽肺纤维化进展中可能起到了重要的调控作用。
课题组多年来,围绕Ac-SDKP 的抗矽肺纤维化作用进行了系列研究[1,2,4],前期已经证明矽肺进展伴发EMT 过程,而Ac-SDKP 能够保护肺泡II型上皮细胞,同时抑制其向间质细胞转化。本研究结果显示,予以Ac-SDKP 预处理,能够显著抑制HH 信号相关蛋白的活化,进而抑制了EMT 的形成。提示Ac-SDKP 能够通过对HH 信号的调节,拮抗SiO2介导的肺泡II 型上皮MLE-12 细胞的EMT 进程。
