超声波协同复合酶提取猴头菇多糖的研究
2020-06-13肖玉娟毛玉婷林慧霞周小伟
傅 奇,肖玉娟,毛玉婷,林慧霞,周小伟
(1.厦门华厦学院环境与公共健康学院,福建厦门 361024;2.江西省山江湖开发治理委员会办公室,江西南昌 330046;3.韶关学院英东食品科学与工程学院,广东韶关 512005)
0 引言
猴头菇又名猴头菌、刺猬菌[1],蛋白质、维生素和矿物质等含量丰富,且含有人体必需的8 种氨基酸,干猴头菇所含有的蛋白质含量为香菇的2 倍[2]。作为猴头菇的主要活性成分,猴头菇多糖具有极高的营养价值,具有保肝护肝、增强机体免疫力、抗肿瘤、降血糖和降血脂等[3-4]生理功能。猴头菇多糖主要是由葡萄糖、甘露糖和半乳糖等重要成分构成的葡聚糖,是β-1,3 键连接的主链和β-1,6 键连接的支链构成的基本结构[5]。
迄今为止,水提法、超声波技术和酶法技术[6-10]已广泛应用于植物多糖的提取中。同时,多种提取方法的协同作用对于提高多糖的提取率也大有裨益。如超声微波协同提取富硒蛹虫草硒多糖[11],超声-酶法[12-14]提取百合多糖、玉米多糖、杏鲍菇多糖等。近年来,研究人员主要通过热水浸提法、酶法、微波提取法、超声波提取法、微波协同复合酶法等提取猴头菇多糖[15]。但传统热水浸提法耗时长且提取率较低,而超声波由于其强烈的空化和搅拌作用等可以有效加速植物中的多糖溶于溶剂中[16],从而缩短提取时间,同时该提取方法温度低,能够防止多糖的结构被长时间的高温作用毁坏,得以大大提高多糖的提取率。同时,酶制剂由于安全、高效,被广泛应用于食用菌的功能活性物质提取。
试验对比超声波协同复合酶提取猴头菇多糖得率和超声波法提取猴头菇多糖得率情况,并通过正交试验优化出超声波协同复合酶法提取猴头菇多糖的最优工艺条件,以期提高多糖的提取率,增大猴头菇的利用率,提高猴头菇产品的营养价值。
1 材料与设备
1.1 材料与试剂
干猴头菇,五马寨菌业有限公司提供;纤维素酶(15 000 U/g)、果胶酶(15 000 U/g),均为食品级;柠檬酸、柠檬酸钠、葡萄糖、苯酚、浓硫酸等,均为分析纯。
1.2 仪器与设备
T6 新世纪型可见分光光度计,北京普析通用仪器有限责任公司产品;CS-2000 型高速多功能粉碎机,永康市天祺盛世工贸有限公司产品;HH-S16s型数显恒温水浴锅,金坛市大地自动化仪器厂产品;SK8210LHC 型超声波清洗器,上海科导超声仪器有限公司产品;ZD-2 型自动电位滴定仪,上海仪电科学仪器股份有限公司产品;DHG-9076 型电热恒温鼓风干燥箱,江苏金坛市大地自动化仪器厂产品;SHD-Ⅲ型循环水式多用真空泵,保定高新区阳光科教仪器厂产品;BS210S 型电子分析天平,北京赛多利斯天平有限公司产品;YP1201N 型电子天平,上海精密科学仪器有限公司产品。
2 试验方法
2.1 工艺流程
干猴头菇→粉碎→过30 目筛→称重→溶解→复合酶酶解→超声波处理→灭酶→抽滤→除蛋白→醇沉→冷冻干燥→猴头菇粗多糖→测定。
2.2 多糖含量的测定——苯酚硫酸法[17]
称取适量粗多糖溶于水,配成供试液,按标准曲线制备方法测定吸光度,代入标准曲线,计算多糖含量,并计算猴头菇多糖提取率。
2.2.1 标准曲线建立
0.50 g 葡萄糖在80 ℃下干燥至恒质量,称取0.01 g 葡萄糖标准品溶解,在100 mL 容量瓶中定容,振荡摇匀,配成质量浓度0.1 mg/mL 的葡萄糖标准溶液。
称取5 g 苯酚,添加适量蒸馏水并搅拌,待其完全溶解后,定容至100 mL。
分别移取0.2,0.4,0.6,0.8,1.0 mL 的葡萄糖标准液于试管中,依次添加1 mL 质量分数5%的苯酚溶液,振荡,再缓慢加入5 mL 的浓硫酸,边添加边振荡。蒸馏水作为空白对照。20 min 后,于波长490 nm 处测定样液。
2.2.2 多糖含量计算[18]
多糖含量根据式(1)计算

式中:C——样品溶液葡萄糖质量浓度,mg/mL;
V——供试液体积,mL;
m——供测粗多糖质量,mg。
2.2.3 多糖提取率计算[18]
多糖提取率按式(2)计算

式中:m——醇沉后得到的粗多糖总质量,g;
m1——称取的猴头菇样品干质量,g。
2.3 猴头菇粗多糖的提取方法
2.3.1 超声波提取法
称量5 g 猴头菇粉,根据料液比添加适量的蒸馏水,搅拌溶解,并选用超声功率、超声时间、料液比作为试验因素,各取5 个水平进行单因素试验,超声功率200,250,300,350,400 W;超声时间5,10,15,20,25 min;料液比 1∶10,1∶15,1∶20,1∶25,1∶30。以单因素试验结果为依据总结各因素的最佳条件,并通过三因素三水平正交试验进一步研究因素间的相互影响,根据正交试验得到超声波提取猴头菇多糖的最优组合。
正交试验因素与水平设计见表1。
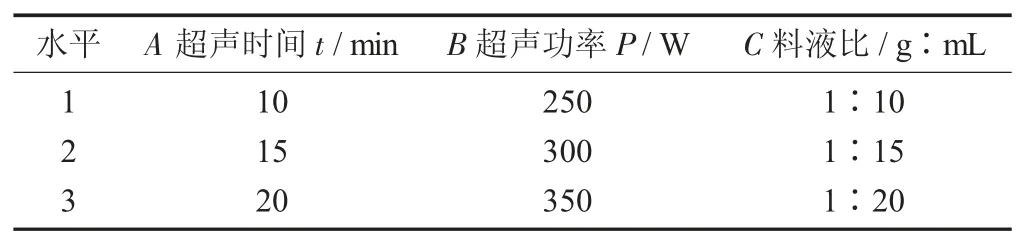
表1 正交试验因素与水平设计
2.3.2 超声波协同复合酶提取法
(1)单因素试验。称量5 g 猴头菇粉,根据料液比添加适量的蒸馏水,搅拌溶解,在复合酶比例为1∶1,酶解时间30 min,pH 值4,酶解温度50 ℃的条件下完成复合酶酶解,选取超声时间、超声功率、料液比、复合酶添加量作为因素,各选取5 个水平进行单因素试验,确定各因素最优水平。
①超声时间对多糖提取率的影响。在超声功率250 W,料液比1∶25,复合酶添加量2%的基础上,采用10,15,20,25,30 min 的超声时间进行试验,研究猴头菇多糖的提取率因不同的超声时间产生的变化。②超声功率对多糖提取率的影响。在超声时间25 min,料液比1∶25,复合酶添加量2%的基础上,采用200,250,300,350,400 W 的超声功率进行试验,研究猴头菇多糖的提取率因不同的超声功率产生的变化。③料液比对多糖提取率的影响。在超声时间25 min,超声功率250 W,复合酶添加量2%的基础上,采用1∶15,1∶20,1∶25,1∶30,1∶35 的料液比进行试验,研究猴头菇多糖的提取率因不同的料液比产生的变化。④复合酶添加量对多糖提取率的影响。在超声时间25 min,超声功率250 W,料液比1∶25 的基础上,采用1.0%,1.5%,2.0%,2.5%,3.0%的复合酶添加量进行试验,研究猴头菇多糖的提取率因不同的复合酶添加量产生的变化。
(2)正交试验。依据单因素试验的分析结果,分别选取超声时间、超声功率、料液比、复合酶添加量4 个因素,按照四因素三水平表完成正交试验,因素之间的交互作用将不被予以考虑。并通过正交试验总结出最高的多糖提取率组合。
正交试验因素与水平设计见表2。
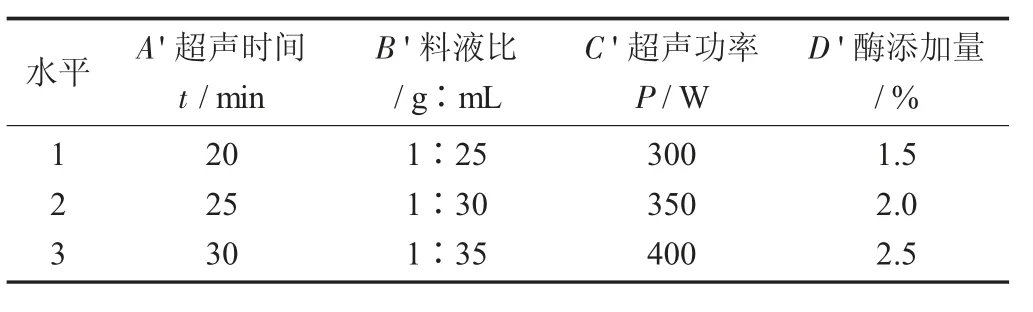
表2 正交试验因素与水平设计
3 结果与分析
3.1 标准曲线绘制
葡萄糖标准曲线见图1。
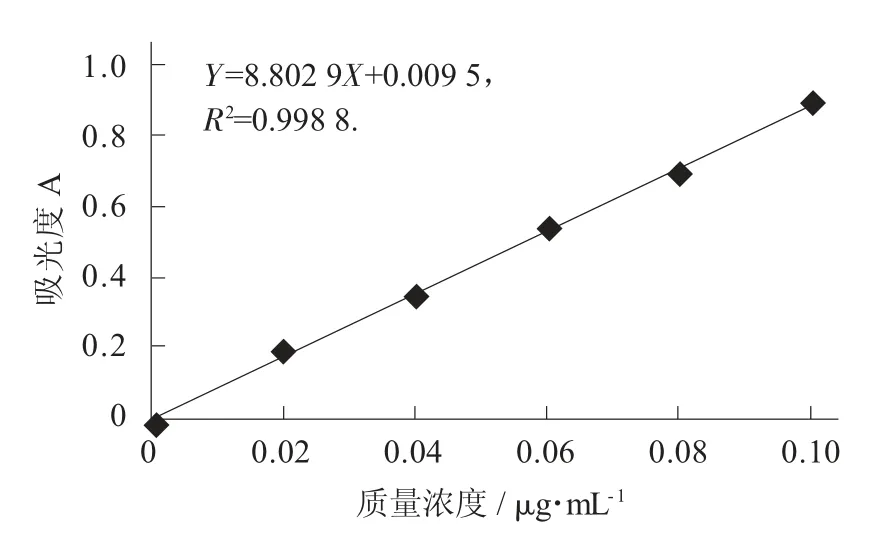
图1 葡萄糖标准曲线
由图1 可知,回归方程 Y=8.802 9X+0.009 5,R2=0.998 8,线性关系良好。
3.2 超声波提取法
3.2.1 单因素试验结果
(1)超声时间的影响。
不同超声时间对猴头菇多糖提取率的影响见图2。
由图2 可知,多糖提取率在时间逐渐增加的情况下先升高后降低,当超声时间为5~15 min 时,多糖提取率显著升高;在超声处理15 min 后,多糖提取率缓慢降低,这是由于超声波具有高的加速度,使有效成分快速被提取出来,多糖的提取率升高,当达到一定时间后,猴头菇提取液体系渗透压达到平衡,多糖得率也就趋于平稳。超声时间太长会破坏局部多糖的结构,使多糖含量减少,提取率降低,同时也造成能源浪费。通过分析可知,最佳超声时间为15 min,并选择超声时间10,15,20 min 进行正交试验。
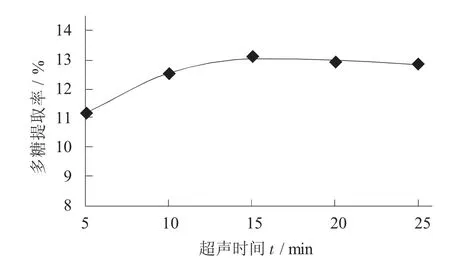
图2 不同超声时间对猴头菇多糖提取率的影响
(2)超声功率的影响。
不同超声功率对猴头菇多糖提取率的影响见图3。
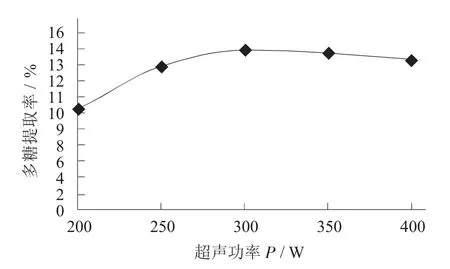
图3 不同超声功率对猴头菇多糖提取率的影响
由图3 可知,多糖提取率随着超声功率的增大先迅速提高后平缓降低,多糖提取率在超声功率为200~300 W 逐渐提高;当功率超过300 W 时,多糖提取率缓慢降低,这可能是因为超声功率逐渐提高,对细胞壁的破损程度逐渐增大,使多糖快速溶出,提取率升高,但超声功率太大可能造成反应容器内部部分温度急速升高,破坏猴头菇多糖的结构,使多糖提取率下降。通过以上分析可知,超声功率选择300 W 为宜,并选取超声功率250,300,350 W进行正交试验。
(3)料液比的影响。
不同料液比对猴头菇多糖提取率的影响见图4。
由图4 可知,多糖提取率因溶剂量逐渐增加先升高后降低,多糖提取率在料液比1∶10~1∶15 迅速提高;但在料液比1∶15 之后逐渐降低。这是由于多糖溶解已达到基本饱和,但继续添加溶剂会使多糖浓度降低,同时也造成能源浪费。通过以上分析可知,料液比选1∶15 为宜,并选择料液比1∶10,1∶15,1∶20 进行正交试验。
3.2.2 正交试验结果

图4 不同料液比对猴头菇多糖提取率的影响
采用L9(34)的正交水平表完成正交试验。
L9(34)正交试验结果与分析见表3。
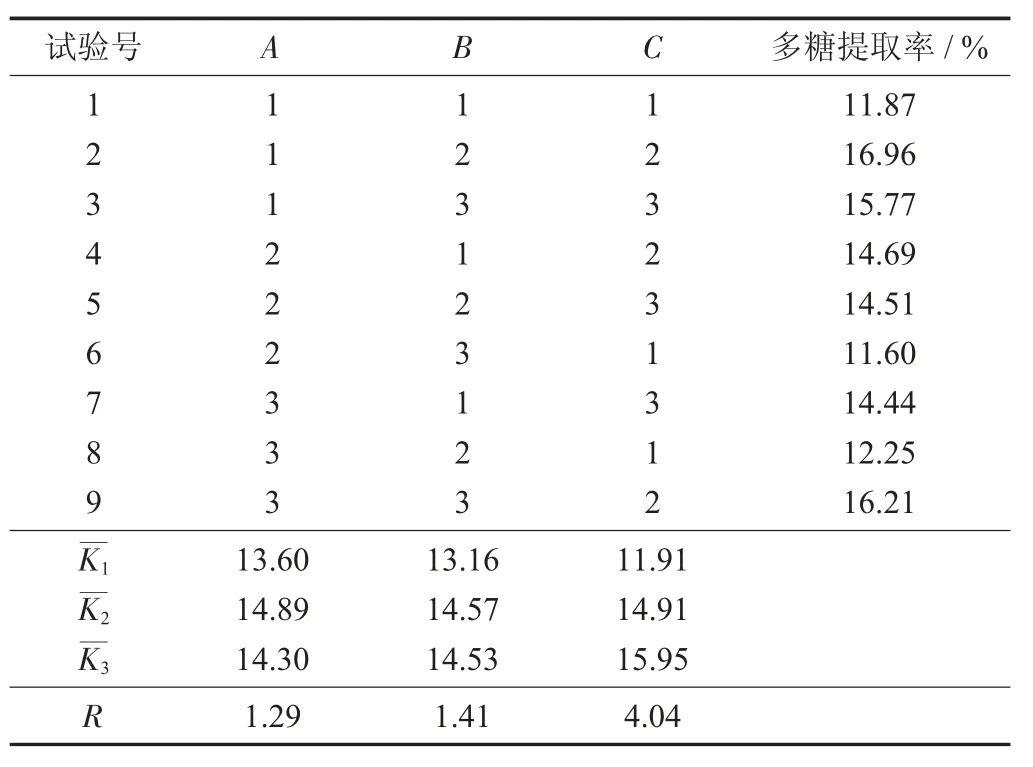
表3 L9(34)正交试验结果与分析
由表4 可知,各个因素水平都影响猴头菇多糖的提取率,通过比较极差R 值可知,影响多糖提取率的主要次序为料液比>超声功率>超声时间,同时表明猴头菇多糖提取率受料液比的影响最大,并得出超声波提取猴头菇多糖的最优方案组合为A2B2C3,即超声时间15 min,料液比1∶20,超声功率300 W,多糖提取率达到了最高为16.96%。
3.3 超声波协同复合酶提取多糖
3.3.1 单因素试验结果
(1)超声时间的影响。
不同超声时间对猴头菇多糖提取率的影响见图5。
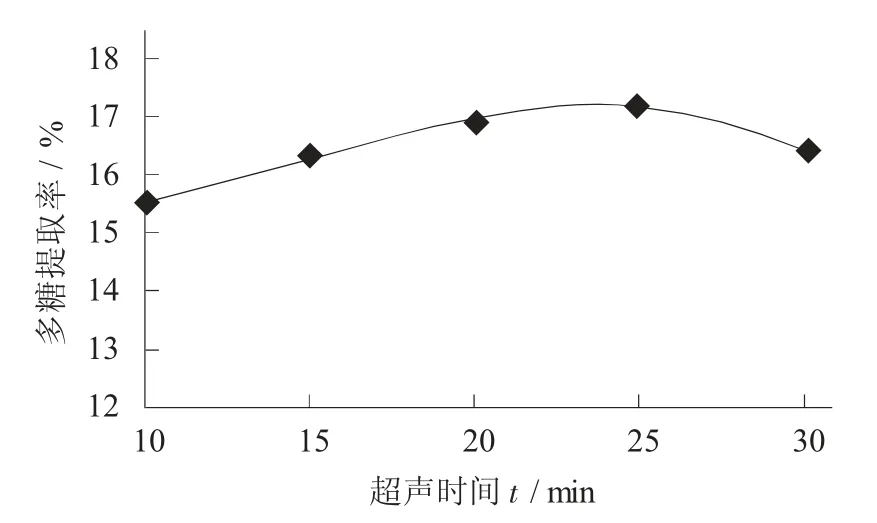
图5 不同超声时间对猴头菇多糖提取率的影响
由图5 可知,多糖提取率在时间逐渐延长的情况下,先升高后降低。当超声处理为10~20 min 时,多糖提取率显著升高;在超声处理20 min 后,多糖提取率缓慢上升;当超声时间大于25 min 时,多糖提取率逐渐降低,推测可能因为超声波不仅具有高的加速度,还存在剧烈的空化效应、搅拌影响等,使有效成分快速流入溶液,多糖的提取率升高,但超声时间太长会破坏局部多糖的结构,使多糖含量减少,提取率降低。通过分析可知,最佳超声时间为25 min,并选择超声波提取时间20,25,30 min进行正交试验。
(2)超声功率的影响。
不同超声功率对猴头菇多糖提取率的影响见图6。
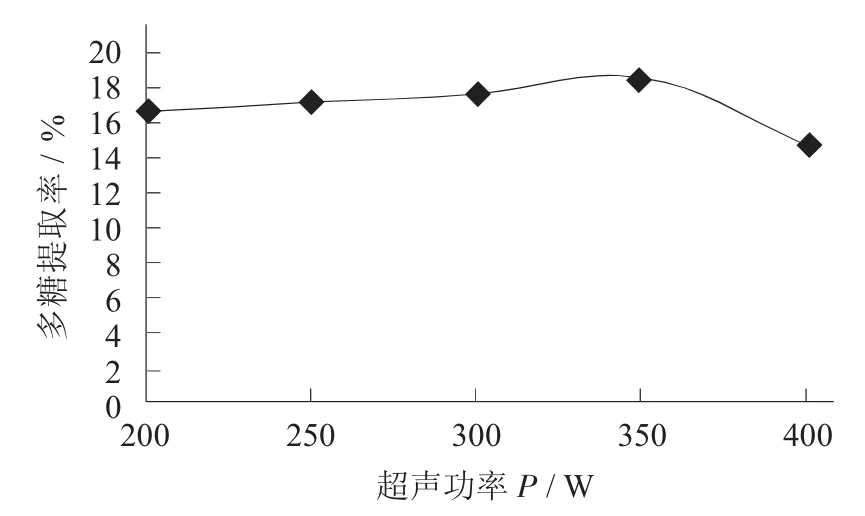
图6 不同超声功率对猴头菇多糖提取率的影响
由图6 可知,多糖提取率因为超声功率逐渐增大先缓慢升高后降低,多糖提取率在超声功率为200~350 W 逐渐提高,当超声功率大于350 W 时多糖提取率显著降低,这可能是因为超声功率逐渐增大,对细胞壁的破损程度逐渐提高,使多糖快速溶出,有利于多糖提取率的提高,也可能是超声功率产生的空化效应在一定程度上增强了复合酶的活力,促进酶法提取过程的进行,提高了多糖提取率,但超声功率太大可能造成反应容器内部部分温度急速升高,在短时间内破坏猴头菇多糖的结构,增加细胞膜和细胞壁通透性,使多糖提取率下降[19]。通过以上分析可知,超声功率选350 W 为宜,并选择超声功率300,350,400 W 进行正交试验。
(3)料液比的影响。
不同料液比对猴头菇多糖提取率的影响见图7。
由图7 可知,在溶剂量逐渐增大的条件下,多糖提取率先升高后降低,多糖提取率在料液比1∶15~1∶30 逐渐增大,但在料液比1∶30 之后多糖提取率降低。由此说明,料液比为1∶30 时可以充分提取多糖,此时多糖得率较高,但过高的料液比会对提取液的浓缩产生影响,从而使多糖得率降低,同时也造成能源浪费。通过以上分析可知,料液比选1∶30 为宜,并且选择料液比 1∶25,1∶30,1∶35 进行正交试验。

图7 不同料液比对猴头菇多糖提取率的影响
(4)复合酶添加量的影响。
不同复合酶添加量对猴头菇多糖提取率的影响见图8。

图8 不同复合酶添加量对猴头菇多糖提取率的影响
由图8 可知,多糖提取率在复合酶添加量逐渐增加的情况下先提高后降低,多糖提取率在复合酶添加量1%~2%时逐渐增大,但在酶添加量2%之后多糖提取率逐步降低,在一定条件下,酶添加量越高,酶解效果越强,但复合酶的添加量不能过高,高酶量作用太过强烈会破坏多糖结构,使多糖提取率降低,通过以上分析可知,复合酶添加量应选以猴头菇粉的2%为宜,并且选择复合酶添加量1.5%,2.0%,2.5%进行正交试验。
3.3.2 正交试验结果分析
采用L9(34)的正交水平表完成正交试验。
L9(34)正交试验结果与分析见表4。
由表4 可知,各因素水平对猴头菇多糖的提取率存在相应的影响,通过比较极差R' 值可知,影响猴头菇多糖提取率的主要次序为超声功率>料液比>超声时间>复合酶添加量,说明影响多糖提取率最大的因素是超声功率,从而得出超声波协同复合酶提取猴头菇多糖的最优方案组合为A'2B'2C'1D'3,即超声时间25 min,料液比1∶30,超声功率300 W,复合酶添加量2.5%,在此条件下多糖提取率达到了最高为19.44%。
4 结论
通过单因素试验和正交试验,得出在猴头菇粗多糖的提取中,超声波协同复合酶提取方法的最优工艺条件为超声时间25 min,料液比1∶30,超声功率300 W,复合酶添加量2.5%,此条件下猴头菇多糖提取率达到最高值19.44%。
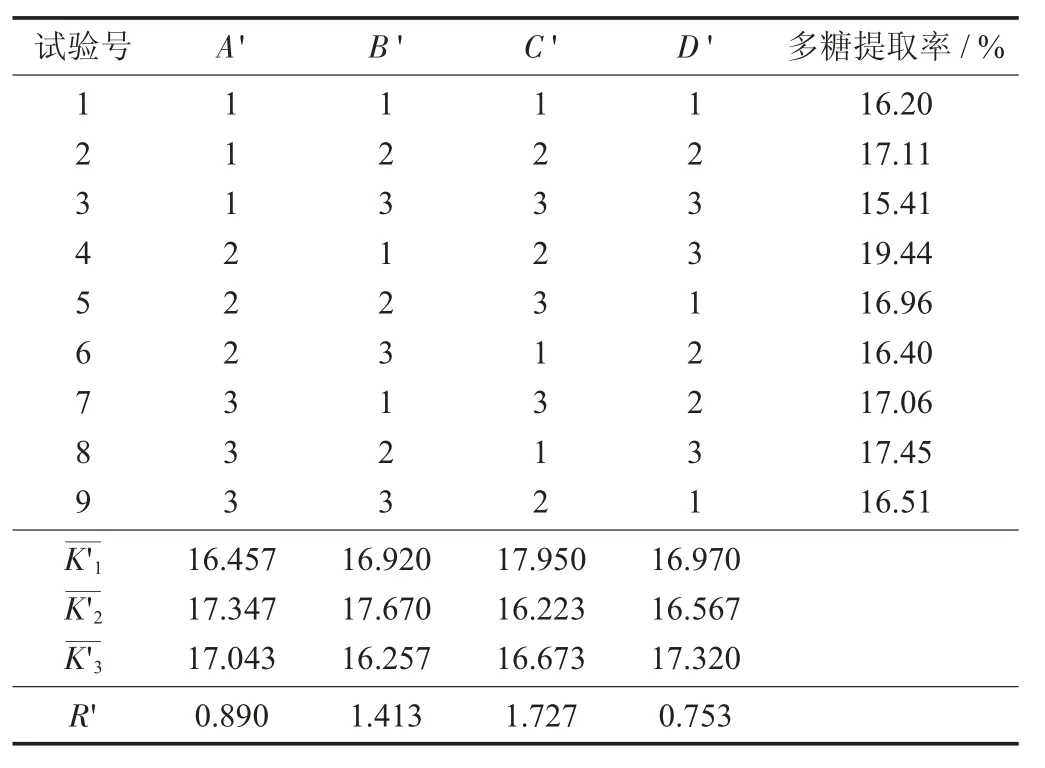
表4 L9(34)正交试验结果与分析
