活性污泥菌胶团/生物絮团形成菌的分离鉴定及基因组分析
2020-06-12刘亚琦刘双元戴景程邱东茹
刘亚琦 刘双元, 高 娜, 戴景程, 邱东茹,
(1. 大连海洋大学水产与生命学院, 大连 116023; 2. 中国科学院水生生物研究所, 武汉 430072;3. 中国科学院大学, 北京 100049)
收稿日期:2019-10-22;修订日期:2020-03-14
基金项目:中国科学院先导项目“美丽中国”子课题(XDA23040401); 中国科学院重点部署项目(KFZD-SW-219-3-2)资助 [Supported by Strategic Priority Research Program of CAS (XDA23040401); Key Research Program of the Chinese Academy of Sciences Grant(KFZD-SW-219-3-2)]
作者简介:刘亚琦(1995—), 女, 硕士研究生; 主要从事分子微生物学与生物技术研究。E-mail: liuyaqi@ihb.ac.cn
通信作者:邱东茹(1968—), 男, 研究员; 博士生导师; 主要从事分子微生物学与生物技术研究。E-mail: qiu@ihb.ac.cn
doi:10.7541/2020.080
活性污泥技术距今约有百年历史, 广泛应用于市政污水和工业废水处理。活性污泥法主要是通过曝气促进微生物的代谢及生长, 活性污泥可通过重力作用实现泥水分离, 加之污泥回流以维持曝气池中微生物的浓度, 即所谓的活性污泥法三要素[1]。活性污泥微生物菌胶团的形成有利于污泥的沉降和回用, 是该技术成败的关键, 微生物所分泌的胶质状由胞外多糖、蛋白质和核酸等生物大分子物质组成的胞外多聚物(简称EPS)是菌胶团形成的基础[1,2]。
在活性污泥微生物菌群中, 动胶菌属(Zoogloea)是活性污泥中的优势菌群, 是菌胶团形成的代表性微生物, 本实验室已对其菌胶团形成机制进行了相关的研究报道[3—7]。本次从云南省泸西县污水处理厂水样中分离到一株伪杜擀氏菌, 编号YN12, 发现该菌株能够形成稳定的菌胶团。
迄今为止, 伪杜擀氏菌属仅有3个已知物种且均从不同生境中分离。李文均等[8]从森林土壤中分离的紫黑伪杜擀氏菌(Pseudoduganella violaceinigra)YIM 31327T是该属的模式种, 因该菌与杜擀氏菌(Duganella zoogloeoides)IAM 12670T具有较近的亲缘关系, 故发现之初被分类定名为紫黑杜擀氏菌(D. violaceinigra)。2012年, 该菌被重新分类、定义为新属伪杜擀氏菌属(Pseudoduganella)[9]。随后,从斑马鱼体内和泻湖沉积物中分别分离到呈米黄色的斑马鱼伪杜擀氏菌(P. danionis)E3/2T[10]和象牙白伪杜擀氏菌(P. eburnean)10R5-21T[11]。本次分离的伪杜擀氏菌YN12株经16S rDNA序列分析鉴定与P. eburnean10R5-21T具有较高的同源性, 通过基因组测序、组装和注释, 发现该菌具有与喜树脂动胶菌(Z. ramigera)MMB株、解叔丁醇水居菌(Aquincola tertiaricarbonis)RN12株以及解壳聚糖松江菌(Mitsuaria chitosanitabida)XHY-A6株相似的菌胶团形成相关基因及基因簇[2,6,7,12]。我们还从中国科学院水生生物研究所石首养殖池塘中和安徽阜阳六里河中分离到同种菌株, 也能形成稳定的生物絮团, 说明该菌分布广泛, 加之所能利用的碳源比较多且基因组中含有氮代谢相关基因, 这种细菌可能适合用于以色列学者Avnimelech提出的生物絮团技术(Biofloc Technology)中, 用来调控生物絮团的微生物群落组成, 降低养殖水体中的氨氮含量,以净化养殖水质、达到养殖动物最佳健康状态[13—15]。
1 材料与方法
1.1 菌胶团/生物絮团形成菌的分离纯化
将从云南省泸西县污水处理厂采集的污泥样品和水样充分混匀, 用R2A液体培养基进行10-3—10-6倍梯度稀释(每个梯度3个重复), 将稀释液均匀涂布到R2A固体培养基上, 放入28℃培养箱中培养24—36h。从平板上挑取不同颜色、形态的菌落接种至R2A液体培养基中, 振荡培养(28℃, 220 r/min),筛选菌胶团形成稳定的菌株并进行多次分离纯化,以获得纯培养物。挑取纯培养物的单克隆摇菌, 用40%甘油按体积比1∶1保存菌种, 于-80℃冷冻保藏备用。
1.2 菌株的分子鉴定
以细菌基因组为模板, 利用16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA片段。PCR反应条件为: 95℃预变性5min;95℃变性30s, 55℃退火45s, 72℃延伸1min, 30个循环; 72℃延伸10min; 16℃保温。
扩增产物经纯化后与pMD18-T载体连接, 并通过热激转化的方法转入到大肠杆菌(Escherichia coli)DH5α感受态细胞中, 经37℃复苏后涂布到含氨苄青霉素的LB固体板上置于37℃培养箱培养。用引物M13(-47) 5′-CGCCAGGGTTTTCCCAGT CACG-AC-3′, M13(-48) 5′-GAGCGGATAACAATTT CACACAGG-3′对阳性克隆进行菌落PCR扩增检测, 选取扩增片段大小正确的克隆送至测序公司完成测序。测序结果在GenBank上进行BLAST比对,获得亲缘关系相近菌株的16S rDNA序列, 利用MEGA X软件, 通过邻接法(Neighbor-Joining method)构建系统发育树。
1.3 菌株YN12基于BioLog GEN III微孔板鉴定的碳源利用
将筛选获得的菌胶团形成稳定的菌株YN12在R2A固体板上划线, 28℃培养箱培养1—2d, 用无菌棉签挑取少量菌落接种于BioLog GEN III专用接种液IF-A中, 制备为均一菌悬液。先将菌悬液浓度调整至90%—98%T, 然后倒入V型加样水槽中, 再用8道移液器按每孔100 μL的量将菌悬液按顺序加入GEN III微孔板的所有孔中, 放入28℃培养箱中培养36h, 用Omni Log读数仪读取数据。
1.4 基因组测序拼接及注释
用苯酚抽提法提取基因组, 经NanoDrop8000超微量紫外分光光度计及1%琼脂糖凝胶电泳进行浓度及质量测定, 待检测合格后, 送至公司进行二代全基因组测序, 测序结果利用本实验室已有的SPAdes基因组拼接工具对测序结果进行组装, 并通过RAST (Rapid Annotation using Subsystems Technology)基因组自动注释服务器进行注释。
2 结果
2.1 菌胶团形成菌表型的筛选
我们从云南省泸西县污水处理厂采集的活性污泥样品及水样中分离并纯化到一株菌胶团形成菌YN12(图1)。经16S rDNA序列分析鉴定为伪杜擀氏菌属细菌。与从云南森林土壤中分离的紫黑伪杜擀氏菌不同的是, YN12并不产色素, 液体培养基中形成的菌胶团和固体培养基上形成的菌落都呈白色, 与从泻湖沉积物中分离的象牙白伪杜擀氏菌在颜色及16S rDNA序列同源性上都更为接近,故将菌株YN12鉴定为Pseudoduganella eburnea。
2.2 菌株YN12基于16S rDNA序列的系统发育进化树分析
将16S rDNA序列的测序结果在BLAST上进行比对发现, 菌株YN12与P. eburnean10R5-21T和P.violaceinigraYIM 31327T的相似度分别为98.8%和98.5%。将亲缘关系相近菌株的16S rDNA序列在MEGA X软件中通过邻接法(NJ法)进行比对时发现(图2), 在同属菌株中, 菌株YN12与伪杜擀氏菌YIM 31327T株和10R5-21T株亲缘关系更近, 与P.danionisE3/2T在序列及颜色上都有差异, 亲缘关系相对较远。伪杜擀氏菌属与杜擀氏菌属(Duganella)和马赛氏菌属(Massilia)同属于伯克霍德氏菌目(Burkholderiales)草酸杆菌科(Oxalobacteraceae), 三者之间存在较近的亲缘关系, 与红环菌目(Rhodocyclales)的动胶菌属亲缘关系相对较远。
2.3 象牙白伪杜擀氏菌YN12基因组的组装与注释
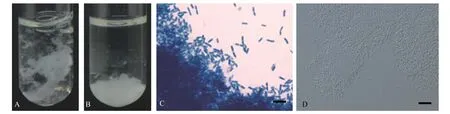
图1 Pseudoduganella eburnea YN12菌胶团形成表型及显微镜图Fig. 1 Floc-forming phenotype and microscopical observation of P. eburnea YN12 strain

图2 Pseudoduganella eburnea YN12及近缘细菌基于16S rDNA序列的系统发育进化树Fig. 2 Phylogenetic tree based on 16S rDNA sequences of Pseudoduganella eburnea YN12 and closely related strains
采用苯酚氯仿抽提法提取P. eburneaYN12基因组, 送至公司进行全基因组测序。利用RAST自动注释服务器注释后显示(表1), 菌株YN12基因组的大小约为5933582 bp, G+C含量为63.9%, 与P.eburnea10R5-21T株相接近, 含有104个RNA, 包含5313个蛋白质编码序列, 其编码的蛋白按照功能可分为以下几类(图3): 辅因子、维生素、辅基和色素相关(278个基因, 占5.23%), 细胞壁和荚膜形成相关(126, 2.37%), 毒素、感染和防护相关(122, 2.30%),钾离子代谢相关(16, 0.30%), 多种功能相关(43, 0.81%),噬菌体、前噬菌体、转座因子和质粒相关(1,0.02%), 膜转运相关(296, 5.57%), 铁离子摄取与代谢类相关(59, 1.11%), RNA代谢相关(184, 3.46%),核苷与核苷酸相关(116, 2.18%), 蛋白质代谢相关(300, 5.65%), 细胞分裂周期相关(37, 0.70%), 运动性和趋化性相关(227, 4.27%), 细胞调控和信号转导相关(49, 0.92%), 次级代谢相关(8, 0.15%), DNA代谢相关(113, 2.13%), 脂肪酸、脂肪和类异戊二烯相关(135, 2.54%), 氮代谢相关(49, 0.92%), 休眠和孢子形成相关(4, 0.08%), 呼吸作用相关(131, 2.47%),应激反应相关(194, 3.65%), 芳香化合物代谢相关(24, 0.45%), 氨基酸及其衍生物相关(436, 8.21%),硫代谢相关(33, 0.62%), 磷代谢相关(48, 0.90%), 碳水化合物相关(323, 6.08%), 功能未知(1961,36.91%)。

表1 基因组信息统计Tab. 1 Genomic information statistics
2.4 菌株YN12基于基因组分析的胞外多聚物合成相关基因簇及相关基因编码产物间的比对
象牙白伪杜擀氏菌YN12基因组中存在与喜树脂动胶菌MMB[6,7]、解叔丁醇水居菌RN12[12]及解壳聚糖松江菌XHY-A6[2]相似的胞外多糖生物合成途径、PrsK-PrsR双组分系统和PEP-CTERM胞外蛋白家族, 共同介导和调控了菌胶团的形成。与后者相比, 菌株YN12的胞外多糖与蛋白质合成相关基因分布更为集中, 主要分布在大小约为72 kb的大型基因簇上, 包含已报道的天冬酰胺合成酶基因asnB和asnH、多个糖基转移酶基因、葡萄糖醛酸表型异构基因uge, 双组分系统相关基因prsR-prsK, 糖基转移酶基因epsB2等与菌胶团形成相关的基因。

图3 Pseudoduganella eburnea YN12胞外多聚物形成相关基因簇Fig. 3 The extracellular polymeric substances biosynthesis gene cluster of P. eburnea YN12
与菌株MMB胞外多聚物相关基因簇相比,YN12中含有两个prsT相关基因, 且两个相关基因与MMB中同源基因编码产物的相似度均为33%(表2)。多糖脱乙酰酶(Polysaccharide deacetylase)、荚膜合成蛋白CapK、天冬酰胺合成酶AsnH、多糖输出蛋白Wza、转录调节因子PrsR以及尿苷二磷酸葡萄糖脱氢酶Ugd等直系同源基因表达产物的相似度均在50%左右, 序列相对较保守。这些结果说明虽然这两个菌株分属Beta变形菌纲的两个不同的目, 但是胞外多糖、胞外多聚物和菌胶团/生物絮团形成的分子机制非常相似。
2.5 菌株YN12与其他菌胶团形成菌的碳源利用比较及比较基因组学分析
细菌通常可以利用多种碳源, 包括有机污染物,是细菌净化水质的重要基础。BioLog自动微生物鉴定系统可以从侧面提供细菌代谢生理比较分析和亲缘关系鉴定的依据。将P. eburneaYN12微孔板的鉴定结果与已知的杜擀氏菌进行比对, 在碳源利用方面(表1), 菌株YN12与P. violaceinigraYIM 31327T和P. eburnean10R5-21T都可以利用葡萄糖、麦芽糖、纤维二糖、蔗糖、N-乙酰基葡萄糖胺等作为唯一碳源, 也可以利用组氨酸、丝氨酸等氨基酸,但都不能利用岩藻糖、鼠李糖、山梨醇及柠檬酸。
通过对P. eburneaYN12基因组分析发现, 该菌拥有完整的三羧酸循环和乙醛酸支路、磷酸戊糖途径(pentose phosphate pathway)和微生物特有的Entner-Doudoroff途径。还拥有乳糖、果糖、甘露糖和蔗糖的吸收和降解相关基因, 与BioLog分析结果相吻合。
将P. eburneaYN12的基因组与用同种方法注释的P. violaceinigraYIM 31327T基因组进行比对后发现, 菌株YN12基因组中含有N-乙酰D-氨基葡萄糖运输系统, 半乳糖、N-乙酰D-氨基半乳糖、甘露糖、D-半乳糖酸、D-葡萄糖酸、D-甘油、聚羟基丁酸酯、甘油脂和甘油磷脂等分解代谢相关基因,具有谷氨酸转运系统渗透酶蛋白GltI、GltK、GltJ和脯氨酸代谢相关蛋白的编码序列。在碳源利用方面, 菌株YN12能利用的碳源更为丰富。
与菌株MMB相比, YN12基因组中含有脯氨酸、4-羟脯氨酸、组氨酸、赖氨酸降解相关基因,甲壳素、N-乙酰氨基葡萄糖、N-乙酰半乳糖胺、半乳糖胺、D-半乳糖酸、D-葡萄糖酸、甘油、半乳糖、蔗糖等分解代谢相关基因, 拥有谷胱甘肽的生物合成和谷氨酰胺循环相关基因。而MMB基因组中含有的乳酸、尿素、苯甲酸分解基因, 辅酶B12、氰钴胺素合成相关基因, 铬酸盐抗性蛋白ChrB、多重耐药蛋白MarC、汞转运蛋白MerT、蛋白质加工修饰的G3E蛋白家族、CRISPR相关蛋白的编码序列, 具有维生素B6降解途径, 4-羟基苯乙酸分解代谢途径, 酮己二酸途径的儿茶酚分支等。相对而言, 菌株YN12在多糖利用方面较菌株MMB更为丰富, 可以利用淀粉(糊精)、几丁质及果胶等植物来源的大分子物质。而后者对脂肪酸和酯的利用能力较强, 与BioLog分析结果相符合。

表2 Pseudoduganella eburnea YN12与喜树脂动胶菌MMB中EPS合成相关基因簇表达产物的序列相似性Tab. 2 The gene products of the extracellular polymeric substances (EPS) biosynthesis gene cluster of Pseudoduganella eburnea YN12 strain and the predicted orthologues in the closely related proteobacterial genomes (the polypeptide sequence identity was shown)
2.6 不同水体中伪杜擀氏菌属细菌的筛选
我们从安徽省阜阳市六里河和中国科学院水生生物研究所石首养殖基地水样中分离到伪杜擀氏菌属菌株F1和SS14, 16S rDNA序列鉴定分析结果显示, 与P. eburnean10R5-21T相似度分别为99.4%和99.6%。平板培养的菌落及液体培养中形成的菌胶团均为白色(图4)。与菌株YN12相同, 三者在R2A液体培养基中均能形成稳定的菌胶团(生物絮团)。
生物絮团技术是近年来水产养殖中用以调控水质的新型养殖模式, 但难以控制生物絮团中群落组成是目前存在的问题[16]。喜树脂动胶菌MMB株分离于活性污泥中, 不能利用葡萄糖及多种单糖、淀粉和纤维素。与之相比, 象牙白伪杜擀氏菌不仅分布范围更为广泛, 我们从云南泸西、湖北石首和安徽阜阳均分离到该种生物絮团形成菌, 且利用的碳水化合物种类较前者更为丰富(表3), 在养殖水体中, 可以更好的吸收利用生物絮团技术中常用的淀粉等碳源, 更有利于其存活和促进生物絮团的形成。

图4 从不同水体中分离纯化的象牙白伪杜擀氏菌菌胶团形成表型及显微镜图Fig. 4 Floc-forming phenotype and microscopic observation of the Pseudoduganella eburnean strains isolated from different water bodies
3 讨论
我们从云南省泸西县污水处理厂的活性污泥水样中分离到一株菌胶团形成菌YN12, 经16S rDNA序列分析鉴定与P. eburnean10R5-21T株亲缘关系最近。通过全基因组测序发现, 菌株YN12的基因组大小约为5934 kb, G+C含量为63.9%, 包含5313个编码序列, 含有与喜树脂动胶菌MMB株、解叔丁醇水居菌RN12株及解壳聚糖松江菌XHYA6株等菌胶团(生物絮团)形成菌相似的胞外聚合物合成相关基因簇。
近年来, 在水产养殖中用以调控水质的新型养殖模式生物絮团技术主要通过添加不同碳源调控水体中的碳氮比, 而施用生物絮团形成菌或丝状菌直接调控生物絮团的微生物组成和结构相关研究鲜少报道。该技术目前存在着难以控制生物絮团中菌群组成的问题[16]。为解决这一问题, 中国科学院水生生物研究所研究人员将我们所分离的活性污泥菌胶团形成菌喜树脂动胶菌MMB株接种到鱼类养殖试验池中, 结果发现该菌未能在养殖池中大量繁殖[17]。我们认为很可能是所添加的碳源不能被该菌吸收利用进行生长的缘故。
菌株YN12相比于喜树脂动胶菌MMB和解叔丁醇水居菌RN12, 所能吸收利用碳源特别是单糖、二糖和多糖更为丰富多样(表1), 除了淀粉(糊精)以外, 该菌可以利用纤维二糖、龙胆二糖、蔗糖、甘露糖、半乳糖、几丁质(壳聚糖)单体N-乙酰-D-葡萄糖胺、N-乙酰-D-半乳糖胺等作为唯一碳源, 还可以利用果胶等植物来源的大分子多糖。此外, 从菌株YN12基因组注释结果中发现, 该菌拥有铵转运体(Ammonium transporter)和谷氨酸和谷酰胺合成酶(Glutamate synthetase and glutamine synthetase)基因, 说明该菌可以吸收利用养殖水体中高浓度的铵离子并用来合成氨基酸和蛋白质, 进而形成生物絮团被鱼类滤食、消化和吸收利用。同时, 我们从石首水产养殖水体和阜阳河流中也分离到象牙白伪杜擀氏菌SS14和F1菌株。因此菌株YN12及其同种近缘菌株可能更适合应用于改善养殖水质的生物絮团技术中, 可以加以利用来直接调控、促进生物絮团中菌群的组成, 提高资源循环利用和水质净化功能, 促进绿色养殖。
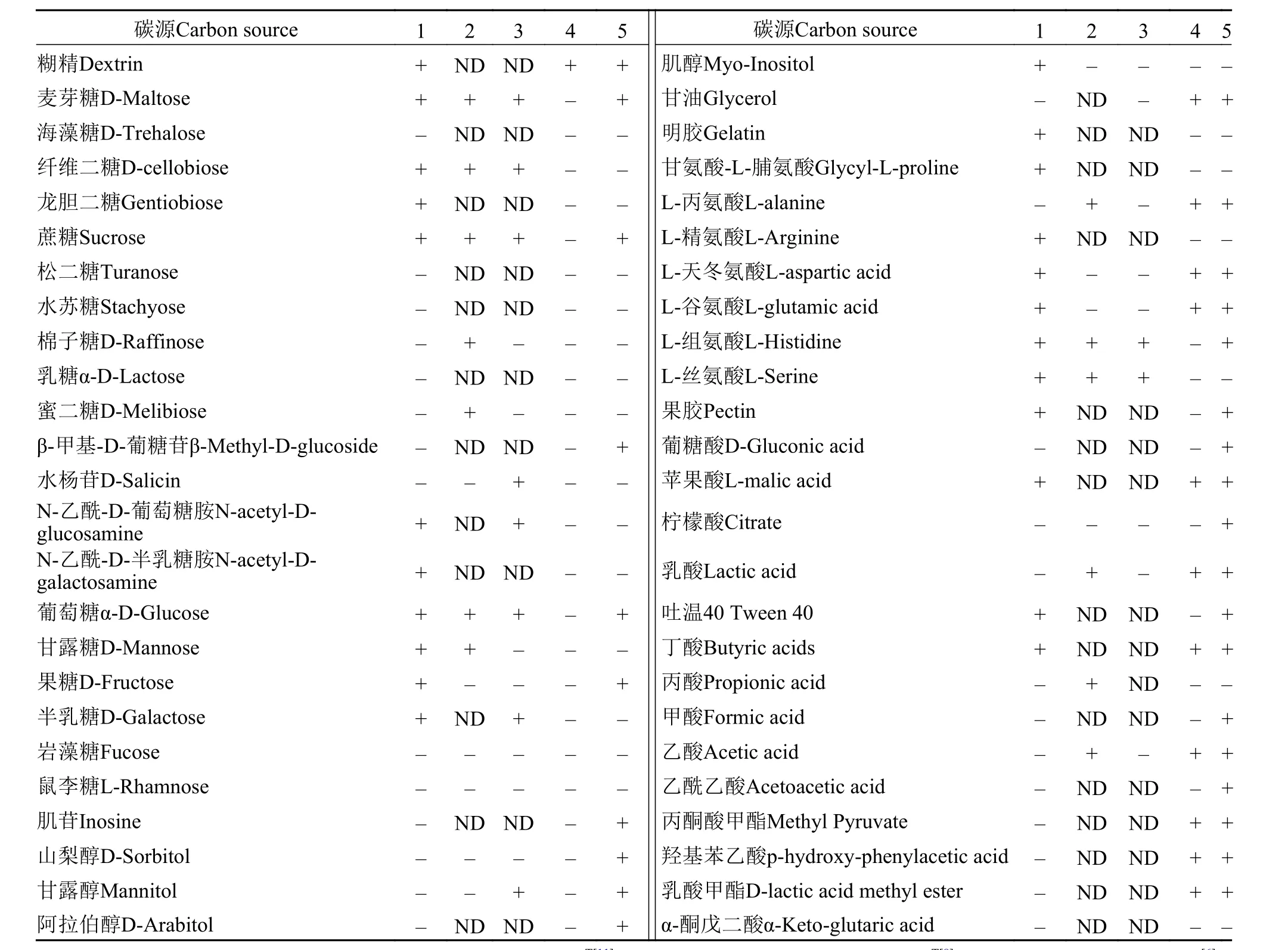
表3 Pseudoduganella eburnea YN12基于BioLog结果的碳源利用Tab. 3 Utilization of carbon source based on BioLog results of Pseudoduganella eburnea YN12
