溶藻细菌筛选及溶藻活性物质对铜绿微囊藻生理活性的影响
2020-06-12陈莉婷宋立荣甘南琴
陈莉婷 左 俊 宋立荣 刘 津 甘南琴
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
淡水水体富营养化问题日益加剧, 大范围、高生物量、高危害特征的蓝藻水华频繁暴发。这不仅会破坏水体生态系统的结构和功能, 制约湖泊水资源的可利用性, 危害人类及动植物的健康生存, 也会影响社会经济的可持续发展。研究和发展控藻抑藻关键技术, 对于湖泊水环境的健康发展和水资源的可持续利用具有重要的理论和现实意义。与常规的物理法、化学法控藻技术相比,利用微生物控藻具有经济、特异、安全的优势,是一种颇具应用前景的修复、净化富营养化水体的方法, 引起了越来越多研究者的关注[1]。纵观国内外的研究, 微生物控藻法中报道最多的是利用溶藻细菌控制蓝藻水华。这些溶藻细菌多为革兰氏阴性菌, 一般分离自发生水华或赤潮的海洋、湖泊及水库, 少数分离自土壤, 适合在水华发生初期投入使用, 短期内即可抑制藻类生长, 缓解甚至消除水华[2]。
溶藻细菌的胁迫能够影响藻细胞内的一系列生理过程, 比如阻碍电子传递降低藻细胞光合系统活性、抑制叶绿素a等色素合成或一系列与光合作用相关基因的表达、产生氧化损伤引起藻细胞膜脂过氧化和抗氧化酶失活、阻碍胞内蛋白质和碳水化合物合成、扰乱胞内正常的离子代谢、破坏细胞结构引起细胞基质外溢等[3—6]。
溶藻细菌筛选的常用方法为将已纯化菌株的固体斜面纯培养物或液体培养基中的纯培养物接种到藻液中[7,8], 通过观察藻液的黄化确定其是否为溶藻菌。菌株的纯化和培养通常使用的培养基为Luria-Bertani(LB)培养基, 但大多数研究未关注LB培养基自身的抑藻作用及其在溶藻细菌筛选过程中的影响[9—11]。
本研究指出了使用细菌的LB液体纯培养物筛选溶藻菌时存在风险和弊端, 并对筛选所得溶藻细菌的溶藻方式及溶藻活性物质对铜绿微囊藻生理活性的影响进行了初步探究。一方面为溶藻细菌筛选方法的选择提供参考, 另一方面为修复、净化富营养化水体的研究提供理论基础。
1 材料与方法
1.1 藻种及培养
本实验所用藻种为铜绿微囊藻(Microcystis aeruginosa)PCC7806, 由中国科学院水生生物研究所淡水藻种库(FACHB)提供。藻株所用培养基为BG-11[12], pH为7.1—7.2。培养温度为(25±1)℃, 光照为25 μmol/(m2·s), 实验光源为冷光源(Philip), 光暗周期比为12h∶12h。藻细胞培养至对数生长期后用于实验。
1.2 菌种分离与纯化
从太湖竺山湾(31.45° N, 120.03° E)、梅梁湾(31.41° N, 120.19° E)采集蓝藻水华水样, 经0.8 μm的滤膜(Millipore)过滤, 滤液用无菌水稀释至不同梯度后涂平板, 再反复平板划线分离纯化菌株。细菌培养基为LB: NaCl 10.0 g、蛋白胨10.0 g、酵母提取物5.0 g、蒸馏水1000 mL, pH约为7.5。培养温度为30℃, 转速为140 r/min。配制固体培养基时需加入1.5%(m/v)的琼脂粉。
1.3 溶藻细菌的筛选及鉴定
LB液体纯培养物感染藻细胞挑取单克隆接种于LB液体培养基, 培养48h后, 以10%的体积比将细菌培养物添加到藻液中, 另设一个加入等体积LB液体培养基的LB组, 空白对照组(CK组)藻液中加入等体积的无菌水。每2天取样测定藻液的叶绿素a(Chlorophylla, Chl.a)浓度。
LB固体斜面纯培养物感染藻细胞挑取单克隆接种于LB固体斜面, 待细菌菌落长出, 用无菌水冲涮, 吹打均匀制成菌苔洗脱液, 最后用无菌水调配细胞密度至5×108cells/mL左右。以10%的体积比添加菌苔洗脱液到藻液中, 空白对照组(CK组)藻液中加入等体积的无菌水。每2天取样测定藻液的叶绿素a浓度。
鉴定将溶藻菌的PCR产物送往公司测序,所测得的16S rDNA序列经校对后, 在美国国立生物技术信息中心(NCBI)的GenBank数据库中用局部相似性基本查询工具(BLAST)进行核苷酸序列同源性比较。利用MEGA6.0软件, 采用邻接法(Neighbor-joining, 重复度F1000)构建系统发育树,对筛选出的溶藻细菌进行种属鉴定[11]。
1.4 LB培养基主要成分抑藻试验
配制与LB液体培养基中等浓度的酵母提取物溶液、蛋白胨溶液、NaCl溶液, 以10%的体积比分别添加至藻液中, 空白对照组(CK组)加入等体积的无菌水, 于12孔板中培养。每天摇匀3次, 一周后观察各孔中藻液的生长状况。
将酵母提取物溶液以10%的体积比添加至藻液中, 空白对照组(CK组)加入等体积的无菌水, 于三角瓶中培养, 测定实验过程中藻液的生物量变化。生物量以藻液在680 nm处的吸光值(OD680)来表示。
1.5 溶藻方式探究
分别将菌株THW7的无菌滤液、菌体重悬液、原始菌液以10%的体积比加入藻液中, 一周后取样测定叶绿素a的浓度, 分析各处理液的溶藻效果。
1.6 溶藻活性物质对铜绿微囊藻生理活性影响的试验
将菌株THW7的无菌滤液以5%的体积比加入藻液中, 对照组加入等体积无菌水, 于500 mL三角瓶中培养。每组设置3个平行, 每2天取样测定相关生理指标, 生理指标包括: OD680、叶绿素a浓度、Fv/Fm(最大光化学量子产量)、α(光能转化效率)、ETRm(最大电子传递速率)、MDA(丙二醛)含量及抗氧化酶活性。(1)紫外可见分光光度法[13]测定藻液的叶绿素a浓度和OD680值; (2)叶绿素荧光参数Fv/Fm、α、ETRm用Water-PAM测定; (3)MDA含量采用硫代巴比妥酸法测定[14]; (4)SOD(超氧化物歧化酶)活性采用核黄素-NBT(氯化硝基四氮唑蓝)光化还原氧化法测定[15], POD(过氧化物酶)活性采用愈创木酚法测定[4], CAT(过氧化氢酶)活性采用钼酸铵法测定[16], 粗酶液中可溶性蛋白含量利用南京建成生物工程研究所的蛋白测定试剂盒进行测定。
1.7 溶藻效果的评价
以叶绿素a的去除率表征溶藻效果, 公式如下:叶绿素a的去除率(%)=[(C0-C)/C0]×100)式中,C0为每组实验初始时的叶绿素a浓度(mg/L),C为每组实验测定时的叶绿素a浓度(mg/L)。
1.8 数据整理与统计分析
采用Excel 2013对实验数据进行整理, 利用SPSS 19.0进行数据分析。所有数据均采用单因素方差分析(One-way ANOVA)方法。图象绘制使用OriginPro 9.1。
2 结果
2.1 溶藻细菌的筛选及鉴定
本研究共分离、纯化出93株细菌, 经筛选鉴定共得到7株溶藻细菌, 这里仅以菌株THW4和THW7为例, 展示细菌筛选的不同结果。需指明的是研究中以LB固体斜面纯培养物感染藻细胞的结果作为确定溶藻菌的标准, 即LB固体斜面纯培养物添加至藻液后能引起叶绿素a浓度显著降低的菌株为溶藻细菌。
LB液体纯培养物和LB固体斜面纯培养物溶藻效果试验期间, 对照组微囊藻叶绿素a浓度持续升高; 各处理组的叶绿素a浓度降低(图1A), 均显著低于对照组(P<0.01)。菌株THW7的LB液体纯培养物加入藻液后, 藻液叶绿素a浓度持续下降, 第2、第4、第6天叶绿素a浓度显著低于其他各组(P<0.01)。第6天时叶绿素a浓度为0.326 mg/L, 仅为初始水平的28.07%, 溶藻效率为71.93%。LB组和菌株THW4的LB培养物组叶绿素a浓度在第2天时均有不同程度的升高, 2d后开始呈下降趋势, 其中LB组的下降速率显著高于菌株THW4培养物组的下降速率(P<0.01)。第6天时LB组的叶绿素a浓度为0.685 mg/L, 溶藻效率为41.04%; THW4培养物组的叶绿素a浓度0.891 mg/L, 溶藻效率为23.34%。
菌株THW4的斜面洗脱液加入藻液后, 叶绿素a浓度逐渐升高, 趋势与对照组相同; 菌株THW7的斜面洗脱液加入藻液后, 藻液明显黄化, 叶绿素a浓度逐渐下降(图1B), 显著低于对照组和菌株THW4斜面洗脱液组(P<0.01)。第6天时, 菌株THW7斜面洗脱液组的叶绿素a浓度降至0.162 mg/L, 仅为初始水平的15.23%, 溶藻效率为84.77%。
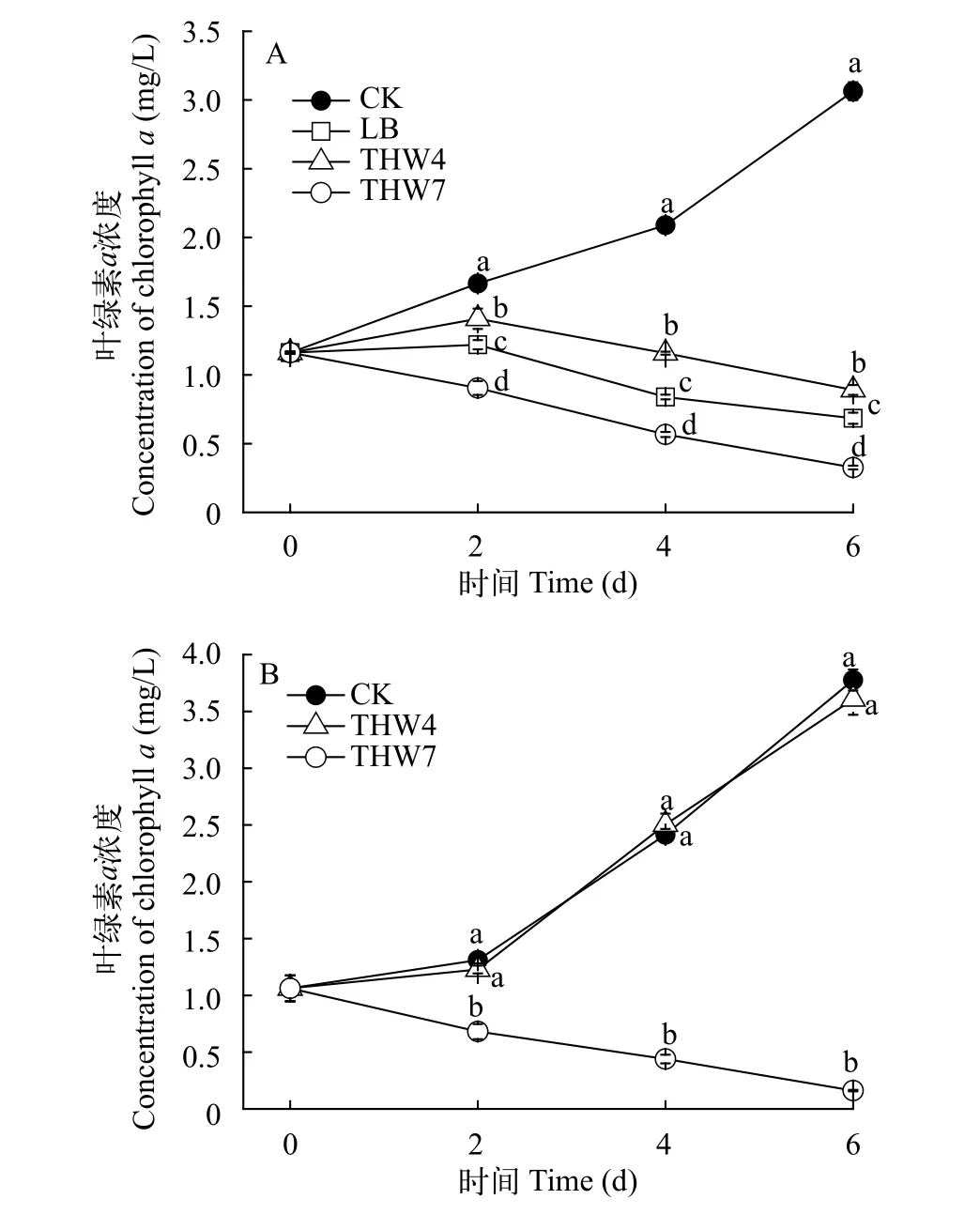
图1 两株细菌不同培养物的溶藻效果Fig. 1 Algae-lysing effects of different culture solution of two bacteria in LB liquid culture
溶藻细菌的鉴定形态观察和生理生化试验结果显示溶藻细菌THW7为G-菌, 短杆状, 接触酶阳性, 淀粉水解阴性, 能利用氨基酸和酯类, 菌落颜色为乳白色, 光滑、不透明、较湿润。利用16S rDNA序列进行比对分析, 构建系统发育树, 鉴定其为假单胞菌属(Pseudomonas), 与蒂氏假单胞菌Pseudomonas teessideatype strain PR65T(AM419154.2)的亲缘关系最近(图2), 16S rDNA基因的相似性为99.79%。目前未见关于蒂氏假单胞菌溶藻的报道。
2.2 LB培养基不同成分抑藻效果
添加蛋白胨溶液和NaCl溶液的两组藻液呈蓝绿色, 藻细胞生长状况良好; 添加LB液体培养基和酵母提取物的藻液呈白色, 说明藻细胞生长受到抑制甚至死亡(图3)。
酵母提取物溶液添加至三角瓶中藻液的试验结果显示对照组藻生长良好, OD680直线升高; 酵母提取物溶液组的藻从第2天开始迅速下降, 8d时OD680降至0.080(图4), 显著低于对照组(P<0.01)。
2.3 溶藻方式分析
试验初始的铜绿微囊藻叶绿素a浓度为1.162 mg/L。一周后, 对照组藻液生长状况良好; 原始菌液组、无菌滤液组的铜绿微囊藻生长受到明显抑制,藻液发黄甚至泛白, 叶绿素a浓度分别降至0.571和0.443 mg/L, 均显著低于对照组(P<0.01), 溶藻效率分别为50.84%和61.84%; 菌体重悬液对铜绿微囊藻的生长几乎没有起到抑制作用, 叶绿素a水平与对照组基本一致, 无显著性差异(图5)。
2.4 铜绿微囊藻的生理指标
生长情况试验初始的铜绿微囊藻OD680为0.254, 叶绿素a浓度为0.817 mg/L。对照组藻液生长状况良好, OD680和叶绿素a浓度逐渐升高; 处理组OD680和叶绿素a浓度的变化趋势相似, 逐渐下降(图6), 显著低于对照组(P<0.01)。第10天时, OD680降至0.041, 叶绿素a含量降至0.046 mg/L, 仅为初始水平的5.62%, 溶藻效率达94.38%。
光合系统活性试验期间对照组的铜绿微囊藻生长状况良好, 藻细胞的一系列叶绿素荧光参数Fv/Fm、α、ETRm一直保持较高水平; 而投加溶藻菌THW7无菌滤液的处理组,Fv/Fm、α、ETRm呈迅速下降的趋势(图7), 均显著低于对照组(P<0.01)。处理组的Fv/Fm在第6天降至0.032, 仅为初始值的9.94%, 第8天降为零。ETRm和α在试验初始约1h的样品处理时间内即开始降低, 第2天分别降低到试验初始值的21.81%、42.81%, 从第4天开始, 均降至检测限以下。
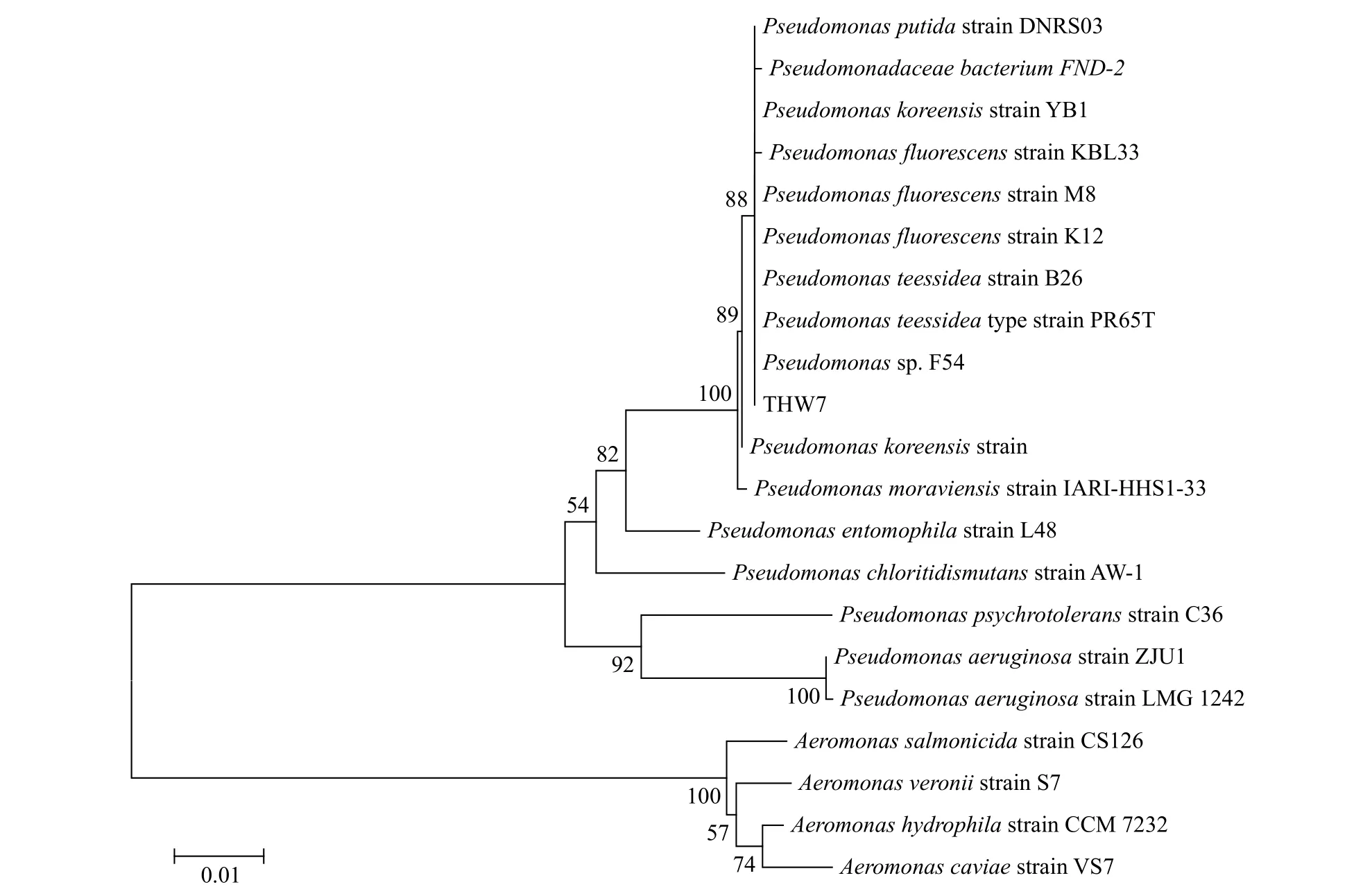
图2 溶藻细菌THW7系统发育树Fig. 2 The phylogenetic tree of the algalytic bacterium THW7
MDA含量及抗氧化酶活性对照组MDA含量始终维持在一个较低的水平; 处理组的MDA含量在第2天降至初始值的75.75%, 2d后迅速升高(图8)。第4天时处理组的MDA含量升高至初始值的1.62倍, 显著高于对照组的MDA含量(P<0.05); 第6和第8天, 其MDA含量分别升高至初始值的1.99倍、2.77倍, 均显著高于对照组(P<0.01)。
对照组酶活在一定范围内上下波动, 变化不大;处理组的SOD、POD、CAT活性呈现先升高后降低的趋势且一直高于对照组, 其中CAT活性变化最显著, 2d时即升至初始水平的9.47倍(图9)。处理第4天、第6天, SOD活性分别升高至初始水平的1.25倍、1.73倍, POD活性分别升高至初始水平的1.90倍、6.19倍, CAT活性分别升高至初始水平的为初始水平的7.76倍和11.85倍, 均显著高于对照组的相应酶活性(P<0.01)。处理第8天, SOD、POD活性虽大幅下降, 但仍高于对照组, 其中POD活性为初始水平的3.08倍。CAT活性在第8天未降低, 继续升高至初始水平的14.15倍, 显著高于对照组的CAT活性(P<0.01)。
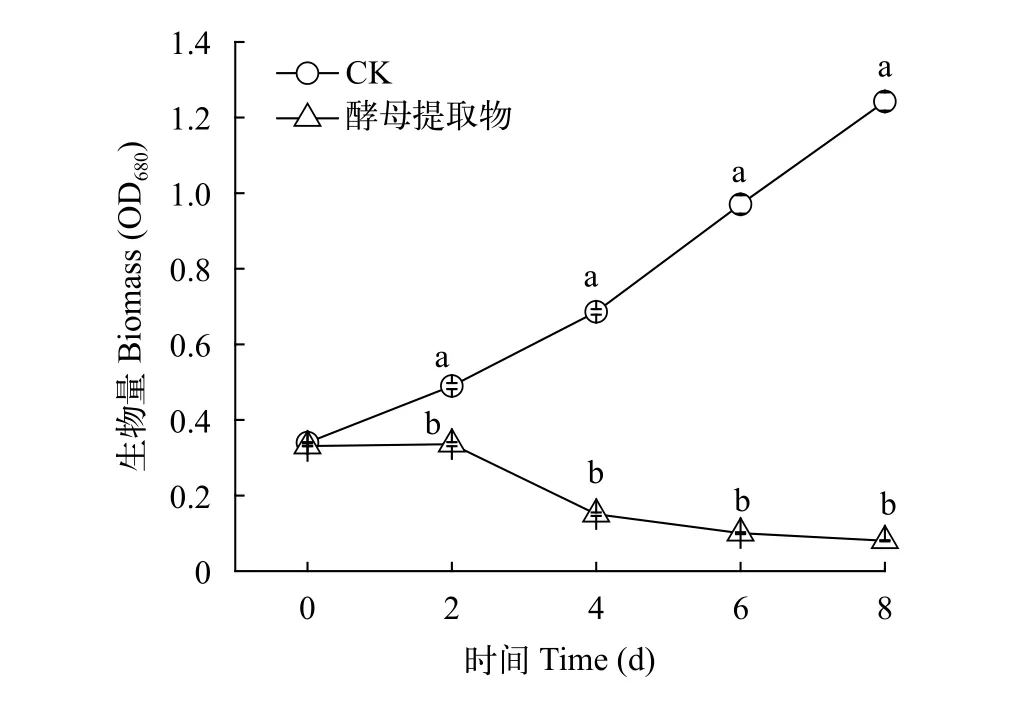
图4 酵母提取物对藻生长的影响Fig. 4 Effects of yeast extract on algae growth

图5 溶藻细菌THW7不同处理液的溶藻效果Fig. 5 The algicidal effect of different THW7 treatment solutions

图6 THW7的无菌滤液对铜绿微囊藻生长的影响Fig. 6 Effect of THW7 bacteria-free filtrate on the growth of Microcystis aeruginosa, as determined by the OD680
3 讨论
3.1 溶藻菌的筛选及溶藻方式的探究
LB培养基为常用的细菌培养基, 多用于溶藻细菌筛选过程中的菌株扩培。多数研究采用细菌的LB液体培养物感染藻液来筛选溶藻菌, 但很少注意到LB培养基本身所具有的溶藻作用[9,10]。本研究结果表明, LB培养基具有一定的溶藻作用, 其主要成分酵母提取物具有较高的溶藻效率。郑小平等[17]也发现添加培养基至藻液中导致叶绿素a浓度显著下降, 第7天由初始值1.650 mg/L降至0.865 mg/L, 但并未对其进行深入探究和解释。另有研究虽然将LB培养基添加至藻液中作为对照, 但未曾发现其抑藻、溶藻作用[11], 这可能与其试验中LB培养基添加的比例较低有关。为避免培养基在筛选溶藻菌的过程中造成干扰, 部分研究在筛选溶藻菌时将液体培养物离心后反复洗涤[18], 但这一方法往往只能筛选得到直接溶藻的溶藻菌, 多数间接溶藻的细菌易被筛掉。因此采用LB液体纯培养物感染藻液筛选溶藻菌存在较大的假阳性或漏筛风险。
筛选溶藻菌的另一种方式为将固体斜面培养基上形成的菌苔收集后感染藻液, 通过藻细胞的生长情况来确定菌株是否具有溶藻作用[9]。本研究中将两株细菌THW4和THW7的LB固体斜面纯培养物接种到藻液中, 结果发现仅有菌株THW7具有溶藻作用, 前者藻细胞正常生长, 与对照组无差异, 说明该方式可有效避免LB培养基带来的干扰。因此在筛选溶藻菌时, 应使用菌株的LB固体斜面纯培养物感染藻液或在利用LB液体纯培养物筛选的过程中设置严格的空白对照, 或选用对藻生长无影响的细菌培养基如改良基础柠檬酸培养基、R2A培养基等。
菌体重悬液中仅有菌体, 无菌滤液中仅有细菌的分泌物, 未经任何处理的原始菌液既包含细菌的分泌物又包含菌体。本研究结果显示同时含有细菌分泌物的无菌滤液组和原始菌液组均表现溶藻效果, 这表明THW7产生溶藻作用的因子为胞外分泌物, 菌体本身无溶藻效果, 即菌株THW7通过分泌溶藻活性物质至胞外的方式间接溶藻。这是报道最多的一种溶藻方式, 气单胞菌属、假交替单胞菌属、鞘氨醇单胞菌属、弧菌属、假单胞菌属等多通过的这种方式溶藻[19—23]。已有研究指出假单胞菌能分泌抗生素或生物碱类活性物质溶藻[24,25],关于该菌的活性物质组成有待进一步研究。

图7 THW7的无菌滤液对铜绿微囊藻光合活性的影响Fig. 7 Effect of THW7 bacteria-free filtrate on the photosynthetic activity of Microcystis aeruginosa
3.2 溶藻活性物质对铜绿微囊藻生理活性的影响
叶绿素a作为藻类细胞重要的组成成分, 也是可用来表征浮游植物生物量的最常用的指标之一[13]。在本研究中, 添加溶藻细菌THW7无菌滤液后, OD680和叶绿素a浓度均显著降低, 说明铜绿微囊藻的生长受到显著抑制。
光合作用的强弱可直接反映自养型生物的生长情况, 而叶绿素荧光技术是一种方便、快速且灵敏的测量植物在逆境条件下光合作用的有效方法,它以植物体内叶绿素作为探针[26]。通过测定活体的一系列叶绿素荧光参数如Fv/Fm、Yield、α、ETRm等, 就可知光能吸收、电子传递、光能转化等过程的强弱, 这也能在一定程度上反映藻细胞的光合系统活性, 表征微藻的生长环境良好与否。在正常生理状态下, 这些参数值比较稳定、变化很小,但在胁迫条件下明显下降[5]。在本研究中, 处理组的Fv/Fm、α、ETRm参数值均显著下降直至检测限以下, 这种变化比藻细胞生长、MDA含量、抗氧化酶酶活的变化更迅速。这说明在THW7无菌滤液的胁迫下, 铜绿微囊藻细胞的光合系统II迅速受到影响, 光合系统活性降低, 表现为电子传递受阻、光能转化效率降低, 光合作用逐渐丧失。

图8 THW7的无菌滤液对铜绿微囊藻细胞内MDA含量的影响Fig. 8 Effect of THW7 bacteria-free filtrate on the MDA content in Microcystis aeruginosa
由不饱和磷脂构成的细胞膜容易受到氧自由基攻击和破坏, 导致MDA积累, 故其含量可作为表征生物细胞膜脂过氧化程度的重要指标, 反映细胞膜完整性被破坏的程度[3]。本研究中处理组的MDA含量从第4天开始一直增加, 显著高于对照组。这表明在溶藻菌THW7无菌滤液的胁迫下, 藻细胞受到氧化损伤, 且细胞膜脂过氧化的程度随着时间不断加重。
藻类在正常代谢过程和各种环境胁迫下均能产生活性氧和自由基, 它的积累将引起细胞结构的破坏和功能的紊乱, 生物机体出于自我保护, 除了还原性谷胱甘肽(GSH)、类胡萝卜素等非酶系统做出应激防御, 体内的抗氧化防御系统也起着重要作用, 通过生成各种抗氧化酶、升高酶活等使细胞内的活性氧维持在较低水平以确保正常生长和代谢[27],当胁迫解除后, 酶活可得到不同程度的恢复。
藻细胞在受到胁迫时细胞内MDA含量和抗氧化酶活性会呈现先升高后降低的趋势, Su等[4]研究发现在一株铜绿假单胞菌胁迫下, 藻细胞内MDA含量逐渐积累, CAT、POD活性迅速升高后又急剧降低。Hou等[5]报道一株芽孢杆菌B1的液体培养物能够降低藻细胞的叶绿素a含量, 抑制一系列与光合作用相关基因如psbA、psbD、rbcL等的表达, 且MDA含量升高, 抗氧化系统和细胞内部结构受损,最终藻细胞溶解死亡, 引起内容物外泄。Kong[6]的研究也发现溶藻细菌胁迫引起抗氧化酶活性升高,且发酵液浓度越高, SOD、POD、CAT酶活升高程度越大。Shi等[28]甚至发现在棕鞭藻培养滤液的胁迫下, 微囊藻的生长也会受到抑制, MDA含量和CAT活性明显增加。与以上研究相似, 本研究中一系列抗氧化酶活性在溶藻物质的胁迫下总体呈现先升高后降低的趋势, 这说明在一段时间内溶藻菌THW7所产生的溶藻活性物质会对微囊藻细胞结构和抗氧化系统造成一定的损伤。

图9 THW7的无菌滤液对铜绿微囊藻细胞内抗氧化酶酶活的影响Fig. 9 Effect of THW7 bacteria-free filtrate on the antioxidant enzyme activity in Microcystis aeruginosa
4 结论
LB培养基中的酵母浸提物具有一定的溶藻作用, 仅采用LB液体培养物进行溶藻菌筛选存在假阳性或高估溶藻效率的风险, 而采用其固体斜面培养物筛选溶藻菌则可避免。筛选得到的溶藻细菌THW7通过分泌胞外活性物质的方式间接溶藻, 该溶藻物质会抑制铜绿微囊藻细胞的生长和光合作用, 破坏细胞膜结构完整性并使细胞内抗氧化系统受到损伤。
