活化素Ⅰ型受体对小鼠下颌骨髁突软骨生长发育的影响及其机制
2020-06-12闫广兴叶佳朋王爽爽刘苍维周怡君郝新青杜奥博孙宏晨
闫广兴,叶佳朋,王爽爽,刘苍维,周怡君,胡 月,郝新青,杜奥博,史 册,孙宏晨,
(1.吉林大学口腔医院病理科,吉林 长春 130021;2.吉林大学口腔医院颌面外科,吉林 长春 130021;3.中国医科大学附属口腔医院口腔病理科,辽宁 沈阳 110001; 4.吉林大学口腔医院牙体牙髓科,吉林 长春 130021)
颞下颌关节(temporal mandibular joint, TMJ)是仅在哺乳动物中发现的滑膜关节,在张闭口运动中参与下颌骨的平移和旋转[1]。下颌骨髁突软骨(mandibular condylar cartilage, MCC)是下颌骨生长和关节活动的重要部位,但目前有关MCC形态和发生发展的遗传、细胞及分子机制研究却依然很少。
小鼠的遗传学研究[2-4]表明:骨形态发生蛋白(bone morphogenetic protein, BMP)信号通路参与调控软骨的生长发育。BMP受体由Ⅰ型和Ⅱ型受体组成,其中Ⅰ型受体是特异性信号转导的主要决定因素[5-7]。活化素Ⅰ型受体(activin A receptor type Ⅰ, ACVR1)是Ⅰ型BMP受体之一,ACVR1可与多种BMP、转化生长因子β(transforming growth factor-β, TGF-β)和活化素配体结合从而传导BMP信号通路[8-9]。近年来,ACVR1在生长板软骨中的作用已逐渐被报道,小鼠生长板软骨条件性敲除ACVR1(Col2a1-Cre模型)与同窝野生型小鼠的生长板软骨细胞形态和组织结构比较无明显异常[10]。由于生长板软骨与髁突软骨在胚胎发生、组织结构和对生长因子反应等方面存在一定的差异[11-12],因此,ACVR1对髁突软骨生长发育的作用可能与生长板软骨不同。ACVR1能抑制小鼠髁突软骨细胞的增殖,促进小鼠髁突软骨细胞的成软骨向分化[1, 13- 14]。然而由于体内的环境复杂多变,尚无文献报道ACVR1在MCC发生发展中的作用。为了探讨ACVR1在MCC发生发展中的作用,本实验采用条件性ACVR1基因敲除小鼠模型(Osterix-Cre模型)[15],探讨ACVR1在MCC发生发展中的作用及其相关机制,旨在为临床上MCC相关性疾病的病因及治疗研究提供参考。
1 材料与方法
1.1 实验动物、主要试剂和仪器基因修饰小鼠来自美国密歇根大学牙学院Yuji Mishina实验室。UltraSensitiveTMSP(兔和鼠)免疫组织化学(immunohistochemistry, IHC)试剂盒(福州迈新生物技术公司),DAB(北京中杉金桥生物技术公司),X-gal(型号:B4252)和表面活性剂IGEPAL(型号:I-3021)(美国Sigma公司),抗Osterix(Osx)抗体(型号:ab209484)、抗增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体(型号:PC10)、抗Ⅹ型胶原抗体(型号:ab58632)(美国Abcam公司),甲苯胺蓝染色液(国药集团化学试剂有限公司)。SZX体式显微镜和Vanox倒置显微镜(日本Olympus公司),micro-CT系统(瑞士Scanco Medical AG公司)。
1.2 模型建立和实验分组通过小鼠扩群和鼠耳鉴定,将基因型为Osterix-Cre; Acvr1+/-的雄性小鼠和基因型为Acvr1fx /fx; RS/RS的雌性小鼠配对,选取雄性子代基因型为Osterix-Cre; Acvr1fx /-; RS/+的小鼠作为实验组,Osterix-Cre; Acvr1fx /+; RS/+小鼠作为对照组。于出生当天(postnatal day 0, PN0)、出生第21天(postnatal day 21, PN21)和出生第42天(PN42)分别收集标本,每组标本数:n≥ 3。
1.3 X-gal染色观察MCC组织中Osterix-Cre表达取新生Osterix-Cre; RS/+小鼠,于冷PBS中解剖小鼠并分离小鼠下颌骨,4%多聚甲醛固定10 min,PBS快速冲洗2次,浸泡液4 ℃浸泡30 min(每10 min换液1次),X-gal染液37 ℃染色过夜。第2天将下颌骨取出,采用PBS于4 ℃浸泡60 min(每30 min换液1次),4%多聚甲醛固定20 min,PBS快速冲洗2次,体式显微镜拍照。组织显现为蓝色的部分为阳性结果。组织经15% EDTA脱钙,梯度脱水后石蜡包埋,制成3 μm切片。将X-gal染色标本制成3 μm切片,常规脱蜡至水,伊红Y染色液染色2 min,梯度酒精脱水,二甲苯透明,中性树胶封片,显微镜下观察。
1.4 micro-CT法检测小鼠下颌骨髁突宽度和髁头长度micro-CT检测方法[16](图1,见插页五):点1为髁突关节面的最后点;点2为髁突关节面的最前点;点3为髁突最外点;点4为下颌切迹最凹点;点5为下颌升支最凹点。点1和点2连线为髁突宽度,点3至点4和点5连线的垂线为髁头长度。
1.5 HE和甲苯胺蓝染色观察MCC细胞形态及MCC组织各层软骨厚度取PN21、PN42实验组和对照组小鼠,脱颈处死,分离下颌骨,4%多聚甲醛固定,15% EDTA溶液脱钙,梯度乙醇脱水,石蜡包埋,制成3 μm切片。切片脱蜡至水后,行常规HE染色,封片后显微镜下观察。甲苯胺蓝染色:切片常规脱蜡至水后,甲苯胺蓝染液染色60 min,0.2%冰醋酸分化10 s,蒸馏水冲洗,自然风干后封片,显微镜下观察MCC细胞形态和MCC组织结构[17]。根据MCC周长将髁突软骨平均分为三等分(前1/3、中1/3和后1/3),测量各等分处MCC各层平均厚度。MCC分层(以中1/3区为例):关节层(articular zone, Ar)、增殖层(proliferative zone, Pr)、成软骨细胞层(chondroblastic zone, Ch)和肥大软骨细胞层(hypertrophic zone, Hy)。采用Image J和Image-Pro Plus软件进行组织学测量。
1.6 IHC染色观察MCC组织中PCNA阳性细胞数和Ⅹ型胶原水平标本常规脱蜡至水,抗原修复,3% H2O2阻断内源性过氧化物酶;PCNA(稀释比为1∶1 000)和Ⅹ型胶原(稀释比1∶500)抗体37 ℃水浴锅孵育2 h,根据IHC试剂盒说明书滴加生物素标记的二抗、辣根过氧化物酶标记的链霉素生物素工作液;DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。MCC组织中显现为棕色染色的部分为PCNA和Ⅹ型胶原染色阳性结果。IHC检测方法[18]:采用Image-Pro Plus软件,经校准后测量MCC各层棕色部分的累计光密度(IOD)值,再除以相对各测量层的面积,作为各层阳性区域的平均吸光度(A)值,以A值代表MCC中Ⅹ型胶原表达水平。计数各层PCNA阳性细胞数,重复3次取平均值。
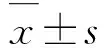
2 结 果
2.1 X-gal染色观察MCC组织中Osterix-Cre表达PN0时,小鼠MCC形态与成熟的MCC形态不同,髁突表面仍存在部分未分化的间充质细胞,此时髁突软骨由关节表面到关节内部分层:纤维软骨细胞层(fibrous chondrocyte zone,Fi)、多态软骨细胞层(polymorphic chondrocyte zone,Pc)、扁平软骨细胞层(flattened chondrocyte zone,Fc)和Hy。X-gal染色结果显示:新生小鼠的下颌骨染色为蓝色,体式显微镜下可见下颌骨、髁和髁突软骨均被染为蓝色(图2A,见插页五)。切片后行伊红染色结果显示:髁突软骨扁平软骨细胞和肥大软骨细胞呈阳性(图2B,见插页五),表明Osterix-Cre在髁突软骨的扁平软骨细胞和肥大软骨细胞中均有表达,间接说明了上述细胞中ACVR1基因被敲除。为了确定Osterix-Cre在小鼠出生后是否持续表达,对PN21的野生型小鼠的髁突软骨进行IHC染色结果显示:Osterix-Cre位于髁突软骨的成软骨细胞和肥大软骨细胞中(图2C,见插页五),提示ACVR1基因在上述细胞中持续缺失。
2.2 PN21时2组小鼠下颌骨髁突宽度和髁头长度micro-CT检测结果显示:PN21时实验组和对照组小鼠下颌骨中均能观察到形态完整的髁突,对髁突宽度和髁头长度测量及统计分析结果显示:实验组小鼠下颌骨髁突宽度和髁头长度均明显短于对照组(P<0.05)。见表1。
表1 PN21时2组小鼠下颌骨髁突宽度和髁头长度


GroupnCondylar widthCondylar head lengthControl81.20±0.052.27±0.42Experiment101.09±0.10*2.25±0.07*
*P<0.05 compared with control group.
2.3 PN21时2组小鼠MCC细胞形态和MCC组织各层软骨厚度HE染色和甲苯胺蓝染色可见:2组小鼠髁突软骨结构完整,均能观察到Ar、Pr、Ch和Hy各层及正常MCC细胞的形态表现。见图3(插页五)。检测小鼠髁突不同区域的各层软骨厚度结果显示:髁突前、中和后1/3的各层软骨厚度比较差异无统计学意义,实验组小鼠中1/3区域的Ch与对照组比较出现增厚趋势,但组间比较差异无统计学意义(P= 0.06)。见表2。
2.4 PN21时2组小鼠MCC组织中PCNA阳性细胞数和Ⅹ型胶原表达水平IHC染色结果显示:PCNA主要表达于增殖期细胞的细胞核,阳性细胞(棕色)主要位于MCC组织中的Pr、Ch和Hy,见图4(插页五)。由于Osterix-Cre主要表达于Ch和Hy,ACVR1在这2层软骨细胞中敲除,其最可能影响这2层的增殖和分化。实验组小鼠MCC组织中单个Hy以及Ch和Hy两层中PCNA阳性细胞数明显多于对照组(P<0.05);实验组小鼠MCC组织中Ch中PCNA阳性细胞数与对照组比较出现增多趋势,但差异无统计学意义(P=0.13)。见表3。
表2 PN21时2组小鼠MCC组织各层软骨厚度

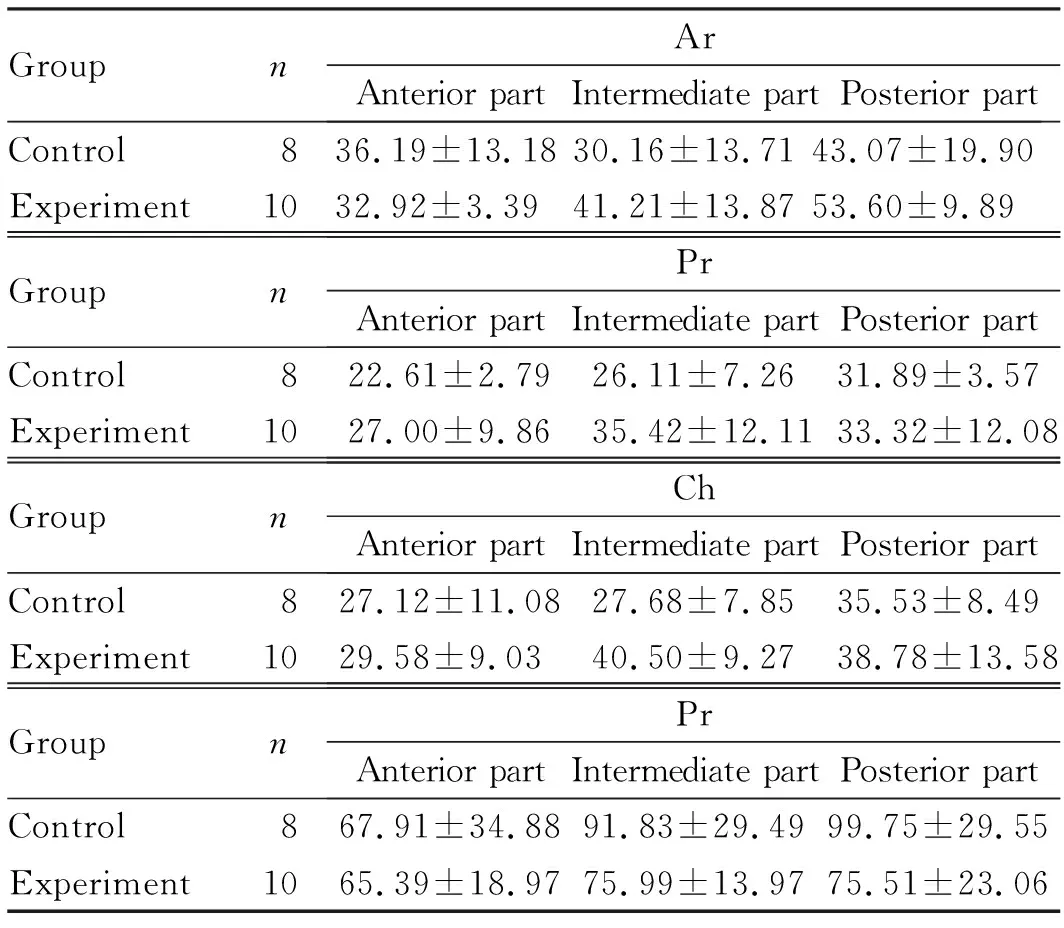
GroupnArAnterior partIntermediate partPosterior partControl836.19±13.1830.16±13.7143.07±19.90Experiment1032.92±3.3941.21±13.8753.60±9.89GroupnPrAnterior partIntermediate partPosterior partControl822.61±2.7926.11±7.2631.89±3.57Experiment1027.00±9.8635.42±12.1133.32±12.08GroupnChAnterior partIntermediate partPosterior partControl827.12±11.0827.68±7.8535.53±8.49Experiment1029.58±9.0340.50±9.2738.78±13.58GroupnPrAnterior partIntermediate partPosterior partControl867.91±34.8891.83±29.4999.75±29.55Experiment1065.39±18.9775.99±13.9775.51±23.06
Ⅹ型胶原主要由髁突软骨的Ch和Hy表达并分泌。采用Image-Pro Plus软件测量Ch和Hy中Ⅹ型胶原阳性区域结果显示:在PN21时,实验组小鼠Ch和Hy两层MCC细胞中Ⅹ型胶原表达水平与对照组比较差异无统计学意义(P>0.05)。见表4。
表3 PN21时2组小鼠MCC组织中PCNA阳性细胞数


GroupnNumber of PCNA positive cells Ch Hy Ch and HyControl824.25±4.432.75±0.9627.00±3.56Experiment1029.33±2.086.67±1.53**36.00±2.00*
*P<0.05,**P<0.01 compared with control group.
2.5 PN42时2组小鼠MCC组织形态表现HE和甲苯胺蓝染色结果显示:PN42时,实验组小鼠部分髁突软骨细胞形态异常,成软骨细胞肥大化进程减慢,部分髁突肥大软骨细胞的排列紊乱,见图5(插页五)。由于髁突软骨在PN42 Ar变薄,所以将Ar和Pr厚度一起测量;此外,由于髁突软骨中部为主要咀嚼受力区域,因此在中部区域测量Ar、Pr和Ch总厚度结果显示:实验组小鼠髁突软骨前1/3区Hy和中1/3区Ar、Pr和Ch这3层总厚度均明显厚于对照组,且前1/3区Ch厚度较对照组有增厚趋势,但差异无统计学意义(P= 0.083),其他各层厚度比较差异均无统计学意义(P>0.05)。见表5。
表4 PN21时2组小鼠MCC组织中Ⅹ型胶原表达水平


GroupnLevel of type Ⅹcollagen ChHyControl80.16±0.040.15±0.06Experiment100.15±0.060.17±0.06
*P<0.05 compared with control group.
表5 PN42时2组小鼠MCC组织各层软骨厚度

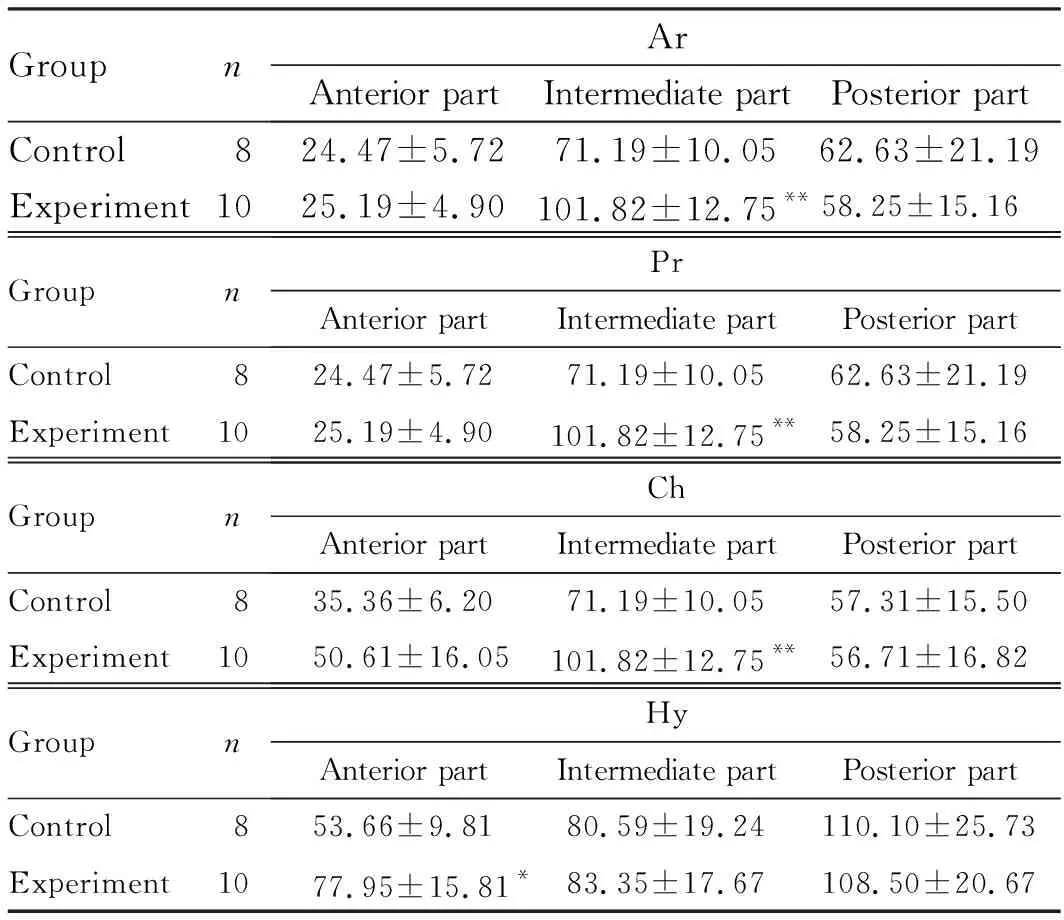
GroupnArAnterior partIntermediate partPosterior partControl824.47±5.7271.19±10.0562.63±21.19Experiment1025.19±4.90101.82±12.75**58.25±15.16GroupnPrAnterior partIntermediate partPosterior partControl824.47±5.7271.19±10.0562.63±21.19Experiment1025.19±4.90101.82±12.75**58.25±15.16GroupnChAnterior partIntermediate partPosterior partControl835.36±6.2071.19±10.0557.31±15.50Experiment1050.61±16.05101.82±12.75**56.71±16.82GroupnHyAnterior partIntermediate partPosterior partControl853.66±9.8180.59±19.24110.10±25.73Experiment1077.95±15.81*83.35±17.67108.50±20.67
*P<0.05,**P<0.01 compared with control group.
2.6 PN42时小鼠MCC组织中PCNA阳性细胞数和Ⅹ型胶原表达水平IHC染色结果显示:在PN42时,PCNA主要表达于Pr、Ch和Hy。在PN42时,Ar较薄,且Pr和Ch界限不清,见图6(插页五),实验组小鼠髁突软骨中PCNA阳性细胞数明显多于对照组。
Ⅹ型胶原主要位于髁突软骨的Ch和Hy。在PN42时,实验组小鼠髁突软骨Ch中Ⅹ型胶原表达水平大于对照组,说明在Ch中Ⅹ型胶原的分泌增多。Hy中Ⅹ型胶原表达水平与对照组比较无明显差异。
3 讨 论
本实验采用条件性ACVR1基因敲除小鼠模型(Osterix-Cre模型)检测小鼠髁突软骨的形态、组织学结构、髁突软骨细胞的增殖和分化结果显示:ACVR1通过抑制髁突软骨细胞的增殖和成软骨细胞向肥大软骨细胞的分化,在调控髁突软骨的生长发育中发挥重要作用。
本课题组选择Osterix-Cre是由于Osterix表达于胚胎期(第13.5天时)髁突软骨刚形成时[19]。本课题组采用的基因修饰小鼠携带Rosa26报告基因,即当Cre在表达Osterix的细胞中被激活后LacZ开始表达。因此可通过X-gal染色显示LacZ阳性细胞,间接说明上述细胞表达Osterix。在本实验中,X-gal和IHC染色结果也进一步明确了PN0和PN21时,Osterix-Cre主要表达于Ch和Hy,说明在模型小鼠中,ACVR1在这部分软骨细胞中被敲除。
本研究结果显示:MCC组织厚度异常出现在PN42时,而PN21时2组小鼠MCC组织厚度比较差异无统计学意义。本文作者推测:由于在PN21时,髁突软骨增殖细胞数较少,并未影响髁突软骨整层组织学结构的改变,因此导致虽然实验组小鼠髁突软骨增殖细胞数增加,但并未引起整层组织结构及厚度的改变。研究[20-21]显示:咀嚼诱导的机械应力也影响髁突软骨的生长发育,由于在出生后21 d小鼠断奶,开始发生自我咀嚼,这也可能是造成PN42时小鼠髁突软骨厚度发生变化的原因之一。RIGUEUR等[10]发现:条件性敲除ACVR1(Col2a1-Cre)的小鼠在胚胎期(第17.5天时)椎体软骨中软骨细胞增殖率降低,这与本研究结果相反,可能是由于ACVR1在椎体软骨和髁突软骨中发挥了不同的作用,或可能是由于ACVR1在体内不同发育时期具有不同的作用,或可能是不同的Cre启动子导致了不同的结果。张琦[22]发现:沉默ACVR1后小鼠髁突软骨细胞的增殖水平升高,这与本研究结果一致。
Ⅹ型胶原蛋白是软骨细胞终末分化的标志物,在PN42时实验组小鼠Ch内MCC细胞中Ⅹ型胶原水平明显增多,说明随着出生后小鼠年龄的增长,ACVR1抑制了髁突软骨Ⅹ型胶原的分泌。Ch中Ⅹ型胶原增多而中后部Hy厚度无改变的可能原因是ACVR1促进了Hy中肥大软骨细胞的的凋亡从而并未影响Hy的厚度,或者可能由于咀嚼力的在ACVR1缺失小鼠中发挥了更重要的作用。本课题组前期研究[22]结果表明:体外培养髁突软骨细胞并沉默ACVR1基因后Ⅹ型胶原的分泌水平降低,这与本研究结果相反,可能原因是体内Ⅹ型胶原的调控机制较体外更为复杂,且体外提取细胞的小鼠为3周龄(体质量为10~12 g),与体内观察到Ⅹ型胶原增多的PN42时期结果也不同。
综上所述,出生后小鼠不断生长,尤其是断奶后的发育时期ACVR1基因缺失导致了小鼠髁突软骨不同层的增殖和分化的改变。ACVR1对小鼠髁突软骨的正常发育至关重要。
