围术期肌松监测的研究
2020-06-12罗珺涵叶继伦张旭
罗珺涵 ,叶继伦 ,张旭
1 深圳市生物医学工程重点实验室,深圳市,518000
2 广东省生物医学信号检测与超声成像重点实验室,深圳市,518000
3 深圳大学 生物医学工程学院,深圳市,518000
0 引言
现代临床的麻醉四要素包含镇静、镇痛、肌松、抑制不良神经反射,其中,肌松主要通过使用肌肉松弛药来实现。肌松药作用于神经细胞后膜,阻滞神经肌肉兴奋传递,从而产生肌肉松弛。适当的肌松能够消除患者术中自主呼吸与机械通气的对抗,减弱或终止某些由骨骼肌痉挛性疾病引起的肌肉强直等[1]。在肌松为手术提供良好的操作条件的同时,肌松药应用的安全性也成为围术期的重要问题。
由于肌松药具有的副作用,在手术的不同阶段需尽量做到以最少的肌松药剂量达到肌松的要求。然而,一些因素诸如药物的特性、药物的相互作用影响、患者的生理病理差异等,会导致患者在肌松药作用后的反应不同。这些因素以及不同医生的临床经验差异,都会影响术后肌松残余(postoperative residual curarization,PORC)评估的准确性。PORC可能会导致肌肉无力、低氧血症以及术后肺部并发症等。但是,当前许多临床麻醉科并未使用定量肌松监测仪来提供手术指导。
肌松监测可以在术中指导肌松药的使用,提示医生调整输注药物的剂量,从而根据肌肉松弛状态和手术进展情况选择合适的停药时机,并在术毕时减少PORC作用。
采用定量肌松监测仪能够在围术期合理地指导肌肉松弛药物的使用,实现肌松药剂量的个体化使用,并在术后发现残余肌松作用,从而减少患者对肌松药的不良反应,降低手术风险。
1 刺激方式
1.1 刺激源类型
刺激源一般可分为电刺激、磁刺激和热刺激。考虑到对人体的伤害以及测量的准确度,目前临床上主要采用电刺激法作为刺激源。当外周神经受到电刺激后,会诱发该神经所支配的肌肉产生收缩反应或肌电效应,之后可通过传感器检测该反应,从而实现定量评估神经阻滞程度。
磁刺激通过外界磁场作用于人体组织时产生的电流来刺激神经元的突出前膜,引起运动神经元去极化,从而兴奋大脑皮层的运动区产生肌肉运动[2]。这种刺激源无需与受试者的身体接触,患者疼痛感较弱,但存在设备使用不便等缺点。
热刺激在短时间内作用于机体后,法布罗大学的首席研究员Arnd Pralle博士表明:“神经元细胞受热会迫使温度敏感性的离子通道打开,从而刺激神经元放电”。热刺激源与磁刺激类似,同样无需与受试者的身体接触。
1.2 电刺激模式
基于电刺激源,可通过改变刺激电极输出电流的大小和放电时间等参数来产生多种可选的电刺激模式。
单刺激(single-twitch stimulation,SS)指通过刺激电极输出频率为0.1~1 Hz、波宽为0.2~0.3 ms的单次超强刺激,常用刺激频率为0.1 Hz。这种刺激模式的优点在于刺激方法简单,且受试者的不适感较低,因此可用于反复测试,从而协助医生判断受试者对刺激的敏感程度。缺点在于不能反应肌松药对突触前膜的作用,也无法判断神经阻滞的性质,且不同频率的刺激所得结果之间无法相互比较,因此需提前测定参照值。四次成串刺激(train of four stimulation,TOF)是目前临床应用最广泛的电刺激模式,它无需测定参照值且刺激部位痛感轻。由刺激电极输出四个间隔0.5 s的连续超强刺激串,频率为2 Hz,波宽为0.2~0.3 ms,两组TOF刺激之间相隔10~20 s。之后,可以通过式(1)来表示衰减程度,将rTOF作为评估神经阻滞程度的指标。
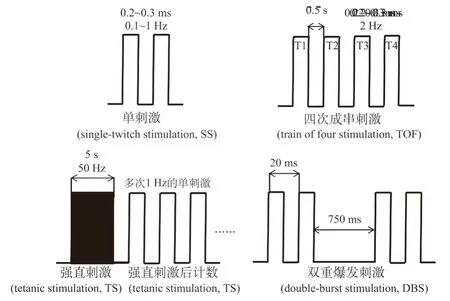
图1 各种电刺激模式示意图[6]Fig.1 Schematic diagram of various electrical stimulation patterns

式中:T4代表第4个肌颤搐,T1代表第1个肌颤搐。关于TOF指标的评估标准经历了两个阶段:早期认为,rTOF>0.7时肌松残余作用已消除,但进一步的研究证实,呼吸肌对肌松药较不敏感,呼吸肌从肌松药作用中恢复较早,当rTOF>0.7时,呼吸功能已经基本恢复,但咽喉部肌肉肌力恢复较晚,而在rTOF≥0.9时,咽喉部肌肉的协调功能才能够完全恢复正常,使颈动脉体缺氧性通气反应不受损害。因此,目前推荐以rTOF<0.9作为提示PORC存在的标准[3]。
强直刺激后计数(post-tetanic twitch count,PTC)也是临床上较为常用的一种电刺激模式,是基于强直刺激(tetanic stimulation,TS)后产生的强直后易化现象,记录强直刺激后对单次肌颤搐刺激反应的次数。该方法能够弥补TOF无法评估深度神经阻滞的缺点,且能够判断非去极化肌松药使用后的神经阻滞性质。不足之处在于两次强直刺激需间隔6~10 min,因此无法实现动态连续监测,且使用去极化肌松药时无法采用该刺激模式。
双重爆发刺激(double-burst stimulation,DBS)适用于神经肌肉阻滞恢复期对衰减程度的判断,在主观评估(目测或触摸)时,DBS比TOF能在更广的范围内察觉到肌颤搐的衰减,且每次所需的间隔时间较PTC短,但患者的不适感较强。
根据临床实际需求来切换电刺激模式,能够确保刺激电流既能安全作用于人体,又能达到检测肌松的目的。如麻醉诱导时常选用SS和TOF,以了解肌松程度并评估恢复期;中度阻滞与恢复期间选用TOF监测;深度阻滞则采用PTC;在恢复室病人应用TOF和DBS观察PORC现象。
1.3 刺激部位
最佳监测肌群是在围手术期中最容易观察的部位,因此临床上普遍首选的刺激部位是尺神经。刺激时,将远端电极放在近端腕横纹1 cm尺侧屈腕肌桡侧,近端电极置于远端电极近侧2~3 cm处[4]。目前,肌松深度一般在刺激尺神经后,通过监测拇内收肌进行评估。
2 检测方式
自肌松监测在20世纪50年代被引入临床以来,对围术期患者肌松残余的检测方式主要经历了三个发展阶段:①1950年代起以生命体征为依据的临床检测;②1970年代起采用周围神经刺激器的定性检测,且研究认为TOF比值>0.7时,可表示神经肌肉功能恢复较好[3];③1997年Kopman等将rTOF<0.9作为标准的定量检测法,这是目前诊断神经肌肉阻滞准确性最好的检测方式[3]。
2.1 临床检测
临床检测法是最早期临床医生判断患者肌松状况的一种主观方法。2017年《肌肉松弛药合理应用的专家共识》中指出,判断肌松药的残留阻滞作用基本消除,有以下4项较为可靠的临床指征:
①患者意识清醒,同时伴有呛咳和吞咽反射;
②患者头部能够持续抬离枕头5 s以上(反映肌肉强直收缩力);
③患者呼吸平稳,呼吸频率为10~20次/min,最大吸气压≤-50 cmH2O(1 cmH2O=9.81 Pa);④测量得到的PetCO2和PaCO2均≤45 mm Hg(1 mmHg=133.32 Pa)。
在没有专门的肌松监测仪器的情况下,该方法能够在一定程度上评估患者术后的肌松残余。但该方法通常需要在患者清醒的情况下配合进行,且依赖于医生的个人经验和主观判断,对患者的肌松状况没有统一的评估标准,导致肌松评估结果可能存在风险。
2.2 定性评估
由于使用临床检测后,PORC的现象仍普遍发生,因此在1958年,CHRISTIE等[5]提出采用外周神经刺激器(peripheral nerve stimulator,PNS),来用于诊断应用肌松药后导致的持续呼吸抑制现象。
使用外周神经刺激器后,由于不同患者对同一刺激产生反应的敏感程度不同,神经反射程度仍无法被定量评估。
定性检测法可以让医生在患者意识非清醒状态下,通过视觉或触觉评估肌肉松弛程度。对比临床检测法,该检测方法的可靠性有所提升[3],但仍需基于临床医生的主观判断,无法形成统一、客观的评估标准,因此还需进一步采用定量检测。
2.3 定量评估
目前肌松监测的研究主要基于定量检测的方式。在围术期配合使用肌松监测仪,有助于医生了解肌松药作用的起效、维持和消退情况。
定量的肌松监测设备一般需含有两个部分:一是通过刺激源产生刺激作用于外周神经,类似于周围神经刺激器;二是检测肌肉松弛程度并量化,最终以数字形式(0~1.0或0~100%)直观地显示结果。
2.3.1 肌机械描记法
肌机械描记法(mechanomyography,MMG)通过传感元件测量拇内收肌等长收缩肌力,测量得到的TOF指标准确度高,是肌松监测的“金标准”[6]。由于MMG型的监测仪在使用前需要较为繁琐的设置,且设备价格昂贵,因此主要为了科研目的而开发,不再作为商业生产[6]。
2.3.2 加速度描记法
加速度描记法(acceleromyography,AMG)基于牛顿第二定律的原理,将加速度传感器和刺激电极分别固定在患者拇指和腕部的运动神经上,当肌肉受刺激收缩后,加速度传感器能够测量得到与该收缩幅度成正比的信号[6]。基于加速度描记法,将探针附着在拇指尖端,以标准的方式刺激尺神经,如图2所示。该方法虽然测量结果稳定性较EMG型监测仪差,但由于加速度型肌松监测仪的操作简便、体积较小,因此该检测方法常用于肌松监测的产品中。
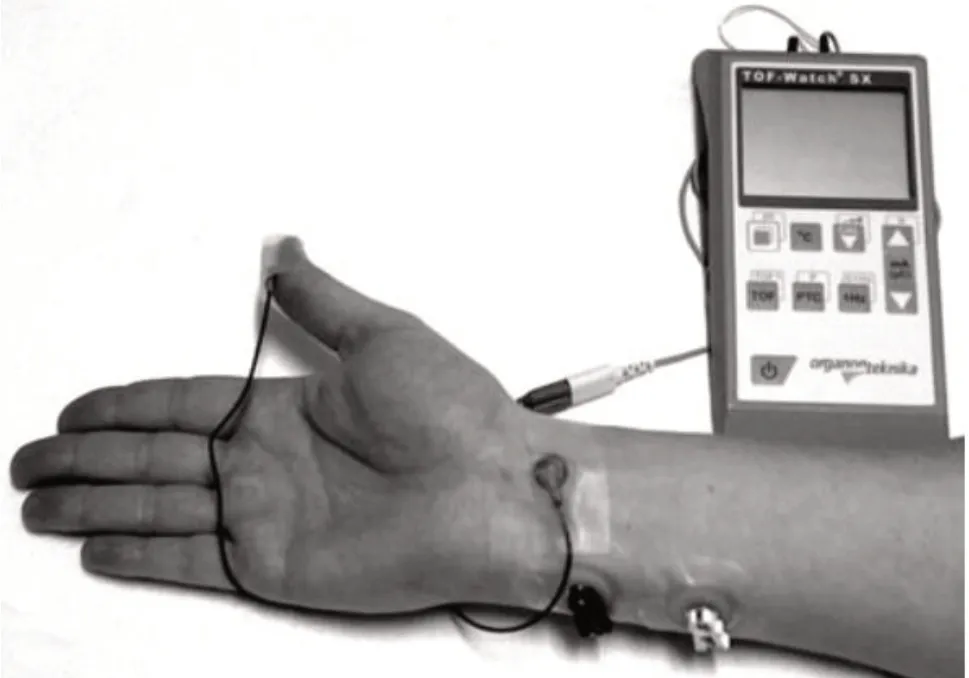
图2 加速度描记法Fig.2 Acceleromyography
2.3.3 压电描记法
压电描记法(kinemyography,KMG)基于压电效应,采用压电传感器测量拇指收缩弯曲传感器而产生的电信号[6]。该方法使用简便,但不足之处在于只能用于尺神经部位的监测,要求患者的拇指可自由活动[7]。
2.3.4 肌电描记法
肌电描记法(electromyography,EMG)是最初的神经肌肉定量评估方法[8],测量原理基于运动神经被电刺激后的复合动作电位,使用时需要放置一个参照电极,通过电刺激尺神经,并在鱼际区记录肌电图,以检测拇内收肌的诱发反应,如图3所示[9]。虽然测量时易受电气干扰或环境温度影响[10],但由于测量肌肉的电活动,因此肌肉无需要求固定或可自由活动。目前正在开发用于临床常规使用的小型独立EMG型肌松监测仪[6]。
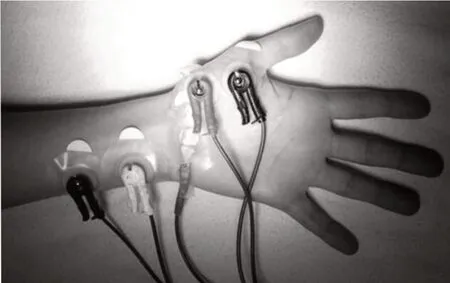
图3 肌电描记法Fig.3 Electromyography
2.3.5 肌音描记法
肌音描记法(phonomyography,PMG)采用电容式麦克风检测肌肉收缩引起肌纤维横向运动发出的低频声音,声音强度与收缩力的大小成比例[6]。该方法的优势在于可用于各种部位的肌肉监测,易于使用。虽然PMG型肌松监测仪尚未用于临床使用,但已有研究表明PMG与“金标准”MMG测量得到的结果具有良好的一致性[11]。
3 应用
根据2017年的《临床麻醉监测指南》,目前临床上常用的神经肌肉传导功能监测仪一般带有简便的神经刺激器和加速度肌松监测,如国外欧加农公司生产的TOF-Watch SX肌松监测仪,国内迈瑞公司生产的插件式NMT模块等。
肌松监测仪能够客观、定量、及时地反映患者使用肌松药后的神经肌肉阻滞程度,对临床合理使用肌松药具有很强的指导意义,应在围术期推广应用定量肌松监测仪,目前上市主流的独立或模块式肌松监测产品,如表1所示。
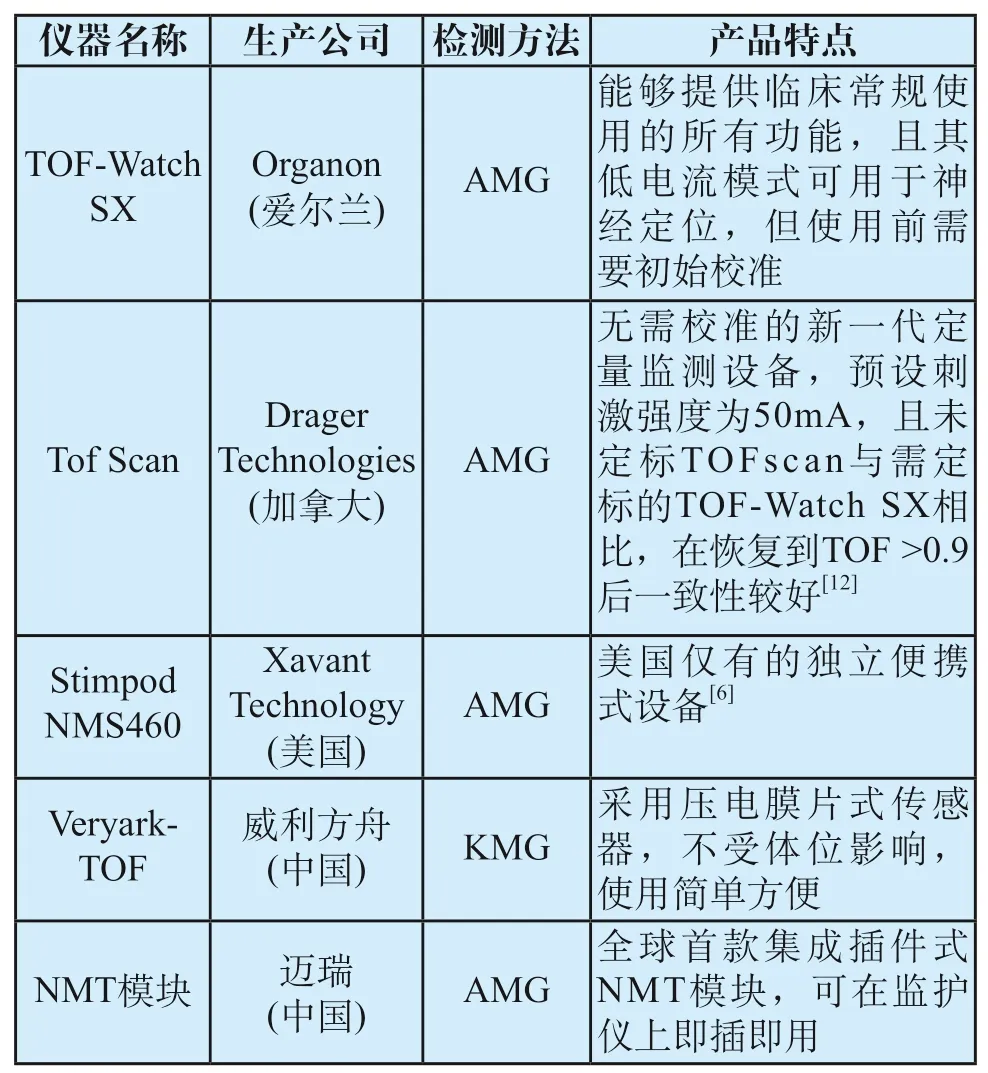
表1 肌松监测产品Tab.1 Muscle relaxant monitor products
4 总结
本研究对肌松监测涉及到的原理及方法,以及现有仪器做了较为详细的介绍。通过对目前国内外肌松监测方法研究的梳理,可以发现肌松监测已成为临床麻醉学领域的一个研究热点,已经有一些肌松定量检测方法应用于临床,如AMG、EMG等。但研究表明,肌松监测的研究和应用两者间存在着较大的差异。在围术期使用了主观方式评估肌松效应的患者不到40%,而使用定量肌松监测仪进行客观评估的患者仅仅为17%[13-14]。虽然国外对肌松监测的研究起步更早,较早研发出了肌松监测的产品,但据临床数据统计[15-16],仍有约10%的美国、澳大利亚和新西兰,以及20%的欧洲麻醉师从不通过施加外部神经刺激来监测肌松状况。
我国当前在肌松监测仪方面的研究和临床应用仍存在一些不足。目前,只有一些较好的医院会采用肌松监测仪作为临床指导,但国内已有不少公司和科研机构正在研发肌松仪器,如迈瑞医疗公司、北京思路高医疗公司、中国医学科学院生物医学工程研究所[17]、湖州市第三人民医院设备科[18]。因此,对于肌松监测仪器后续的研究与应用,主要可以从以下几个方面展开:
(1)将肌松监测与主流器械整合,可增加其应用场景。例如,近年中国医学科学院生物医学工程研究所研制了一款带有血氧监测功能的肌松监测仪,可通过外部传感器探头同时监测血氧饱和度和肌松指标,能够减少患者因监测需要佩带的传感器数量,同时减少监护仪使用对患者产生的干扰。
(2)优化现有的仪器设计方案。现有产品主要基于目前较为成熟的AMG检测方法,但在测量准确度、性能稳定性方面仍需进一步优化提升。同时,若公司为临床提供使用更简便、性价比更高的设备,也有助于我国在临床上普及肌松监测仪的应用。
(3)研究新的监测评价指标。目前临床上公认rTOF是评估神经阻滞程度较为可靠的监测指标。但各科研机构也可以根据现有肌松监测仪存储统计得到的临床数据,进一步分析其潜在意义,评估新的监测指标,有助于提升国产肌松监测技术及应用水平。
肌松监测仪在围术期应用后,明显有助于医生发现患者术后的残余肌松作用。建议我国各医院积极引入定量肌松监测仪,并推广其在围术期使用,从而降低因肌松而引起的手术风险,以及术后严重并发症的发生率。
