云南疣粒野生稻抗白叶枯病多菌系鉴定分析
2020-06-12邢佳鑫陈玲柯学钟巧芳张敦宇付坚陈越肖素勤王玲仙王波殷富有陈丽娟程在全
邢佳鑫 陈玲 柯学 钟巧芳 张敦宇 付坚 陈越 肖素勤 王玲仙 王波 殷富有 陈丽娟 程在全*
(1 云南农业大学农学与生物技术学院,昆明650201;2 云南省农业科学院生物技术与种质资源研究所/云南省农业生物技术重点实验室/农业农村部西南作物基因资源与种质创制重点实验室,昆明650205;*通讯作者:650205czquan-99@163.com)
水稻白叶枯病(bacterial blight)是世界范围内最严重的水稻细菌性病害,也是我国水稻三大病害之一。实践证明,水稻白叶枯病没有特效的化学防治试剂,而种植抗病品种是最为经济、安全和有效的防治措施。为了在水稻白叶枯病害常发区获得理想的水稻产量,需要不断培育携有不同抗白叶枯病基因的品种,尤其是对广谱抗病基因的发掘与利用,以抵御白叶枯病菌的变异[1]。
野生稻是现代栽培稻的始祖,由于长期处于野生状态,经受了各种灾害和不良环境的自然选择,蕴含了大量的优良基因,是天然的基因宝库[2]。全世界稻属中有22 个野生种,从中发掘可利用的抗病新基因并进行育种利用,是近年来研究的热点。迄今从野生稻中克隆的抗白叶枯病基因有 3 个,即 Xa21[3]、Xa23[4]和 Xa27(t)[5]。 另 外 ,Xa29(t)[6]、Xa30(t)[7]、Xa32(t)[8]、xa32(t)[9]和Xa35(t)[10]等5 个抗白叶枯病基因分别来自药用野生稻、普通野生稻、澳洲野生稻、疣粒野生稻和小粒野生稻。这5 个抗白叶枯病基因已被定位在不同的染色体上,但目前尚未被克隆。可见,野生稻中的抗白叶枯病基因的发掘应用还处于初级阶段,从中开发利用广谱高抗白叶枯病基因的前景广阔,对改良栽培稻抗性、扩宽其遗传基础具有重大意义。
疣粒野生稻是中国现有三种野生稻资源之一,主要分布在云南和海南,拥有许多优良性状,具有很高的利用价值。过去一些研究表明,疣粒野生稻对白叶枯病抗性良好,发现其抗性从高抗到接近免疫[11-12]。然而,程在全等[13]利用 C1、X1、BD8438 和 CN9404 共 4 个菌株鉴定云南疣粒野生稻对白叶枯病的抗性时发现,部分植株感供试菌株。可见,云南疣粒野生稻对白叶枯病菌的抗性并不一致。为了解云南疣粒野生稻对不同白叶枯病小种的抗性,尤其是对近年在云南部分稻区流行的白叶枯病菌的抗性,本研究利用本实验室从2013 年至2017 年间收集的云南不同地区水稻白叶枯病菌株,以及国内外部分标准强致病菌系,对云南疣粒野生稻12 个居群共36 份材料进行了抗性鉴定,以为开发和利用云南疣粒野生稻抗白叶枯病基因提供科学依据。
1 材料与方法
1.1 供试材料和菌株
供试的疣粒野生稻材料取自云南省不同地区的12 个居群,每个居群分别随机采样3 株,共36 份,其详细来源见表1。金刚30 为感病对照材料。所有研究材料均种植于本实验室温室中。
供试水稻白叶枯病菌株:本研究中用到的菌株包括本实验室从2013 年至2017 年间收集的18 个在云南省部分稻作区流行的白叶枯病菌,以及6 个国内外部分标准强致病菌系,共24 个,详细信息见表2。

表2 不同白叶枯病菌详细信息

表3 接种水稻白叶枯病发病程度分级标准
1.2 供试材料的培养
对选取的疣粒野生稻材料进行割茬处理,分栽到直径为20 cm、高为15 cm 的花盆中,每份材料分栽24盆,进行编号,浇透水,放置在温室阴凉处,每隔1 周浇1 次水,待植株长至孕穗期时进行接种鉴定。同时播种金刚30 种子于24 个直径为21 cm、高为21 cm 的花盆中,进行编号,放置在温室中进行正常水肥培养至孕穗期。将各材料相同编号的花盆放在一起,利于接种同一菌株。
1.3 抗病性鉴定
本研究采用剪叶接种的方法进行鉴定。接种前将在-20℃保存的菌种于NA 培养基上复壮,28℃~30℃培养48 h 后,用无菌水洗脱菌株,悬浮均匀,将菌悬液浓度调节为 3×108cfu/mL(OD600=0.5),用于接种试验。手术剪灭菌后,蘸取制备好的病菌悬浮液,将供试材料叶片叶尖剪去1~3 cm,每株植株接种3 片以上叶片,以感病水稻金刚30 作为对照,并做好标记。接种21 d 左右当参试材料的病情发展趋于稳定时,量取病斑长度,鉴定供试植株的抗病性,同时进行拍照。
1.4 数据分析
整理测量得到的数据,抗性分级参考表3。根据对照材料金刚30 的发病等级,分析水稻白叶枯病菌的致病力,并按照抗性分级标准对供试植株进行抗感分级,并利用Microsoft Excel 2010 进行常规的数据统计,采用SPSS 19.0 进行系统聚类分析疣粒野生稻的抗菌谱,以及计算众数值、最小值、最大值、求和值、均值和均值标准差,进行疣粒野生稻对白叶枯病抗性的量化分析,其中众数值是指一组数据中,出现次数最多的标志值,即为最普遍、最常见的标志值,可了解疣粒野生稻哪种抗病类型最普遍;最小值是指样本中取值最小的数据、最大值是指样本中取值最大的数据,根据最小值和最大值,可了解疣粒野生稻抗病类型的范围;求和值是指一组数据所有取值的总和,均值表示某变量所有取值的集中趋势或平均水平,根据求和值和均值,有利于挑选出抗性最优的参试材料;均值标准差(Standard Error of Mean, SE.mean)是描述这些样本均值与总体均值之间平均差异的统计量,可分析样本间抗性差异程度。
表4 感病对照材料金刚30 接菌情况
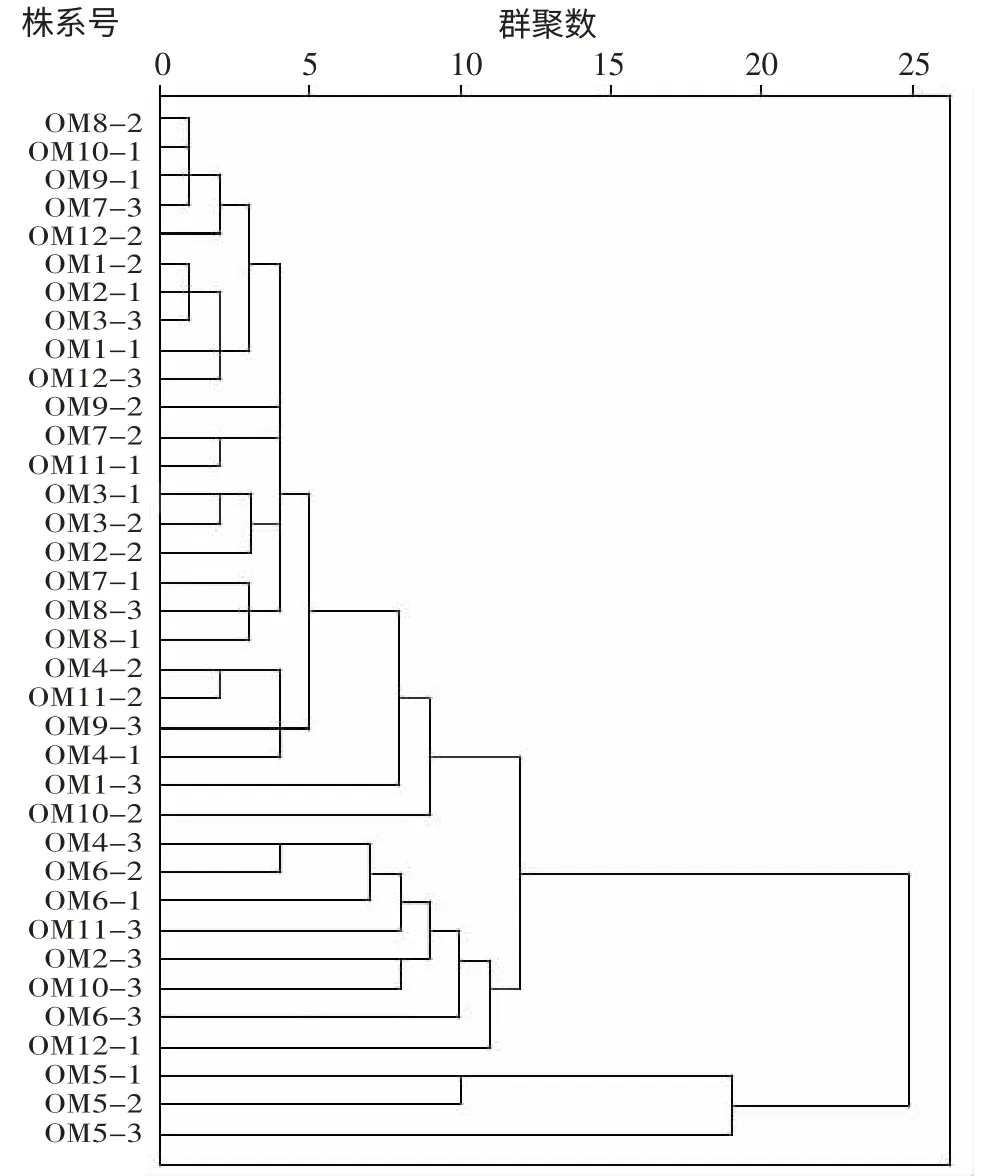
图1 36 份疣粒野生稻对白叶枯病菌抗性结果聚类分析
2 结果与分析
2.1 接种菌株致病力
根据感病对照材料金刚30 的病斑长度,对其进行抗感等级划分,由等级划分判断接种菌株致病力。接种后14~21 d,金刚30 的发病病情趋于稳定。接种后21 d调查发现,金刚30 接种24 个白叶枯病菌的植株病斑长度都超过了20 cm(表4),叶片枯黄,而未接种病菌的植株叶片没有发生任何变化,说明用于接种的白叶枯病病菌致病力没有丧失,可用于接种参试材料。
2.2 云南疣粒野生稻对白叶枯病的抗性反应
疣粒野生稻接种后第21 d,出现了3 类症状5 种病斑。第一类症状为急性症状,像开水烫伤一样,病斑有1 种,呈灰绿色。第二类症状为典型症状,病斑有4种:第1 种呈黄白色,第2 种呈淡黄白色,这两种病斑部分病菌都向下蔓延,病斑往往较长;第3 种呈黄色,少数病菌向下蔓延,病斑稍短;第4 种呈褐色,病菌不蔓延,病斑长度一般为0.00~0.30 cm。第三类无病症,症状与接种清水一样,只有一个割伤的伤口痕迹。参试的材料中大部分材料表现第二类第4 种病斑。量取病斑长度进行统计分析,根据抗性反应的鉴定标准,将36 份云南疣粒野生稻对供试菌株的抗性反应进行分级,结果显示,绝大部分野生稻对参试的24 个菌株的抗性表型基本都处于高抗到免疫程度,抗性表现良好(表5)。
2.3 云南疣粒野生稻对多菌系的抗性分析
通过系统聚类法分析36 份疣粒野生稻的抗谱,可分为抗谱宽和抗谱窄两大类,除居群5 中的3 份材料抗谱较窄之外,其余为抗谱宽类型,即相对于OM5-1、OM5-2 和OM5-3,其余33 份参试疣粒野生稻抗谱都较宽(图 1)。
根据量取的每份疣粒野生稻的病斑长度,统计参试材料分别对24 个菌株抗性反应的病斑长度的众数值、极小值、极大值、求和值、均值及均值标准差,统计结果见表6。从表6 可见,众数值最大为1.00 cm(高抗),最小为 0.00 cm(免疫),除 OM4-3、OM6-1 和OM6-2 这3 份材料众数值稍大外,大部分的参试植株众数值都为0.00 cm,说明对24 个菌株的抗性表现免疫的材料最为普遍。从最小值和最大值可知,参试材料的抗病范围有4 种,第1 种是最小值到最大值在0.00~1.40 cm 之间(I~HR),第 2 种在 0.00~3.00 cm 之间(I~R),第 3 种在 0.00~6.00 cm 之间(I~MR),第 4 种在0.00~9.00 cm 之间(I~MS),其中第 1 种类型最多(占比44.44%),第4 种类型最少(占比仅2.78%)。从均值可看出,OM5-1 抗性最差,其平均病斑最长;18 份参试材料的均值小于等于0.20 cm(I),抗性较好,进一步从求和值可看出,这18 份材料中OM2-1、OM8-2 和OM7-3的抗性表现特别突出,它们对24 个菌株抗性反应的病斑长度相加起来的总和小于等于1.50 cm,而OM2-1的求和值最小,仅为0.68 cm,说明OM2-1 的抗性最优。从标准差可看出,OM2-1 的标准差亦最小,说明OM2-1 对24 个菌株的抗性反应差异最小,结合表5 可知,该份材料除对XOO5 菌株表现为高抗之外,对其余菌株的抗性反应都为免疫,表明OM2-1 的抗谱最为广泛;反之,OM5-1 的标准差最大,说明 OM5-1 对 24 个菌株的抗性反应差异最大,抗谱最窄。

表5 疣粒野生稻对白叶枯病菌的抗感反应
综合以上结果说明,参试的疣粒野生稻对白叶枯病菌的整体抗性水平较好,44.44%野生稻对参试菌株表型处于高抗到免疫水平,并且抗病类型为免疫的表型最为普遍;OM5-1、OM5-2 和 OM5-3 这 3 份材料抗谱较窄,尤其是OM5-1,其余33 份参试材料抗谱都较宽,特别是OM2-1。
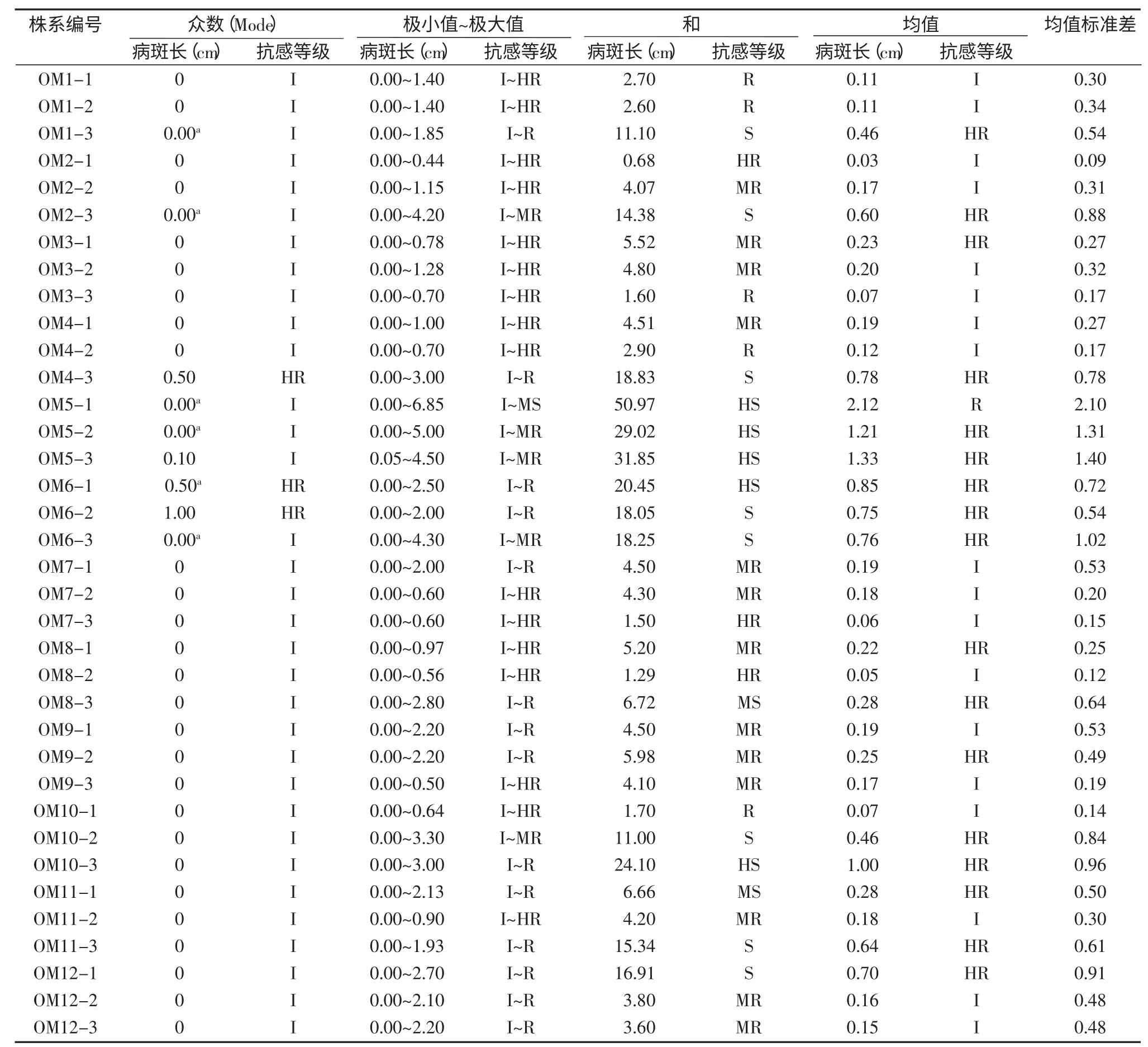
表6 参试材料对24 个菌株抗性反应的量化指标
2.4 云南疣粒野生稻对单一菌株的抗性分析
统计疣粒野生稻对单一菌株不同抗性反应类型的份数,建立柱状图(图2)。从图2 可知,无论对哪个单一菌株的抗性,I 型和HR 型材料所占比例均较大,除对XOO3 菌株HR 型材料比I 型材料多外,参试材料对其余单一菌株的抗性反应以I 型材料最多,具体表现如下:I 型材料中,免疫XOO3 菌株的材料最少,免疫XOO23 菌株的材料最多;HR 型材料中,高抗XOO23菌株的材料最少,高抗XOO3 菌株的材料最多;R 型材料中,抗XOO3 菌株材料最多,有4 个单一菌株(XOO9、XOO14、XOO23 和 XOO24)对参试材料没有 R类型的抗性反应,即对于这4 个单一菌株的抗性反应而言,R 型材料最少,为0 份;MR 型材料中,中抗XOO2 菌株稍多外,有一半以上的菌株对参试材料没有MR 类型的抗性反应;MS 型材料中,只有1 份参试材料对XOO8 菌株出现MS 类型的抗性反应。以上结果表明,参试的云南疣粒野生稻,除有1 份中感XOO8菌株外,其余参试材料对各单一菌株抗性良好,大多数达到了高抗到免疫的程度。

图2 疣粒野生稻对单一菌株抗性反应
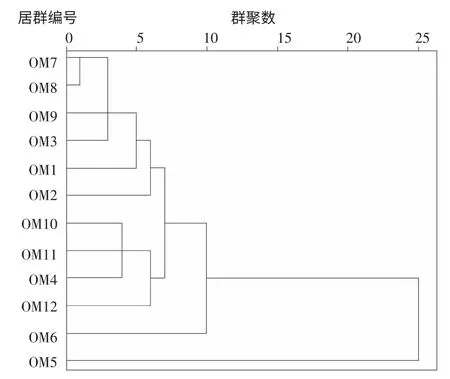
图3 不同居群的疣粒野生稻对白叶枯病菌抗性结果聚类分析
2.5 不同居群的疣粒野生稻抗性比较分析
根据每个居群中3 份植株的病斑求取平均值,依据抗性反应的鉴定标准,统计12 个居群对参试菌株的抗性反应,结果见表7。12 个居群对大多数菌株抗性都达到了高抗到免疫程度,根据其抗病特性,进一步进行系统聚类,如图 3 所示,可分为 A、B、C 和 D 四大类,其中 OM5 为 A 类,OM6 为 B 类,OM4、OM10、OM11 和OM12 为 C 类,OM1、OM2、OM3、OM7、OM8 和 OM9 为D 类。结合表7 可知,A 类的抗谱最窄,此类型对参试的白叶枯病菌的抗性表现为中抗到免疫,B 类较A 类抗谱稍宽,对参试白叶枯病菌的抗性表现为抗到免疫,C 类较A 和B 类抗谱更宽,对参试白叶枯病菌的抗性表现为高抗到免疫,D 类抗性程度虽与C 类一致,但对更多的参试菌株具有免疫能力,此类抗谱较C 类更宽,然而在D 类中,OM7 免疫的菌株更多,即OM7 的抗谱最广。
以上结果显示,除OM5 中抗部分参试菌株外,其余居群都是抗参试菌株。从表7 可见,OM5 对XOO2、XOO5、XOO8 和 XOO16 菌株中抗,病斑都在 3.1 cm 以上,其中对XOO8 菌株抗性反应的病斑最长,达4.28 cm,即XOO8 对OM5 具有一定的致病力。
野生稻植株往往是遗传杂合体,个体之间也存在遗传背景差异。本研究以标准差的大小作为考核指标,评估接种同一菌株同一居群的3 份野生稻抗病能力的差异,标准差大,说明3 株间的病斑长度差异大,则抗病能力差异大,反之亦然。从表7 可看出,除OM3 外,其余疣粒野生稻居群对菌株抗性反应的病斑长度标准差都有超过 1.0 的,其中,OM1、OM2、OM7、OM8、OM9、OM11 对1 个菌株的抗性反应标准差超过1.0;OM4 和OM6 对 2 个菌株的标准差超过 1.0;OM5、OM10 和OM12 分别对10 个、7 个和6 个参试菌株的标准差超过1.0。由此说明,OM3 纯合度高,植株之间抗病差异小,而其余11 个居群具有一定的杂合度,尤其OM5、OM10 和OM12,它们个体之间抗病能力差异较大,这3个居群杂合度相对较高。
综上所述,云南12 个居群的疣粒野生稻对大多数白叶枯病菌抗性表现较好,除OM5 和OM6 之外,其余居群对参试的24 个菌株抗性都达到了高抗到免疫程度,特别是耿马孟定(OM7)野生稻的抗性较其他居群好,景洪景讷(OM5)对在云南会泽流行的菌株(XOO8)抗性不强。同时,本研究也表明了大部分云南疣粒野生稻居群杂合度高,同一居群不同植株对白叶枯病的抗性差异大。
3 结论与讨论
3.1 云南疣粒野生稻是宝贵的抗白叶枯病资源
根据分析结果可知,无论以植株为单位还是以居群为单位,大部分疣粒野生稻对白叶枯病高抗甚至免疫,说明云南大部分疣粒野生稻携有丰富的优良白叶枯病抗性基因。特别是OM2-1 在抗性和抗谱方面都较其它供试材料好,该材料可能含有1 个甚至多个高抗白叶枯病基因。这些丰富的基因资源对遗传研究和品种改良具有重要的价值。本研究还发现,少部分疣粒野生稻中感个别菌株,这与程在全等[13]的研究结果一致,但据其报道的感病疣粒野生稻病斑长度最长为3.2
cm,若按本文的评价标准应为中抗,本文鉴定的最长平均病斑为6.85 cm,即到目前为止,未见相关文献报道疣粒野生稻病斑特别长的,为此,笔者继续同等条件种植培养管理,进行接种,发现该份疣粒野生稻的病斑长度变化不大,推测温室种植可能使疣粒野生稻自身的抗病能力下降,后续还需将该材料种植于室外,经过多年种植之后再进行接种鉴定,了解其是否感病。
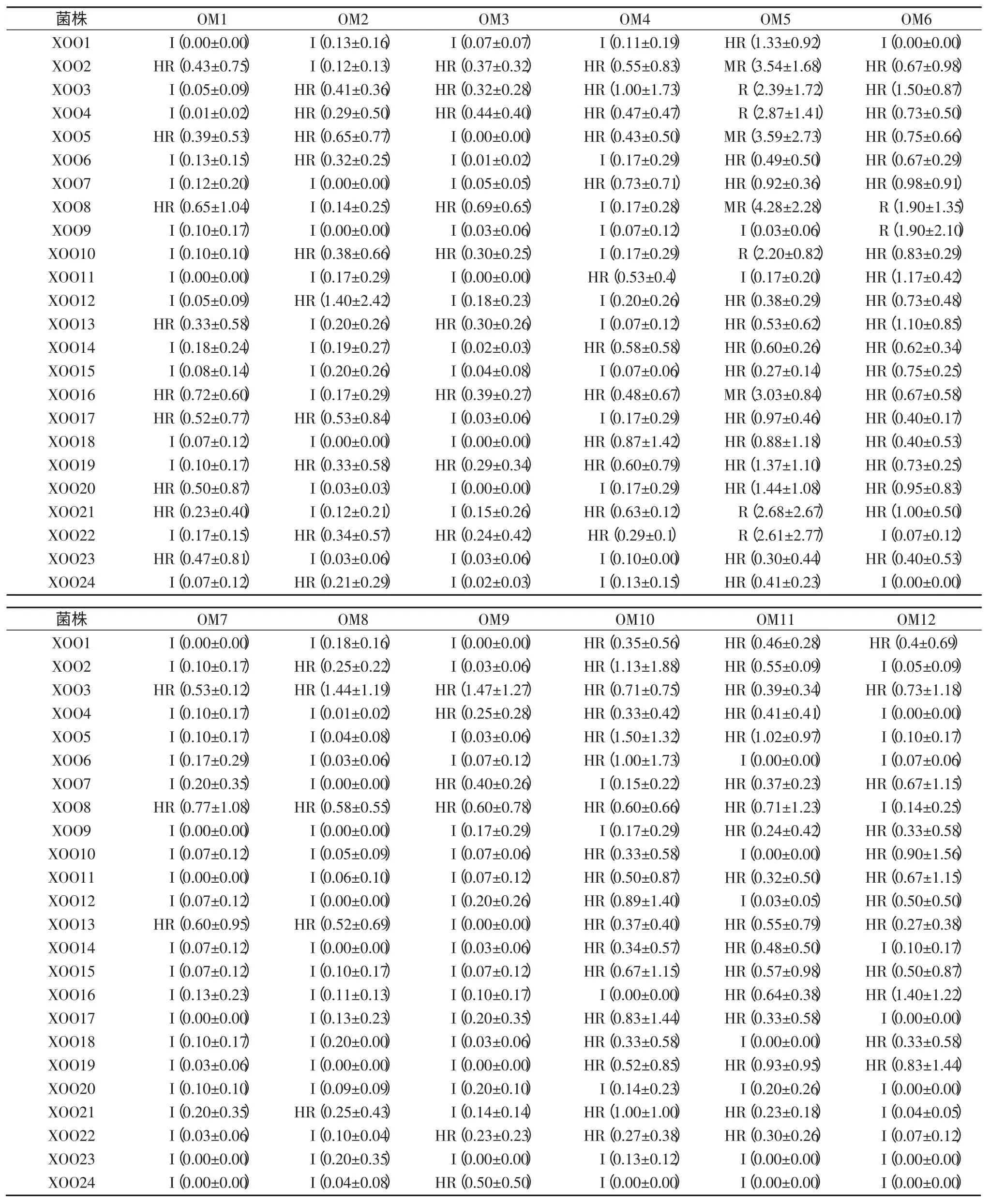
表7 云南疣粒野生稻不同居群对24 个菌株的抗感反应
3.2 评价疣粒野生稻抗性存在的问题
由于寄主与病原菌之间存在互作关系,互作关系为亲和关系时,植物寄主表现感病,互作关系为非亲和关系时,植物寄主表现抗病[14]。所以,评价寄主抗性时,应采用不同的生理小种进行鉴定,以便最大限度鉴定出抗相应小种的抗源,同时能较清楚抗源的抗谱,为充分发掘抗病基因奠定基础。野生稻含有优良的抗性基因,为了筛选出广谱抗性基因,本研究选用不同的生理小种评价疣粒野生稻的抗性,从中筛选出多份广谱高抗白叶枯病抗源。寄主与病原菌之间还存在协同进化的关系,当一个新的抗病品种大量推广后,病菌方面就有相应的新小种产生和流行,并导致抗病品种的抗性“丧失”,因而监测抗病品种的抗性也必须坚持不懈地进行[15]。疣粒野生稻对过去的菌株处于高抗到免疫的程度,了解疣粒野生稻是否对最近几年流行的小种具有抗性尤其重要。从本研究结果可见,值得庆幸的是,云南疣粒野生稻对目前在云南流行的小种基本都还处于非亲和关系。
目前,疣粒野生稻的抗性评价标准存在争议。章琦等[12]认为,病斑占叶面积百分率较能反应试材的实际抗性水平,然而疣粒野生稻同一株叶片长短差异较大,短的才5 cm 左右,长的有20 cm 左右,若病斑都是2 cm,对于短的叶片来说就是高感,对于长的叶片就是中抗,那很难判定其抗感性。程在全等[13]以病斑长度为3 cm 作为抗感界限评价疣粒野生稻抗性,而其文中的病斑最长才3.2 cm,就被认为感病。所以,笔者认为,疣粒野生稻抗性评价标准还是应以国际分级标准更为合理,即病斑长度小于0.2 cm 为免疫,0.2~1.5 cm 为高抗,1.6~3.0 cm 为抗,3.1~6.0 cm 为中抗,6.1~9.0 cm 为中感,9.1~20.0 cm 为感,大于 20.0 cm 为高感,同时应在对照品种的病情发展趋于稳定时进行调查。然后,根据相应结果优先选取高抗的材料用于遗传研究和品种改良,从而最大限度避免以上存在的问题。
本研究发现,云南疣粒野生稻对白叶枯病的抗性与地理位置无关,同一居群的材料有高抗甚至免疫的材料,也存在抗性稍差的材料。其余野生稻,如普通野生稻也存在类似情况[12,16],可能因为大多数的野生稻柱头大而外露,异交结实率较高,造成同一地点采集的材料并不是1 个抗性纯合体[12]。这提示我们,在野生稻接种鉴定时,同一居群应选取3 株以上进行考察,或首先应对参试材料进行亲缘关系分析,分类之后再开展抗性鉴定试验,从而充分的发掘出新的抗源。
