探究化工流程题中碳酸氢盐作沉淀剂的反应原理
2020-06-11郝纬
郝 纬
在实验复习中我们总结出除杂问题有以下几种方法,例如,除去Ca2+可以加入可溶性碳酸盐类;除去Ba2+可以加入可溶性硫酸盐类;除去Cu2+、Fe3+可以将其转化为氢氧化物.但往往到了化工流程题中,有不少考查内容和学生所学知识有冲突,如下题:
题目(2019年全国卷Ⅲ,节选)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如图1所示.回答下列问题:
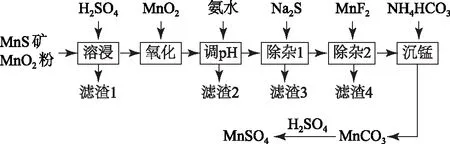
图1
写出“沉锰”的离子方程式________.
相信各学校一线教师都给学生练习过高考真题,但学生的答题情况并不尽如人意.对此,笔者询问过学生,学生的说法不一而足.有下面几类:
1)没有学过锰的相关知识,所以无从下手.
2)碳酸氢盐都可溶,不能理解可溶性锰盐与NH4HCO3为什么能够反应.
3)类似于侯氏制碱法,先生成溶解度较小的小苏打,再加热分解可获得苏打,故方程式分别为
但本题的流程中并没有明显的2个步骤,故此认为说法也不成立.
4)平时课外做题量较大,曾经做过类似的题目,因此做对了.
在“一核四层四翼”高考评价体系指导下,我们应该培养学生具备一定的分析问题、解决问题的能力.笔者决定以这个问题为契机,用中学实验室常见的药品,设计一节实验探究课,拓展学生思维深度和广度,训练学生灵活运用知识的能力.实验设计如下:
教师引导(以下简称教师):请用所学知识,预测NaHCO3和CaCl2能否发生反应.
学生预测1:能反应.
学生预测2:不能反应.
教师:请设计实验验证,根据浓度不同分组实验,并对比实验现象.
学生:查溶解性表配制药品:1mol·L-1CaCl2溶液和1mol·L-1NaHCO3溶液(接近饱和).
1)各取1mL1mol·L-1CaCl2溶液和1mL1mol·L-1NaHCO3溶液,将两种溶液混合.
2)将两溶液均稀释为0.1mol·L-1,再等体积混合.
教师: 如何证明沉淀的生成.
学生:静置后吸出上层清液,再加水稀释,沉淀不再溶解,说明生成的沉淀是CaCO3.
教师: 如何验证反应后溶液的成分.
学生:1)根据质量守恒判断肯定有NaCl.
2)用pH试纸测得pH约为5,说明应该生成弱酸性物质,根据元素守恒分析,可以判断另一成分应该为碳酸.
3)用酒精灯加热上层清液,冷却后再测量,pH升高,接近7,证明确实为碳酸.
教师:请写出CaCl2溶液和NaHCO3溶液反应的离子方程式.能否从平衡常数角度分析该反应发生的可能性.

Ka2=5.6×10-11.

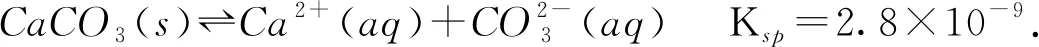
该方程的平衡常数K=Ka2/(Ka1×Ksp)≈4.7×104.经过计算,该反应是可以进行的.
通过以上实验探究,学生对于工业上用碳酸氢盐作为沉淀剂有了一个既直观又有理论依据的认识.有些学生会提出问题,为什么不用碳酸盐直接作为沉淀剂呢?我们可以就势引导学生利用侯氏制碱法思考,原来工业上先获得小苏打,再高温分解获得苏打,那么成本必定是小苏打更低一些.
如何实现德才兼备、全面发展的育人目标一直是教师要思考的问题.只有把学生的需求和社会的需求有机结合,从学生的实际学情分析出发,抛弃刷题模式,调动学生的动手能力,综合运用沉淀原理、弱电解质电离原理、水解原理等各种理论能力,才能助力学生学业减负增效及教育教学提质达标.
