硼掺杂金刚石薄膜电极降解青霉素G钠废水机制
2020-06-11曲有鹏吕江维冯玉杰
曲有鹏,吕江维,冯玉杰,张 杰
(1.城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090; 2.哈尔滨工业大学 生命科学与技术学院,哈尔滨 150080; 3.哈尔滨商业大学 药学院,哈尔滨 150076)
制药废水是最难处理的工业废水之一,特别是含有抗生素的制药废水,由于废水中残留的抗生素和高质量浓度有机物导致传统的好氧生物处理法无法达到预期的处理效果,而厌氧处理高质量浓度的有机物又难以满足出水达标的要求.研究适合其污染物处理的技术工艺已经迫在眉睫[1-2].在众多抗生素中,β-内酰胺类抗生素是使用最广泛的一类,由于其生产存在着原料利用率低、提炼纯度低等诸多问题,导致生产废水中残留抗生素及其中间代谢产物含量过高,生物毒性很大,极大地影响了该类抗生素废水的处理效果[3-4].
电催化法由于能产生具有强氧化能力的活性基团,可以用于抗生素废水等很多难降解废水的处理[5-8].该法可以破坏或降低抗生素的活性,使废水中难生物降解的物质转化为易生物降解的物质,增加废水的可生化性[9].与其他生物处理方法相结合,对于抗生素废水这类典型的难降解废水的处理尤其有意义.20世纪90年代,Carey等[10]将硼掺杂金刚石(boron-doped diamond, BDD)薄膜电极用于废水处理中,该电极属于具有高析氧过电位的“非活性”电极材料,阳极氧化时可以产生较多的弱吸附羟基自由基,可以非选择性地氧化有机污染物;并且在高氧化电位下具有很好的电极稳定性,有机物的吸附性弱,可以避免电极被有机物吸附而导致的污染.电极的电势窗口较宽,电流效率较高[11-14].
基于此,以最典型的β-内酰胺类抗生素青霉素G钠为研究对象,采用电催化氧化工艺,利用具有高催化活性的BDD阳极材料处理制药废水中的青霉素类物质,研究青霉素在BDD电极上的电化学降解规律及相应的降解历程,为后续结合生物处理提供基础数据,对提高抗生素废水处理的效率和经济性具有重要作用.
1 实 验
1.1 试剂与仪器
氢气、甲烷纯度99.999%,哈尔滨黎明气体集团.硅片,上海君合电子材料有限公司.Ti板,宝鸡宝冶钛镍制造公司.硼酸三甲酯,分析纯,上海阿拉丁生化科技股份有限公司;Na2SO4,分析纯,广东汕头西陇化工厂;青霉素G钠(1 650 U/mg),上海阿拉丁生化科技股份有限公司;磷酸二氢钾、乙酸铵、乙腈、甲酸,均为色谱纯,上海阿拉丁生化科技股份有限公司.
Waters 486液相色谱仪(Waters)、ACQUITY Ultra Performance LC液相色谱(Waters)、6520 Accurate-Mass Q-TOF LC/MS质谱(Agilent)、DR3900型COD快速测定仪(美国HACH)、PB-10型pH计(德国Sartorius).
1.2 实验过程
1.2.1 BDD电极的制备
采用直流等离子体化学气相沉积方法制备BDD薄膜,反应气体为CH4、H2和B(OCH3)3,三者体积比5∶190∶10,以H2为载气将挥发的B(OCH3)3带入反应腔体,通过系统正负极高压辉光放电,电压控制在700~800 V,电流控制在7.0~9.0 A,使CH4解离将碳沉积于基体材料重掺杂单晶Si表面,沉积Si片温度控制在1 000 ℃.电极制备的实验装置见文献[15].
1.2.2 青霉素G钠降解实验
选取典型的抗生素青霉素进行降解研究,以青霉素G钠为目标物模拟青霉素废水.将BDD电极固定在自制的电催化反应器上,反应器由有机玻璃制成,装置见文献[16].直流稳流电源输出提供恒定的电流,阳极BDD电极,阴极Ti板,磁力搅拌器进行降解实验搅拌,两电极间距为2 cm,BDD电极的有效面积为4 cm2.配置含一定质量浓度的青霉素G钠溶液,电解质为0.1 mol/L的Na2SO4,溶液体积85 mL.在不同质量浓度和不同电流密度条件下研究BDD电极降解青霉素G钠的电化学特性,取降解不同时刻的溶液测定青霉素G钠的质量浓度、化学需氧量(chemical oxygen demand, COD).
采用高效液相色谱法(high performance liquid chromatography, HPLC)测定青霉素G钠的质量浓度,色谱仪为Waters 486,色谱柱为XB-C18.采用紫外检测器,检测波长225 nm,流动相为0.05 mol/L的磷酸二氢钾(用磷酸调节pH为2.5)和乙腈溶液,V磷酸二氢钾∶V乙腈=60∶40,流速1 mL/min,进样量20 μL.
采用美国HACH的DR3900型COD快速测定仪测定溶液降解过程的COD变化,每次消解管中样品量为2 mL,加入1 mL重铬酸钾-硫酸汞溶液和4 mL硫酸银-硫酸溶液,摇匀后,在165 ℃消解15 min,消解后样品用测定仪测定COD.
1.2.3 青霉素降解历程分析
对青霉素G钠在BDD电极上的电化学降解历程进行了研究,配置质量浓度500 mg/L青霉素G钠,电流密度为10 mA/cm2,取不同时刻0,2,4,6,8 h的电解液采用液相色谱-质谱法(liquid chromatography-mass spectrometry, LC-MS)测定降解过程产生的中间产物.液相色谱为ACQUITY Ultra Performance LC (Waters),液相色谱柱为ACQUITY UPLC® BEH C18 1.7 μm 2.1×100 mm,流动相A为0.1%甲酸-1 mmol/L乙酸铵水溶液,流动相B为含0.1%甲酸的乙腈,梯度洗脱程序:0~5.0 min 95%~50%A,5.0~7.0 min 50%~95%A,流速0.2 mL/min,进样量5 μL.质谱为6520 Accurate-Mass Q-TOF LC/MS (Agilent公司),电喷雾电离,正离子(ESI+)模式.
2 结果与讨论
2.1 不同质量浓度青霉素的降解规律
选择质量浓度为500和100 mg/L的青霉素G钠溶液进行降解,图1为在电流密度10 mA/cm2条件下测试得到的青霉素G钠和COD的去除率曲线.可以看出,高质量浓度500 mg/L和低质量浓度100 mg/L的青霉素G钠均能够完全去除,分别在6和4 h时去除率达到100%,且降解终点这两个质量浓度的COD去除率几乎达到100%,这说明青霉素G钠在BDD电极上主要发生电化学燃烧反应[17],高低的两个初始质量浓度,青霉素G钠均能被完全矿化.但COD的去除要较青霉素G钠的去除慢,高质量浓度和低质量浓度在10和8 h的去除率分别达到93.1%和98.2%,并且降解不同质量浓度青霉素G钠,达到相同降解效果或相同COD去除率时所需反应时间的增长倍数小于青霉素G钠质量浓度的增长倍数.例如当质量浓度由100 mg/L提高到500 mg/L时,青霉素G钠在BDD电极上去除所需时间由4 h增加至6 h,增加1.50倍,而COD去除所需时间分别为8和10 h,增加1.25倍.由公式Q=I·t可知,在电流密度相同的条件下电催化消耗电量与时间呈正比,即两个质量浓度下青霉素G钠和COD去除所需能耗分别增加1.50倍和1.25倍,均小于质量浓度的增长倍数5.由此可以看出,BDD电极更适合于高质量浓度有机污染物的治理,能够缩短反应时间,降低能耗.
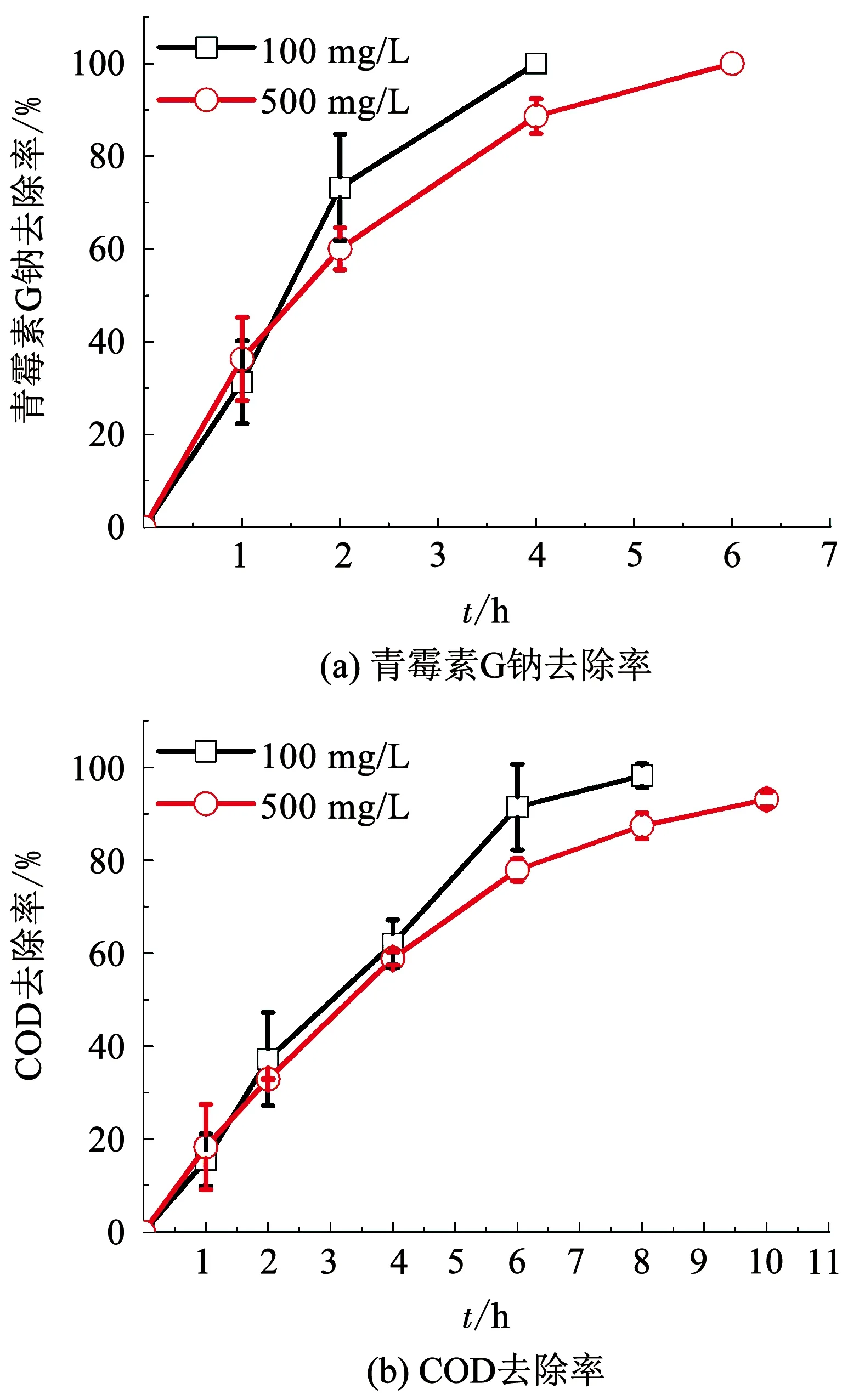
图1 电流密度10 mA/cm2条件下不同质量浓度青霉素G钠的降解
Fig.1 Degradation of penicillin G sodium of different concentrations at current density of 10 mA/cm2
根据式(1)计算BDD电极降解不同质量浓度青霉素G钠的电流效率(current efficiency,EC)[18],结果见图2.
(1)
式中:ΔCOD为COD的去除量(mg/L),F为法拉第常数(96 480 C/mol),V为溶液体积(L),Δt为降解时间(s),I为电流强度(A).
随降解进行,两个质量浓度青霉素G钠溶液的EC都有逐渐降低的趋势,但二者的EC数值差别很大.分析认为青霉素G钠在BDD电极上的氧化反应速度较快,电极过程的控制步骤为液相传质控制,EC与溶液中有机物质量浓度成正比,随着溶液中有机物的不断降低,这两个质量浓度条件下的EC均呈逐渐降低的趋势,所以,对于BDD电极这种氧化反应速度快的电极,处理高质量浓度有机物能够达到较高的EC.

图2 电流密度10 mA/cm2条件下不同质量浓度青霉素G钠在不同时刻的电流效率(EC)
Fig.2ECof penicillin G sodium of different concentrations at different time at current density of 10 mA/cm2
2.2 不同电流密度条件下青霉素的降解规律
对青霉素G钠溶液在不同电流密度条件下的降解情况进行测试,结果如图3所示.提高电流密度,青霉素G钠的降解速率及COD的去除都有显著增加.当电流密度从10 mA/cm2增加到20 mA/cm2,青霉素G钠完全去除时间由6 h缩短到4 h,COD的去除时间也由10 h(对应去除率93.1%)缩短到8 h(对应去除率94.3%).
对青霉素G钠的降解曲线和COD曲线进行反应动力学拟合,如图4所示,发现青霉素G钠质量浓度及COD的对数与反应时间线性相关,线性相关系数接近1,说明降解反应符合一级动力学方程,即[18]
ρ(t)=ρ0e-kt.
(2)
式中:k为反应速率常数,ρ(t)为t时刻反应物的质量浓度或COD,ρ0为初始反应物质量浓度或COD初始值,拟合结果也列于图4中.反应速率常数随电流密度增加而明显增加.当电流密度从10 mA/cm2提高至20 mA/cm2时,青霉素G钠和COD的反应速率常数分别增加了51.3%和29.1%.说明提高电流密度能够加快降解反应,缩短反应时间.

图3 不同电流密度条件下青霉素G钠和COD的变化
Fig.3 Variation curves of penicillin G sodium and COD at different current densities
计算不同时刻这两个电流密度条件下降解青霉素G钠的EC,结果如图5所示.随降解进行两个电流密度条件下的EC均呈逐渐降低的趋势,这与溶液中的有机物质量浓度逐渐降低有关,与前面实验结果(图2)得到的规律一致.每个时刻电流密度20 mA/cm2对应的EC均低于10 mA/cm2对应的EC,提高电流密度导致EC明显降低.对于BDD电极这种“非活性”电极材料,依靠电化学过程产生的高活性基团(如·OH等)氧化有机物的间接电化学过程被认为是有机物降解的主要途径,该过程产生的高活性基团同时也发生副反应(如析氧反应)被消耗,副反应被认为是降低EC的主要原因.在相同的有机物质量浓度条件下,且液相传质为反应的控制步骤时,尽管高电流密度形成的高活性基团较多,但接触反应的有机物质量浓度一定时,过多的活性基团之间发生副反应的机率更大,这是导致高电流密度下EC反而降低的原因.

图4 不同电流密度条件下青霉素G钠和COD变化的动力学拟合曲线
Fig.4 Kinetic fit curves of penicillin G sodium and COD at different current densities
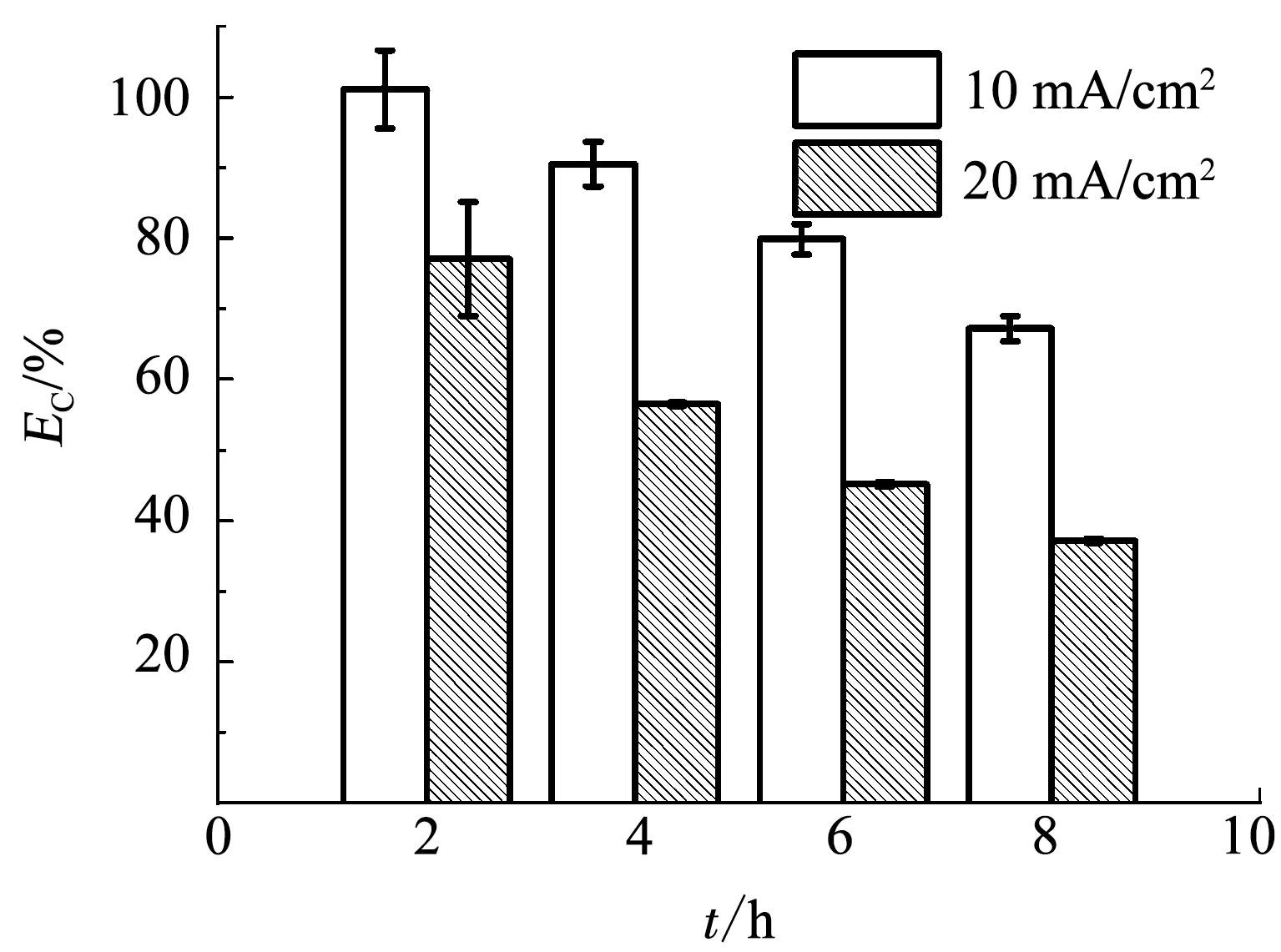
图5 不同电流密度条件下降解500 mg/L青霉素G钠溶液的电流效率(EC)
Fig.5ECof degradation of 500 mg/L penicillin G sodium solution at different current densities
2.3 青霉素降解历程分析
对青霉素G钠在BDD电极上的电化学降解历程进行了研究,图6为电解不同时刻的总离子流色谱图.

图6 降解不同时刻电解液的总离子流色谱
Fig.6 Total ions chromatograph of electrolyte at different degradation time
利用LC-MS分析降解过程的中间产物,共检测到13种化合物(标号a~m).文献报道,青霉素G的β-内酰胺环不稳定,在水溶液中发生的反应比较复杂.在pH=2的溶液中易发生重排生成青霉酸(penillic acid),在pH=4的溶液中易生成青霉烯酸(penicillenic acid)[19-20].青霉素G生成的青霉酸还会再转变形成异构青霉酸(isopenillic acid)[21].根据检测结果,化合物a的m/z=335,确定为青霉素G.化合物b、c、m的m/z均为=335,因此,这3种化合物为青霉酸、异构青霉酸和青霉烯酸.青霉素G的β-内酰胺环开环后形成一个羧基易生成青霉噻唑酸(penicilloic acid)[21],化合物d的m/z=353,确定d为青霉噻唑酸.化合物e、f、g、h的m/z=351,根据青霉素G的结构分析得到了降解过程可能的4种不同结构的中间产物;化合物k的m/z=367,化合物l的m/z=180,化合物i的m/z=274,化合物j的m/z=318,根据降解过程推测了可能对应中间产物的结构.限于篇幅,降解过程中前2 h生成的几种主要酸性中间产物的质谱数据列于表1.青霉素G在BDD电极上可能发生的降解历程如图7所示.

表1 部分主要降解产物的LC-MS数据
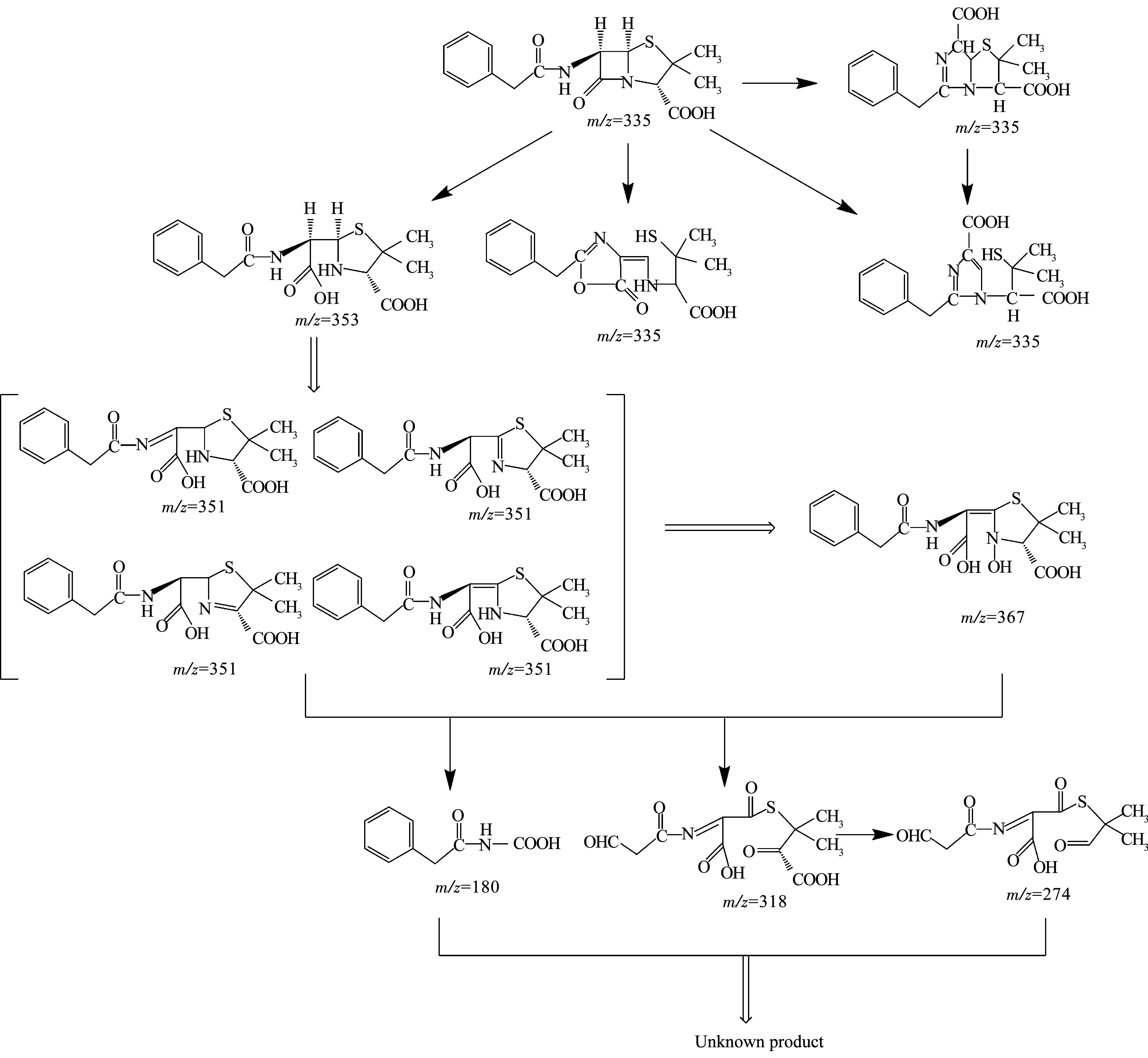
图7 青霉素G在BDD电极上的降解途径
3 结 论
1)青霉素G钠在BDD电极上发生电化学燃烧反应,降解中有酸性中间产物生成,并且可以完全降解.
2)青霉素G钠和COD的去除均符合一级反应动力学,电流密度为10和20 mA/cm2时,青霉素G钠的反应速率常数分别为0.546 9和0.827 5 h-1,COD的反应速率常数分别为0.271 7和0.350 7 h-1.
3)降解过程主要受液相传质过程控制,EC与青霉素G钠的质量浓度和电流密度有关.
4)得到了青霉素G在BDD电极上的降解途径,青霉素G分子发生分子内的异构重排生成酸性中间产物青霉酸、异构青霉酸和青霉烯酸,再进一步打开β-内酰胺环形成青霉噻唑酸,最后逐级降解为不同的中间产物.
