牵引辅助下胃镜胃空肠吻合术的动物实验研究▲
2020-06-11许佳祥方植力白俊杰卓锦辉范晓玲董芳芬
许佳祥 方植力 白俊杰 罗 犇 卓锦辉 范晓玲 董芳芬 施 宏
(1 福建医科大学临床医学部,福州市 350122;2 福建医科大学附属协和医院,福州市 350001;3 福建医科大学附属肿瘤医院、福建省肿瘤医院,福州市 350014)
胃空肠吻合/旁路手术可实现肥胖减重或缓解良恶性胃输出道梗阻[1-2],该项技术目前多在开放/腹腔镜下进行,存在相应的手术并发症[3-4]。随着内镜技术的发展,超声内镜(endoscopic ultrasonography,EUS)或经自然腔道内镜外科(natural orifice transluminal endoscopic surgery,NOTES)下胃空肠双蘑菇头支架置入逐渐用于临床,但胃空肠窦道成熟后,尚需经胃镜取出支架[5-7]。牙线牵引技术在临床上常用于内镜黏膜下剥离,可提高剥离效率[8-9]。本研究借助体外牙线牵引,尝试进行经胃内镜下胃空肠间断吻合存活动物实验获得成功,现报告如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 南京军区福州总医院比较医学科提供的巴马小型猪3只,雌雄不限,体重15~20 kg,术前24 h禁食、12 h禁水。将实验猪随机分为两组:非存活组1只,存活组2只。
1.1.2 实验仪器及试剂 双孔道胃镜(Olympus GIF-2TQ260M)及其附件[钩刀(KD650LR),dual刀(KD-620LR),热活检钳(FD-410LR),口圈咽保护套管,15-16.5-18CRE三级球囊(Boston),抓钳(FG-4L-1),钛夹(HX-610-135L)及尼龙绳(MAJ-340)];动物手术器械。试剂:盐酸肾上腺素注射液、阿托品注射液、氯胺酮注射液、咪达唑仑注射液、乳酸左氧氟沙星氯化钠注射液、青霉素钠、亚甲蓝染液。
1.1.3 麻醉方法 10 mg阿托品1支+100 mg氯胺酮 6支肌注麻醉诱导。实验猪取仰卧位,头高脚低约15°,予心电监护、气管插管,氯胺酮+咪达唑仑静脉维持麻醉,根据心率、呼吸情况调整静脉滴数。
1.2 方法
1.2.1 手术操作 (1)胃壁造口:经口插入无菌口圈咽保护套管,胃镜经套管进入胃内,选取胃窦体交界前壁近大弯位置,钩刀“一”字全层切开1.5~2.0 cm长胃壁后,胃镜进入腹腔。如造口偏小,胃镜进出不畅,可再用球囊扩张导管补充扩张。(2)选取造口附近游离空肠拖入胃内,采用牙线牵引暴露并稳定目标肠管,胃镜探查腹腔,辨认邻近空肠肠管,退镜。经一孔道置入装有钛夹的钛夹推送器,夹脚根部系一牙线[10-12],重新进镜,经胃壁造口到达目标肠管,经胃镜另一孔道送入抓钳,抓取肠管对系膜缘拖入胃内造口,此时将系有牙线的钛夹夹住目标肠管,同时释放钛夹,牙线即与胃镜分离。调整牙线张力、方向,保持肠管位置稳定。(3)采用尼龙绳联合钛夹方式完成胃黏膜-空肠浆肌层间断缝合:利用双孔道胃镜优势,将一孔道送入尼龙圈套置于胃壁造口处,另一孔道送入钛夹推送器,在双孔道配合下先将尼龙圈套一臂夹于胃壁黏膜上,再将另外一臂夹于空肠浆肌层,收紧并释放尼龙圈套,完成一对荷包缝合。重复上述步骤,借助尼龙绳、钛夹配合,完成4~6对胃黏膜面-空肠浆肌层荷包缝合,每点间距5 mm。(4)全层切开目标肠管对系膜缘肠壁,直至暴露肠腔。
1.2.2 术后处理 (1)术后管理:非存活组术毕即刻尸解,吻合口亚甲蓝测漏。存活组术后禁食48 h、禁水12 h,禁食期间经静脉滴注青霉素钠(80万U)、乳酸左氧氟沙星氯化钠注射液(100 mL ∶0.2 g),2次/d,持续2 d。术后第3天起改为进流食,术后1周尸解,观察腹腔感染情况及吻合口生长程度。
1.3 观察指标 记录手术时间、腹腔感染、脏器损伤情况以及吻合口生长程度;观察存活组的精神、进食、排便等术后状态。
2 结 果
2.1 非存活组 手术时间41 min,术中呼吸循环平稳,内镜下荷包缝合效果满意,无严重出血(图1A)。术毕即刻尸解,腹腔未见脏器损伤、无明显积血;胃肠吻合口长约1.5 cm,间断缝合4对(图1B),亚甲蓝测漏阴性。病理切片结果:胃肠吻合处肌层断裂,未见肌层融合现象,未见纤维组织增生,亦未见炎症细胞浸润(图1C)。
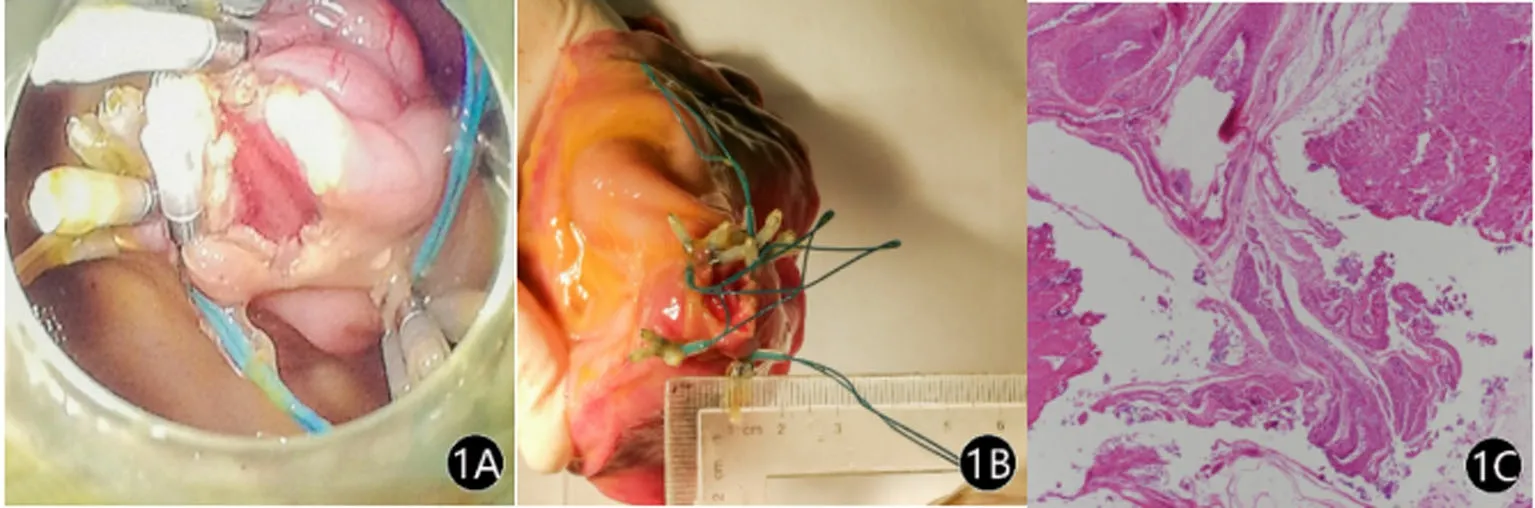
图1 非存活组的术中情况及术后尸解结果
注:图1A为内镜下荷包缝合;图1B为胃空肠吻合口;图1C为病理切片结果—可见胃肠吻合处肌层断裂,未见肌层融合现象,未见纤维组织增生,亦未见炎症细胞浸润。
2.2 存活组 内镜下牙线牵引辅助下的荷包缝合效果满意(图2A)。两只动物手术分别用时 35 min和24 min,术中呼吸循环平稳,无严重出血,术后均存活。第1只于术后第4天呕吐胆汁,复查胃镜见吻合口位置肠管黏膜明显水肿,附有脓性分泌物,考虑局部感染导致肠管水肿,影响胃肠推进性蠕动,予球囊扩张导管扩张促进胃肠贴合后,生理盐水反复冲洗吻合口,处理后未再出现呕吐。另一只术中术后一切平稳。术后7 d尸解:腹腔未见脏器损伤、未见积血及感染征象(图2B);胃空肠吻合口连接良好,胃黏膜与空肠黏膜对接满意(图2C),吻合口直径1.9~2.0 cm,亚甲蓝测漏阴性(图2D)。吻合口病理观察:胃空肠黏膜连接处可见胃黏膜结构,层次清晰,肠黏膜面消失,代之以肉芽组织,肉芽组织内可见内陷的肠黏膜(图2E);肌层连接处可见大量纤维组织增生,连接紧密,可见炎症细胞浸润(图2F);黏膜面连接处连接紧密,2种不同组织之间出现修复反应,即可见大量纤维组织增生(图2G);部分区域纤维组织中可见以淋巴细胞为主的炎症细胞浸润(图2H)。
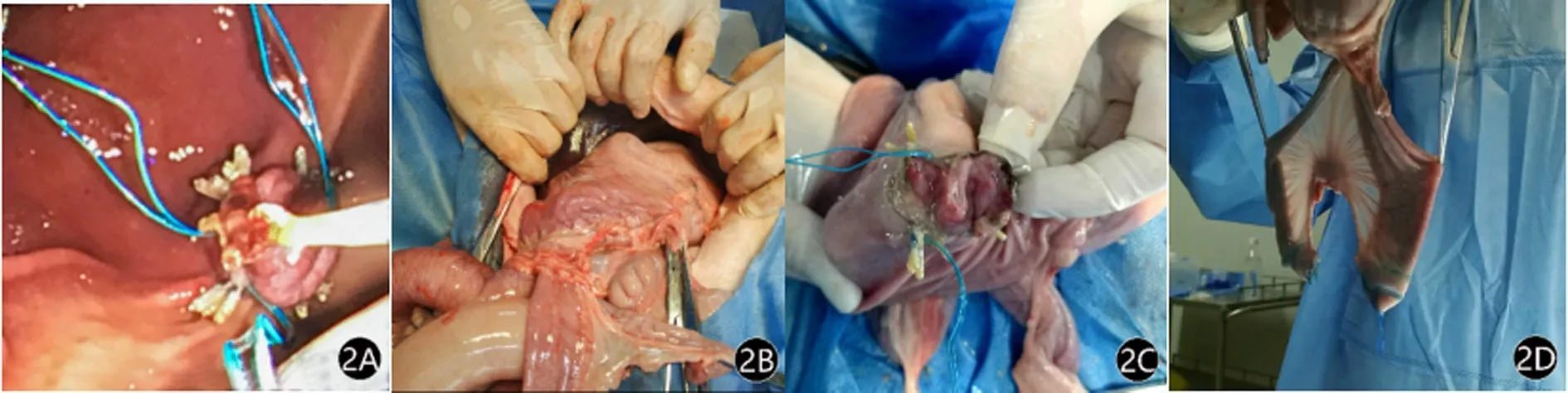

图2 存活组的术中表现及术后尸解结果
注:图2A为内镜下牙线牵引辅助下的荷包缝合;图2B为解剖观察腹腔未出现感染;图2C为胃空肠吻合口;图2D为亚甲蓝测漏阴性;图2E、图2F、图2G、图2H为吻合口的病理切片结果—黏膜连接处可见胃黏膜结构,层次清晰,肠黏膜面消失,代之以肉芽组织(图2E);肌层连接处可见大量纤维组织增生,连接紧密,可见炎症细胞浸润(图2F);肠黏膜坏死,黏膜面可见液化空洞,部分空洞内见残存的肠黏膜,黏膜层及黏膜下层可见大量纤维组织及血管增生,纤维组织间可见出血(图2G);黏膜面连接处,上为肠黏膜、下为胃黏膜,连接紧密,两种不同组织之间修复反应,即可见大量纤维组织增生(图2H)。
3 讨 论
EUS/NOTES下胃空肠造口常需借助双蘑菇头支架实现,并于3~4周后窦道成熟再行支架移除[13-14]。就方式而言,EUS术式因胃壁造口位于后壁,内镜及其附件不必进入腹腔,几乎无术后感染风险,但手术非直视下操作,需在超声及透视引导下进行,具有放射损伤,并有胃结肠瘘等风险[15]。而NOTES术式全程直视,可同时探查腹腔并做活检,但因内镜入腹腔,术前必须灭菌。
本研究采用牙线外牵引辅助经胃镜胃空肠吻合术,与双蘑菇头支架胃空肠造口不同,更类似外科间断缝合技术[16]。选择窦体交界前壁近大弯处全层切开,血管少、胃周无网膜,快速安全;开口大小为1.5~2.0 cm,在保证吻合口通畅的同时可降低术后吻合口漏风险。空肠选取并经胃壁造口拖入胃腔后,借助牙线夹住空肠浆膜,使空肠不容易滑入腹腔,提高了手术成功率,并且明显缩短了胃肠吻合时间[17]。由于浆膜平滑,夹持难度高,故钳夹需充分吸引以夹取更多组织,但牙线牵引方向、数目应根据实际灵活掌握[18]。Qi等[19]采用两根牙线牵引保证了后继造口的安全进行。外牵引牙线虽不占用活检通道,但其与内镜路径一致,可能存在相互干扰,将来也可尝试内牵引方式[20]。此外,采用钛夹联合尼龙绳间断缝合方式将胃黏膜与空肠浆膜对合[17],两点间距为5 mm,借鉴外科手工缝合参数,疏密适中,可避免术后吻合口漏。
本研究3只实验猪手术均获成功。术毕即刻和术后7 d亚甲蓝测漏未见染料漏出,提示技术安全可行。存活组第1只实验猪术后第4天呕吐胆汁,复查胃镜见吻合口位置肠管黏膜明显水肿,附有脓性分泌物,予球囊扩张导管扩张促进胃肠贴合后,生理盐水反复冲洗吻合口,处理后未再出现呕吐,另一只术中术后一切平稳。1周后尸解仅吻合口局部黏膜肿胀,腹腔未见积脓、粘连征象,提示吻合口大小适中;胃肠吻合口病理切片观察吻合口连接良好,胃肌层与空肠肌层经由纤维基本对接,胃黏膜与空肠黏膜尚未完全对接,局部代以肉芽组织,表明机体具有强大的适应力与自我愈合能力。
本研究取得了较满意的结果,但尚有诸多不足:(1)目前胃镜用钛夹仅能夹取部分胃肠壁,无法做到全层钳夹,虽然三次亚甲蓝测漏均为阴性,术后仍有吻合口漏甚至脱离风险;(2)限于内镜视野及附件,本研究仅能大致选取造口附近肠管用以吻合,无法精确测量吻合口肠管与幽门距离,术后存在肠管扭转、牵拉、嵌顿风险。存活组中第1只实验猪进食后出现呕吐,复查胃镜见吻合口水肿严重,7 d后尸解见肠管距离幽门长度长于另一只,考虑为目标肠管距离过远,导致肠管扭转成角,肠内容物通过不畅所致。
综上所述,牵引辅助下经胃镜行胃空肠吻合术具有微创的效果,安全可行,未来有望应用于临床。
