TGF-β1及Smad4在大肠癌组织中的表达及临床意义
2020-06-11贾光辉赵永强
贾光辉,赵永强
乌兰察布市中心医院普外科,内蒙古乌兰察布 012000
大肠癌是当前人类众多疾病中非常常见的一种恶性肿瘤之一,在众多的肿瘤死亡原因中占据着较高的排名,并且正呈现出逐渐上升的趋势[1]。其发生发展是由于多因素参与作用的过程。当前在关于恶性肿瘤发生的癌基因众多的研究中,曾有专家学者提出多基因协同作用假说,他认为在肿瘤进行发生、发展以及转移的各个阶段,至少会有两个或者是两个以上功能不同的异常激活的癌基因在其中发挥着各自不同的作用[2]。而转化生长因子β是一类多功能的多肽类生长因子,TGF-β1是该家族中重要的一员[3]。TGF-β1在各种肿瘤中的过度表达以及临床病理特征与预后中具有着密切的关系。Smad 4基因则是定位于18q21染色体,其编码产物 Smad 4蛋白是 TGF-β信号转导通路中可以发挥出瓶颈作用的一个关键因子[4]。该研究通过采用免疫组织化学方法对于2017年1月—2018年12月该院60例大肠癌组织观察组与同期的正常人的大肠组织60例对照组检测TGF-β1及Smad4在大肠癌组织中的表达以及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
观察组为60例大肠癌组织,均采用该院部分大肠癌手术切术组织的石蜡标本,该次研究经过院伦理委员协会批准,患者均同意该次研究,并签署知情同意书。其中观察组男性35例,女性25例;年龄最小为32岁,最大为65岁,平均48.5岁。对照组正常人的大肠黏膜组织,同样具有60例,其中男性32例,女性28例;年龄最小为35岁,最大为71岁,平均53岁。其中结肠癌 50例,结肠炎50例,正常结肠黏膜20例。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
观察组和对照组同样经常规固定、脱水、石蜡包埋,4 μm切片等一系列操作处理,在经过切片之后,分别进行组织病理学检查以及免疫组化染色[5]。采用免疫组织化学SABC法进行免疫组化染色。用已知阳性染色组织切片作为阳性对照,阴性对照则是采用 PBS液代替一抗孵育已知阳性切片。兔抗人TGF-β1多克隆抗体为 Santa Cruz产品。兔抗人 Smad4多克隆抗体、即用型 SABC试剂盒以及DAB染色试剂盒均来自于武汉博士德生物工程有限公司。
具体的操作方法也就是观察组采用SABC法[6],切片经二甲苯脱蜡以及梯度酒精脱水,在滴加3%过氧化氢溶液之后,将其放置于室温下孵育10 min灭活内源性过氧化物酶,并经过 3次3 min的PBS冲洗之后,将其中滴加一抗,并再次进行60 min的室温孵育,以及PBS冲洗3 min 3次,滴加二抗,经30 min的室温孵育之后,3 min 3次的PBS冲洗,滴加SABC进行10 min的室温孵育,并经过蒸馏水冲洗、苏木素复染之后,对其进行脱水,等到其透明后观察中性树脂封片。
1.3 结果判定
TGF-β1以及 Smad4结果分析分别以文献[7]进行计分,按照分数的高低进行分类:0~1分为阴性或无表达(-);2~3分则是弱阳性表达(±);4~8分是阳性表达(+)。
1.4 统计方法
采用SPSS 21.0统计学软件进行数据处理,计数资料采用()进行表示,采用秩和检验,或 t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 观察组与对照组中的TGF-β1及Smad4表达
观察组中的TGF-β1的阳性率为75.5%(45/60),对照组的TGF-β1的阳性率为3.3%(2/60)。见表1。而观察组中的Smad4阳性率为93.3%(56/60),对照组的Smad4阳性率为 50.0%(30/60),差异有统计学意义(P<0.05),见表 2。

表1 观察组与对照组中的TGF-β1的表达Table 1 Expression of TGF-β1in observation group and control group

表2 观察组与对照组中的Smad4的表达Table 2 Smad4 expression in the observation group and the control group
2.2 TGF-β1及Smad4表达与大肠癌临床病理特征的关系
TGF-β1及Smad4的表达与大肠癌分化程度不具有关系差异无统计学意义(P>0.05);与临床Dukes分期具有明显的关系,并且伴随着病理特征的进展,其阳性率增加,差异有统计学意义(P<0.05),见表 3。
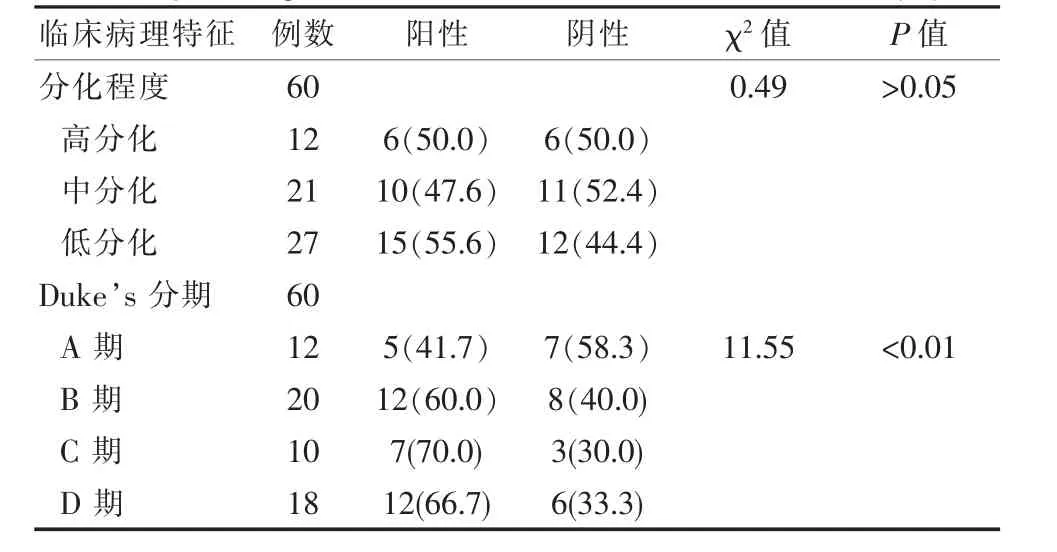
表 3 TGF-β1的表达与大肠癌临床病理特征的关系[n(%)]Table 3 Relationship between TGF-β1expression and clinicopathological characteristics of colorectal cancer[n(%)]
2.3 TGF-β1及Smad4在大肠癌组织中不同的TNM分期的表达
TGF-β1及Smad4表达存在着明显的下降,与肿瘤的肿瘤分期和分化程度具有着直接的关系,并且TGF-β1及Smad4在大肠癌组织中的 I期,II期,III期,IV期分期具有明显的关系,TGF-β1及Smad 4的缺失程度随胃肠肿瘤不同的TNM分期的进展而更加严重(P>0.05),见表4。

表4 TGF-β1及Smad4在大肠癌组织中不同的TNM分期的表达Table 4 Expression of TGF-β1and Smad4 in different TNM stages in colorectal cancer tissues
2.4 两组患者的生存率比较
经过1年时间的随访调查,两组患者的生存曲线见图1。

图1 生存时间Figure 1 Time to live
3 讨论
TGF-β1是一种具有多种生物学活性的多肽生长因子,TGF-β共有3种存在的形式,分别为 TGF-β1、TGF-β2、TGF-β3,这三者之间的生物学作用非常的相似,其中TGF-β1含量最高所以具有最高的代表性。它可以对于细胞的增殖、形态、分化形成双重作用。陈玉红等[8]专家学者发现TGF-β1可以有效抑制肿瘤细胞的生长,其在组织中的表达表现为正相关(r=0.491,P<0.01),该因子能有效介导肿瘤细胞凋亡。
该研究结果显示,观察组中的TGF-β1的阳性率为75.5%(45/60), 对照组的 TGF-β1的阳性率为 3.3%(2/60)。而观察组中的Smad4阳性率为93.3%(56/60),对照组的Smad4 阳性率为 50.0%(30/60),差异有统计学意义(P<0.05)。这与袁学敏与陈玉红等[8-9]的TGF-β1与 Smad4在大肠癌组织中的表达及意义的研究表达一致:大肠癌组织中Smad4蛋白的阳性表达率为44.8%,较正常对照组(95.8%)明显降低 (P<0.05);TGF-β1Smad4在大肠癌组织中的表达呈负相关(r=-0.521;P<0.01)。该研究结果显示,有转移的大肠癌组织中的TGF-β1的表达水平也会比无转移的大肠癌组织明显要高,这主要是因为TGF-β1的高表达与肿瘤转移具有直接的关系。发生该作用的可能机制在于:肿瘤组织中高表达的 TGF-β1会存在基因突变,并且会减弱细胞增殖、分化的双重作用,从而导致的形成与发生肿瘤;而高表达的 TGF-β1可以起到刺激肿瘤内血管形成的作用,并且还会使肿瘤细胞逃避机体免疫的监视,可能是由于其具有促进肿瘤转移的机制。
Smad4基因在最早的时候是由 Hahn等在胰腺癌中发现的,并且Smad4又称之为 DPC4基因。经过专家研究表明,Smad4属于抑癌基因,可以有效地抑制患者的肿瘤细胞的生长。 Smad 4在 TGF-β1信号转导中同样有着极为关键的作用,其发生缺失或者是突变都有可能会导致细胞对于 TGF-β1的生长抑制产生耐受,从而促进肿瘤的生长[8]。TGF-β信号传导中的唯一公共个体就是Smad4蛋白,经过TGF-β1的刺激,Smad4参与诱导 P15(Ink4B)转录,可以有效的抑制肿瘤细胞增殖[9]。
综上所述,经过对于 TGF-β1及 Smad4进行检测,可以帮助临床医生更加了解肿瘤的生物学行为,并且还能够有效地预测肿瘤的复发倾向,可以术后其他辅助治疗提供有用的信息,从而使肿瘤患者的愈后得到改善。
