β-内啡肽在RVLM吗啡预处理减轻大鼠心肌缺血再灌注损伤中的变化
2020-06-11徐凯生
徐凯生,张 丽,张 野
缺血性心脏病是当前致死率很高的疾病,如何减轻心肌缺血再灌注损伤(ischemia reperfusion injury,IRI)一直是研究热点[1-2]。缺血预处理(ischemia preconditioning,IPC)可以发挥较强的内源性心肌保护作用,内源性阿片肽系统在其中发挥重要作用[3]。研究[4]表明中枢吗啡预处理(morphine preconditioning,MPC)可以减轻心肌IRI,但其中发挥作用的具体核团与机制目前研究较少。头端延髓腹外侧区(rostral ventrolateral medullar, RVLM)在心脏调控中扮演了重要的角色,核团内含有丰富的阿片肽能受体以及多种神经递质,其中阿片肽等可通过抑制交感神经活动进而影响心血管活动[5-6]。现拟通过RVLM核团精确给药来探究该核团MPC对于IRI以及外周-β-内啡肽(β-endorphin, β-EP)含量的影响,探究外周β-EP在RVLM MPC发挥心肌保护作用中的变化。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康清洁级雄性成年SD大鼠72只,体质量280~320 g。购买并饲养于安徽医科大学实验动物中心。
1.1.2药物与试剂 盐酸吗啡注射液(1 ml ∶10 mg,批号:181101.1)购自沈阳第一制药厂;氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC,批号129K1867V)购自美国Sigma公司;兔抗c-Fos抗体(anti-c-Fos,批号EPR883.2)、鼠抗β-EP抗体(批号ab54205)购自美国Abcam公司;β-EP ELISA检测试剂盒(批号CEA806Ra)购自武汉优尔生公司;鼠抗β-Actin抗体、山羊抗兔和山羊抗鼠二抗购自北京中杉金桥生物科技有限公司;ECL发光试剂盒购自美国Thermo Fisher公司。
1.1.3仪器 ALC-V9型动物呼吸机购自上海奥尔科特生物科技有限公司;BL-420s型连接生物机能系统购自成都泰盟生物科技有限公司;桌面数显型脑立体定位仪和微型手持颅骨钻购自深圳瑞沃德生物科技有限公司;微量输注泵购自美国KDS公司;凝胶成像系统购自上海天能科技有限公司。
1.2 核团置管与心肌缺血再灌注模型建立苯巴比妥钠50 mg/kg腹腔注射麻醉大鼠后固定在立体定位仪上,于前后囟之间暴露颅骨,定位RVLM(坐标AP 12.2 mm, LR 2.2 mm,H 10 mm),手持钻钻孔突破颅骨后置入导管,用牙科粉固定后缝合皮肤,备用后期给药。置管后肌注青霉素10万U,均单笼饲养3 d,有感觉或运动障碍等情况的大鼠弃去。实验结束后,经给药管用微注射器注射0.25% Evan蓝100 nl,取脑切片,对照大鼠脑图谱确定注射位点准确。成功RVLM置管的大鼠,腹腔注射苯巴比妥钠50 mg/kg麻醉,麻醉维持每60~90 min后追加苯巴比妥钠25 mg/kg 1次。气管切开、插管后连接动物呼吸机行机械通气, 潮气量2~4 ml/kg,频率70~80 次,连接生物系统记录心电图(electrocardiogram,ECG)。沿左锁骨中线切开皮肤2 cm,在左4~5肋间打开胸腔,用撑开器撑开肋骨充分暴露心脏,剪开心包。在肺动脉圆锥与左心耳之间冠状静脉处以6-0 Prolene线穿过冠状动脉作一线结。稳定15 min后,扎紧线结即形成左冠状动脉闭塞致心肌缺血,表现其支配的局部心肌发绀、血压下降, ECG呈心肌梗死改变(ST段抬高或降低等),松开线结即可实现再灌注。
1.3 动物分组RVLM置管模型制备成功的SD大鼠72 只,随机均分为4组:假手术组(Sham组)、缺血再灌注组(IR组)、缺血预处理组(IPC组)和RVLM吗啡预处理组 (MPC组),缺血再灌注模型采用冠状动脉左前降支结扎30 min再灌注120 min,IPC方法为心肌缺血5 min再灌注5 min,重复处理3 次。Sham组、IR组和IPC组预先通过导管5 min内匀速注射0.9%生理盐水0.2 μl,间隔5 min后再次输注,重复3次,共输注0.6 μl。之后IR组进行缺血再灌注;IPC组在IR前进行IPC;MPC组:IR前核团注射吗啡 (5 min内匀速注射吗啡0.2 μl,停5 min,共3次,共输注0.6 μl,吗啡按1 μg/kg用生理盐水配制成0.6 μl)。
1.4 心电图监测监测心电图,于再灌注30 min内记录室性心律失常:室性早搏(premature ventricular contraction,PVCs)及室速/室颤(ventricular tachycardia/ventricular fibrillation,VT/VF)发生次数。
1.5 心肌梗死体积的测定实验结束后,采用颈椎脱臼法处死大鼠。取出心脏,去除非心脏组织,PBS灌注,冲洗出血液,扎紧左冠状动脉处的线结。从主动脉注入0.25% Evan溶液约5 ml。置-80 ℃冰箱速冻2 h。从心尖到结扎处平切5~6片,厚度2 mm。置1% TTC溶液, 37 ℃(pH 7.4)温孵10 min染色,用10%福尔马林固定12 h。Sigma Scan program 4图像分析软件计算左心室(left ventricle, LV)、右心室 (right ventricle,RV)、心脏缺血危险区 (area at risk,AAR)和梗死区(infarct size, IS)面积,×0.2即为各区体积,计算LV与RV体积之和,IS、AAR体积及IS/ARR比值。
1.6 Western blot检测c-Fos的相对表达量实验结束后,立即取出大脑,剥离大鼠RVLM核团区域,在预冷PBS中清洗去除血液,匀浆前称重。将组织切成均匀小块,放入冰上装有RIPA裂解液的匀浆器中匀浆,经过超声裂解至澄清,再将匀浆液3 500 r/min离心5 min,取上清液于-20 ℃下保存。实验前取上清液进行Western blot检测,在收集的蛋白样品中按1 ∶4加入上样缓存液,沸水浴加热10 min。样品冷却后进行10% SDS-PAGE电泳分离并转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,TBST洗涤后,分别加入actin一抗(稀释度1 ∶1 000)、c-Fos一抗(稀释度1 ∶1 000),4 ℃缓慢摇动孵育过夜。次日PBST洗涤3次每次10 min,二抗用山羊抗鼠IgG(1 ∶10 000)或山羊抗兔IgG(1 ∶20 000)室温孵育1 h,TBST漂洗3次,每次4 min,暗室进行ECL显影。采用凝胶成像系统拍照,通过Image J软件测定蛋白条带灰度值,以目的蛋白条带灰度值与actin条带灰度值的比值反映目的蛋白的表达水平。
1.7 脊髓、心肌免疫组织化学染色(immunohistochemistry, IHC)大鼠实验结束后脱颈处死,灌流后立即取出心脏和T2-5段脊髓,用4%多聚甲醛浸泡12 h以上,脱水、常规石蜡包埋、连续切片,厚度5 μm,脱腊后抗原高压修复,3% H2O2室温孵育20 min去除内源性过氧化物酶活性,PBS冲洗3次,加一抗37 ℃孵育1 h,PBS冲3次甩干加二抗37 ℃孵育20 min,PBS冲3遍甩干加DAB显色剂3 min,苏木精衬染后封片观察。镜下观察β-EP的阳性反应(细胞质染成棕色或褐色)并拍照。
1.8 ELISA试剂盒检测β-EP水平实验结束后取LV心肌、T2-5脊髓,放入-80 ℃保存。检测前提取组织蛋白严格按照β-EP检测试剂盒说明书进行操作,用酶标仪分别测定不同浓度标准品和各组脊髓、心肌样品在450 nm波长下的吸光度,计算各样品浓度。
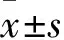
2 结果
2.1 心肌梗死体积各组LV+RV体积及AAR体积差异均无统计学意义(P>0.05);与Sham组比较,IR组的IS体积和IS/AAR比值升高(P<0.01);与IR组比较,IPC组和MPC组的IS体积、IS/AAR降低(F=47.08,P<0.05)。见图1。

图1 TTC染色法检测各组大鼠心肌梗死体积(n=6)
A:TTC染色; B:IS/AAR统计分析; C:AAR/(LV+RV)统计分析; 与Sham组比较:**P<0.01; 与IR组比较:#P<0.05
2.2 心律失常发生次数与Sham组比较,IR组的PVCs和VT/VF发生次数升高(P<0.01);与IR组比较,IPC组和MPC组的PVCs和VT/VF发生次数减少(F1=73.0,F2=46.03,P<0.01)。见表1。
2.3 c-Fos蛋白表达的检测结果Western blot结果显示IR组RVLM中c-Fos蛋白表达量较Sham组增高,差异有统计学意义(P<0.01);与IR组比较,IPC组和MPC组的c-Fos表达水平降低,差异有统计学意义(F=67.15,P<0.01)。见图2。

表1 各组大鼠PVCs和VT/VF发生次数的比较(次,n=6)
与Sham组比较:aP<0.01;与IR组比较:bP<0.01

图2 Western blot检测c-Fos蛋白表达水平(n=6)
与Sham组比较:**P<0.01;与IR组比较:##P<0.01
2.4 左心室肌和脊髓中β-EP表达的ELISA检测和IHC结果ELISA结果显示IR组T2-5脊髓和左心室肌中β-EP表达量较Sham组增高(P<0.01);与IR组比较,IPC组和MPC组脊髓和左心室肌中的β-EP表达增高,差异有统计学意义(F1=30.94,F2=11.49,P<0.01)。见图3。IHC的结果显示各组脊髓与左心室肌样本中内啡肽阳性反应大小差异与ELISA结果相同。见图4。
3 讨论
本研究参照大鼠脑图谱定位RVLM核团,参考文献[7-8]建立核团给药模型和大鼠心肌缺血再灌注损伤模型,并设置缺血预处理组作为对照。结果表明,大鼠缺血时结扎范围心肌发绀,心电图提示心肌缺血,TTC染色结果梗死明显,且IPC组较IR组梗死体积减少,证实缺血预处理和大鼠心肌缺血再灌注损伤模型制备是成功且稳定的,此模型可用于探究RVLM MPC对IRI的影响。研究结果表明RVLMMPC后减少了IR后恶性心律失常的发生次数,有助于改善心脏功能,并在一定程度上减轻了心肌IRI。
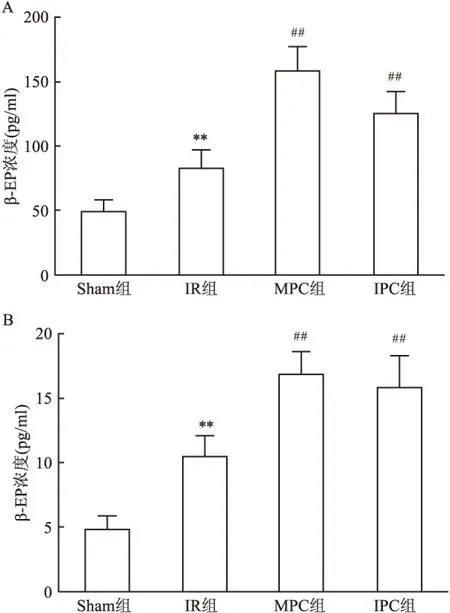
图3 ELISA法检测各组大鼠T2-5脊髓和左心室
A:T2-5脊髓;B:左心室心肌;与Sham组比较:**P<0.01;与IR组比较:##P<0.01
研究[9]发现心肌IR后可以引起大脑多个核团内c-Fos表达上调,侧脑室MPC可以降低心肌IR引起的孤束核内c-Fos高表达。有研究[10]发现抑制大鼠脑内c-Fos表达可降低有害性刺激引起的大鼠心血管反应。有报道[11-12]显示心肌缺血后T2-6脊髓背角SG区神经元兴奋性增高,鞘内MPC能降低心肌缺血引起的T2-6脊髓背角中c-Fos蛋白的高表达。c-Fos表达水平在一定程度上可以反映中枢伤害性神经元的兴奋性程度。本研究结果显示心肌IR后RVLM内c-Fos表达明显增高,而IPC和MPC可以减少c-Fos表达,提示RVLM MPC可能通过抑制心肌缺血后RVLM核团内伤害性神经元的兴奋性,进而产生对心肌缺血伤害性刺激的中枢调控作用。
有研究[13-14]证实EP在大鼠心肌缺血再灌注损伤模型中有一定的心肌保护作用,另外内源性阿片肽参与介导了IPC诱导的心脏保护作用。本研究结果也表明心肌IR会引起T2-5脊髓和左心室肌中β-EP含量增加,缺血预处理后β-EP含量更高。大量研究表明起源于心脏的内脏传入纤维的胞体位于T2-6节段的背根神经节(dorsal root ganglion, DRG),心脏的伤害性传入信息主要通过DRG进行第一级传导,之后通过迷走传入并终止与孤束核。而RVLM可以接受多个核团传入的兴奋性信号,其中就包括下丘脑室旁核、孤束核和延髓尾端加压区等核团,这些区域的变化将直接影响RVLM对交感输出和心血管功能的控制,可见RVLM、胸段脊髓与心脏之间有着密切的联系[15]。本研究结果表明RVLM MPC后,T2-5脊髓和左心室肌中EP含量明显增高,提示RVLM核团内阿片受体激活后通过激活中枢EP系统调节外周EP释放发挥心肌保护作用。

图4 IHC检测各组T2-5脊髓和左心室肌中β-EP的表达 ×20
综上所述,RVLM MPC降低了心肌IR后核团内c-Fos蛋白的表达水平,增加了脊髓和左心室肌组织内β-EP含量,β-EP可能介导了RVLM MPC所发挥的心肌保护作用,为研究心肌IRI的中枢调节机制提供了新靶点和方向。
