单次活检切除在喉显微激光治疗早期喉癌中的应用价值
2020-06-11董飞林郑怡苏立众
董飞林 郑怡 苏立众
喉显微激光手术无需气管切开及颈外开放入路,可以经口支撑喉镜下切除肿瘤组织,具有创伤小、恢复快、喉功能保留好等优点,近年来喉显微激光手术已普遍应用于治疗早期声门型喉癌[1-4]。但按传统喉癌手术方法常需术前先行活检病理确诊后再分次行肿瘤切除,增加了患者的手术风险及经济负担。随着喉显微激光技术的广泛应用,在早期喉癌治疗中,对于是否仍需先活检病理确诊后再分次手术切除,及部分病变局限的早期喉癌术后切缘快速冷冻病理的必要性,目前仍有待进一步商榷[5-8]。本文探讨单次活检切除在早期喉癌激光治疗中应用的可行性及意义。
1 临床资料
1.1 一般资料 回顾性分析2012 年10 月至2018 年10 月本院采用支撑喉镜显微镜下CO2激光治疗的早期喉癌且随访资料完整的病例82 例,均为男性,年龄42~83 岁,平均年龄61.7 岁。依据喉癌临床分期标准,其中Tis 9 例,T1a 36 例,T1b 17 例,T2 20 例。术后病理报告为鳞癌或局灶癌变。
1.2 治疗方法 所有患者均经全身麻醉后气管插管,置入支撑喉镜暴露喉内病变,调整显微镜(目乐 HIR1000/FS3-32),及CO2激光治疗仪(品牌:DEKA 型号:SmartXide HS)。根据不同病变范围选择不同激光功率(5~10W)进行切割。依据欧洲喉科协会2000年声带切除分型[9]:I 型为声带黏膜下切除术;Ⅱ型为声韧带下切除术;Ⅲ型为部分声带肌切除术;Ⅳ型为声带完全切除术;V 型为扩大声带切除术。其中又将V 型分为4 个亚型,分别是Va(包括对侧声带切除和前连合切除)、Vb(包括杓状软骨切除)、Vc(包括声门下切除)和Vd(包括室带切除),根据术中肿瘤范围的判断,采用不同的声带切除方法(见表1)。经活检病理确诊后二次手术切除35 例,单次手术切除47 例,其中因肿瘤范围局限直接单次手术活检切除18例(见图1),肿瘤范围较广结合术中快速冷冻病理确诊后同期手术切除29 例(见图2、表2);58 例术中做切缘快速冷冻病理,24 例行肿瘤切除术后认为安全边缘足够,未再做切缘的快速冷冻病理检查(见表3)。术毕仔细检查声带有无出血及病变残留,用盐水纱条擦去炭屑。

表1 声带切除分型(n)

表2 分次手术统计(n)
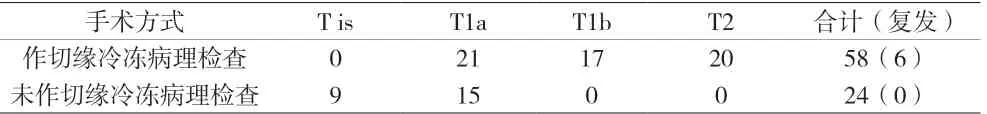
表3 术中切缘情况(n)
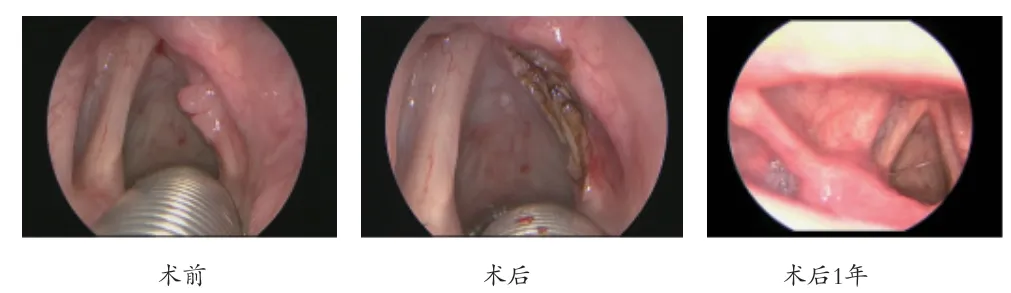
图1 T1a 单次切除活检
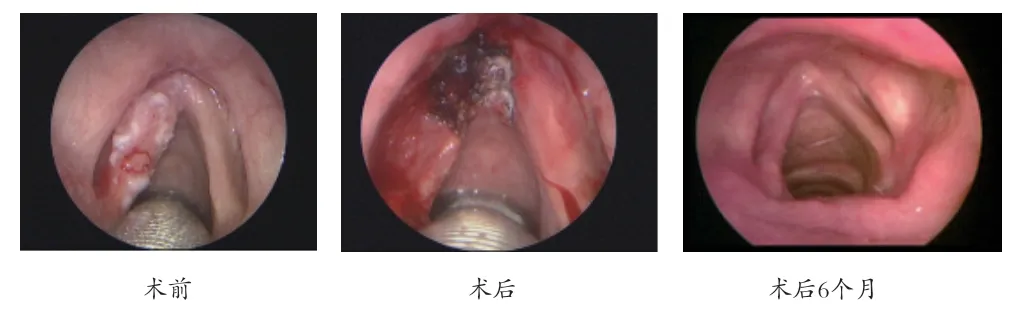
图2 T1b 结合冷冻病理单次切除
2 结果
所有患者术后定期视频喉镜复查随访6 个月~4年。其中局部肿瘤复发4 例,均累及前联合。4 例复发病例均在术后3~6 个月喉镜复查时发现,并再次手术治疗。
3 讨论
因传统喉癌手术需颈外入路切除肿瘤,手术创伤较大,术后并发症多,故需要先行活检病理确诊后再另行手术方案。而随着近年来喉内激光手术的开展,可以经口支撑喉镜下切除肿瘤病变组织,并具有创伤小恢复快、手术视野清晰、切割操作精准、喉功能保留好等优点,对于是否仍需先活检病理确诊后再行扩大切除手术及术中切缘快速冷冻病理的必要性,目前尚有争议。本组病例中,采用不同手术方式均达到了良好的局部肿瘤控制率,并保留了良好的喉功能,肿瘤复发主要与肿瘤分期及浸润深度相关,与手术方式的选择并无相关性。目前,国内外应用CO2显微激光治疗早期声门型喉癌的方法主要有2 种:一种是分次手术,先术前切取活检待病理确诊后,再常规采用扩大声带切除术;另一种是采取切除活检的方法,术中根据病变的范围和深度采用不同类型声带切除术,术中冷冻切片不作为常规,再根据术后病理切缘情况,决定是否进一步扩大切除或观察。Gallo 等[10]和Maurizi 等[11]采用前种方法,Ledda 等[12]和Manola 等[13]采用后种方法,两种方法对于早期喉癌的治疗均取得良好的肿瘤学效果,在局部肿瘤控制率、长期生存率及喉功能保留方面,并无明显差异。且杨怀安等[14]通过临床观察及动物实验发现,切除范围包括声带黏膜及部分声韧带后,全部可以恢复喉的正常结构;切除范围包括部分声带肌后,大部分可以恢复喉的正常结构,形成新声带。光镜下见新声带黏膜表面为结构紊乱的鳞状上皮,上皮下无任何间隙,黏膜下有新生的韧带样结缔组织、黏液细胞及疏松的肌纤维,与正常声带近似,切除范围越小,新声带结构恢复越接近正常。因此,对于未浸润声带肌的早期局限性声门癌,在确保喉癌整体切除的同时保留喉的功能结构,可以采取Ⅰ型或Ⅱ型声带切除术对肿瘤整体活检切除,无需术前组织病理确诊;对于肿瘤范围较大,切除范围较广的,鉴于目前快速冷冻诊断已是手术中明确病变性质的可靠手段[15],可以结合术中快速冷冻病理确诊后同期行扩大声带切除,对于先行活检病理确诊的分次手术切除,并无必要。
对于早期喉癌激光手术术中切缘快速冷冻切片的必要性,目前尚有争议。一般认为肿瘤根治手术应确保手术切缘阴性,术中进行切缘的冷冻切片检查可以减少阳性切缘的发生,进而降低肿瘤复发率,喉癌激光手术也要求术中冷冻切片切缘为阴性。但激光手术存在创面热损伤,为术中冷冻切片检测结果的判断增加难度,而且冷冻切片检测的只是外切缘的几个点并不能肯定整体切缘是阴性。另外,术中切取深部切缘冷冻,可增加正常组织的缺失,影响术后嗓音质量。而Pittore 等[16]和Peretti 等[17]报 道 早 期T1 型 声 门癌,大部分浸润范围仍较局限,少数可以浸润甲杓肌(3.4%~5.5%),但浸润深度仍有限,绝大部分浸润深度≤2mm。因此,即使早期甲杓肌受浸润,2mm 的切缘也足以保障安全切缘。而黄志刚等[8]通过对激光手术切缘的组织病理学观察,发现激光切除缘有烧灼后的组织变性,切除缘有4~8 层细胞结构破坏,出现组织细胞变性坏死。表明激光手术实际的切缘应大于显微镜下所观察的标本切缘,切缘安全性更有保障,通过激光气化切割能够确保2~3mm 切缘,其安全性可以得到保障。本组病例也得到进一步验证,部分局限的声门癌术中未做切缘的冷冻病理并不影响肿瘤的复发,当肿瘤累及前连合时可能不易保证有效安全边界,而更易复发,确保术中安全的边界比切缘阴性更具意义。因此,作者认为术中冷冻切片检查对判断切缘的安全性无疑仍有积极意义,对于浸润范围较广早期喉癌,减少切缘的阳性率可以有效降低肿瘤的复发率;但对于部分局限的早期声门癌,如认为术中安全边界足够,术中切缘的快速冷冻病理切片并非必需,可以根据术后病理切缘情况,决定是否进一步扩大切除或观察。
术前和术中对早期声门癌的病变范围和浸润深度的评估具有重要意义。对于判断早期声门癌是否侵犯声韧带和甲杓肌,主要需凭借临床医生的经验判断手术治疗时采取何种术式和切除多大范围,术前的影像学检查并无多大帮助。Hirano 等[18]研究发现声带运动受损的程度与甲杓肌受侵的深度有关。而Peretti 等[17]认为如声带运动正常而黏膜波消失意味着肿瘤浸润深度至少达声韧带。因此,声带运动受限或固定是甲杓肌受侵的表现,术前结合动态喉镜检查能帮助判断肿瘤侵犯的深度,术中仍需要进一步判断肿瘤浸润深度,术中显微镜直视下可以进一步观察声带病变的范围,特别是喉室和声门下病变的范围,可通过用喉显微器械触碰声带帮助判断浸润的深度[19]。另外,Kass等[20]报道应用声带黏膜下注射等渗盐水的方法,可以帮助判断肿瘤的浸润深度。因此,应根据术前和术中肿瘤范围和浸润深度的判断,分别实施不同类型的切除手术,正确判断肿瘤的范围和甲杓肌受侵深度有助于减少术后局部复发和提高发声质量。
