Hp感染根除治疗前后慢性胃炎胃黏膜组织中miR-22和NLRP3炎症小体表达水平变化
2020-06-11陈梦娜李善高
陈梦娜 李善高
幽门螺杆菌(Hp)是一种严重影响公众健康的革兰氏阴性微需氧致病菌,可引起慢性胃炎、消化性溃疡、胃癌、胃黏膜相关组织淋巴瘤等胃部疾病[1]。1994 年,国际癌症研究机构(IARC)将Hp 定义为胃癌I 类致病物[2]。我国目前Hp 感染率达50%,含铋剂四联已作为经验性根除治疗Hp 方案,随着多种抗生素的耐药率增高,Hp 感染根除杀菌已成为临床治疗的巨大挑战。本研究通过测定不同Hp 感染程度的慢性胃炎患者杀菌前后的胃黏膜组织中miR-22 和NLRP3 炎症小体表达水平变化,初步探讨miR-22 及NLRP3 炎症小体信号通路在Hp 感染致病中的作用,旨在为Hp 相关性疾病的防治提供理论依据。
1 资料与方法
1.1 临床资料 选取2018 年1 月至2019 年3 月浙江中医药大学附属第一医院内镜中心Hp 感染阳性及同期Hp阴性慢性胃炎患者105例,其中阳性组患者85例,男49 例,女36 例,年龄20~60 岁。根据感染程度分为轻度感染组18 例、中度感染组22 例、重度感染组45 例。阴性组患者20 例,男11 例,女9 例,年龄20~60 岁。纳入标准:(1)阳性组患者,C14-尿素呼气试验及胃黏膜组织切片HE 染色结果均为阳性;(2)近期血液有关指标如血常规、肝肾功能及凝血类等均无明显异常;(3)未曾有Hp 根除治疗;(4)意识清楚,无认知障碍等。排除标准:(1)近1 个月内使用抗生素、PPI、非甾体类药物、大剂量激素、免疫抑制剂等人群;(2)排除有严重药物过敏史、孕妇、哺乳期妇女、药瘾者、酗酒者等;(3)排除严重消化性溃疡、胃大部切除史、胃肠道恶性肿瘤等消化道疾患者,严重心、脑、肝、肾功能不全,严重风湿免疫系统疾病,内分泌系统疾病,血液系统疾病,神经精神性疾病等。本项目经浙江中医药大学附属第一医院伦理委员会审核批准,所有患者均签署知情同意书。
1.2 方法 (1)14C-尿素呼气试验:患者保持清晨空腹,检测前漱口,而后通过温凉饮用水(20ml)服用1 粒尿素C14 胶囊(药物由深圳中核海得威生物公司提供)。静坐15~20min 左右,将呼气卡取出,沿呼气口向卡内进行1~3min 的呼气,期间允许换气,忌吸气,直至卡上指示窗的颜色由橙红色变成黄色为止。将呼气卡检测窗口上的封签揭去,插入HUBT-20 型幽门螺杆菌测试仪中,待仪器自动对标本进行检测,结果以每分钟衰变数(DPM/mmol)表示。评判标准:阴性:DPM<100;阳性:DPM ≥100。(2)胃黏膜组织标本采集:所有研究对象均行常规胃镜检查,临床医师在胃镜下使用相同批次的活检钳钳取胃窦部位的胃黏膜组织标本至少2 块,每块标本大小约0.2cm×0.2cm,其中1 块胃黏膜组织标本置于10%福尔马林中固定,另1 块胃黏膜组织标本立即于-80℃冰箱内冷藏备用。(3)HE 染色:取出在10%福尔马林中固定后的胃黏膜组织,冲洗干净后依次放入低浓度和高浓度的乙醇进行脱水处理,加入二甲苯进行透明处理,使其充分替换出残留在其中的乙醇。后将标本放入石蜡块中包埋,用切片机切成厚度约为4μm的薄片,再次加入二甲苯中脱蜡处理,依次放入高浓度和低浓度的乙醇,最后经蒸馏水处理1 次。在处理好的切片中加入苏木精染色溶液染色15min,并在盐酸和氨水中各分色几秒,用蒸馏水冲洗干净后加入伊红酒精溶液染色处理3min,将染色后的切片分别使用100%乙醇和二甲苯进行脱水透明处理,并在切片上加入中性树胶,放上盖玻片进行封固,放置于烤箱内将其烘干,使用电子显微镜观察胃黏膜组织病理形态改变,并拍照保存,贴上标签以备待查。通过在高倍显微镜下对胃黏膜的黏液层及上皮组织进行观察,对Hp感染程度进行分组,评判标准[3]:切片上未见Hp 菌体表示无Hp 感染;见菌株分布<1/3 标本全长表示轻度Hp 感染(+);>1/3 标本全长,不>2/3 区域表示中度Hp 感染(++);Hp 菌株成堆存在,基本分布于标本全长表示重度Hp 感染(+++)。(4)RT-PCR 检测miR-22,NOD 样受体蛋白3(NLRP3)、凋亡相关斑点蛋白(ASC)、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)mRNA 表达水平:将置于-80℃冰箱冷藏的胃黏膜组织取出,Trizol 法提取总RNA,取总RNA 1μg,以细胞总RNA 为模板,逆转录cDNA,制成20μl 逆转录体系;以1.0μl DNA 作为底物进行Real-time PCR:在96X PCR 板各空中加入1.0μl cDNA、5xSYBR mix以及目的条带引物,总反应体系为20ul,置于荧光定量PCR 仪中。95℃5min 预变性后,95℃ 15s →63℃ 25s(收集荧光),40cycles,之后进行溶解曲线实验,检测是否含有非特异性条带扩增。各个基因的相对表达水平以2(Ct 内参基因-Ct 目的基因)进行统计分析。RT-PCR 引物序列见表1。(5)Western blot 检测胃黏膜组织中NLRP3、ASC、Caspase-1 蛋白表达水平:将胃黏膜组织置于1~2ml 匀浆器中,经PBS 洗涤后,用剪刀将其剪碎,向其中添加总蛋白提取试剂(含蛋白酶抑制剂混合液)静置裂解,裂解30min 后,将裂解液移至1.5ml EP 管中,然后在4℃,12000rpm 离心15min,取上清分装于1.5ml EP 管中并置于-20℃保存。后经上样、电泳、转膜、染色、去离子水震荡去除浮色,放入含有封闭液的平皿中,室温下脱色摇床上摇动封闭1h。将一抗用TBST 稀释至适当浓度,在4℃下孵育过夜,同上方法准备二抗稀释液并与PVDF膜接触,室温下孵育1h,洗涤后加入底物孵育,取出硝酸纤维素膜,蒸馏水漂洗后晾干,通过在暗盒中进行约10min 的曝光来完成显影和定影过程。并使用Image J 软件分析每个条带的光密度,并重复进行3 次,靶蛋白的相对表达=[靶蛋白(光密度值)/内部参数(光密度值)]×10n,最终结果表示为均数±标准差(MeanSD)。所有阳性组患者采用相同药物方案进行2周抗菌治疗,1 个月后再次行14C-尿素呼气试验、胃黏膜组织病理检测以及相关指标的测定(具体方法同上)。具体服药方案:(泮托拉唑40mg+果胶铋100mg)(2次/d,餐前30min 口服)+(阿莫西林1000mg+克拉霉素500mg)(2 次/d,餐后口服)。
1.3 统计学分析 采用SPSS 19.0 统计软件。符合正态分布计量资料以(±s)表示,组间比较用单因素方差分析,两两用LSD-t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 所有Hp 感染阳性组患者密切随访,严格服用四联药物14d,且配合临床医师在疗程结束1 个月后再次返院接受14C-尿素呼气试验及胃镜检查,服药期间无明显身体不适,且饮食生活规律。根除治疗结束后1 个月,因各种原因中断治疗10 例(其中轻度5 例,中度3 例,重度2 例)。Hp 根除成功率90.67%。
2.2 RT-PCR 检 测 胃 黏 膜 组 织miR-22,NLRP3、ASC、caspase-1 mRNA 表 达 水 平 Hp 感 染 阳 性 各组胃黏膜组织中miR-22 表达水平显著低于阴性组(P<0.05),NLRP3 炎症小体各组成成分mRNA 表达水平均高于阴性组;随着Hp 感染程度的加重,miR-22表达水平呈下降趋势,NLRP3 炎症小体各组mRNA 则呈现与miR-22 相反趋势,组间比较差异均有统计学意义(P<0.05)。在根除治疗后,发现Hp 感染根除治疗成功组miR-22 表达水平比对应各组杀菌前水平升高(P<0.05),但仍低于阴性组水平;NLRP3 炎症小体各组分mRNA 表达水平较对应各组杀菌前水平降低。Hp 感染根除治疗失败组胃黏膜组织中的miR-22 及NLRP3 炎症小体各组成成分mRNA 表达水平在根除治疗前后差异无统计学意义(P>0.05)。见图1。

图1 各组胃黏膜组织中miR-22,NLRP3、ASC和Caspase-1 mRNA表达水平比较
2.3 Western blot 检测胃黏膜组织中NLRP3、ASC、caspase-1 蛋白表达水平 Hp 感染阳性各组胃黏膜组织中NLRP3 炎症小体各组分蛋白表达水平均高于阴性组(P<0.05);随着Hp 感染程度加重,其表达水平逐渐上升,各组间比较差异均有统计学意义(P<0.05)。根除治疗后,Hp 根除治疗成功组胃黏膜组织中NLRP3炎症小体各组成成分蛋白表达水平较对应各组杀菌前明显下降,但仍高于阴性组水平,各组间比较差异均有统计学意义(P<0.05)。Hp 根除治疗失败组胃黏膜组织中的NLRP3 炎症小体各组成成分蛋白表达水平在根除治疗前后差异无统计学意义(P>0.05)。见图2。
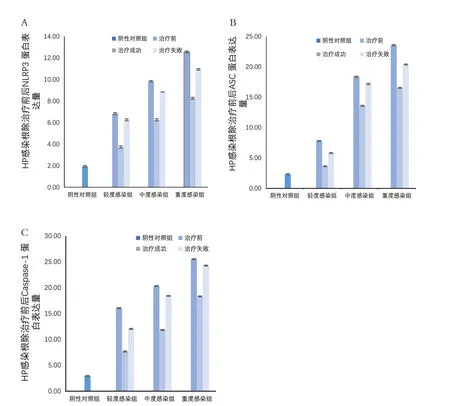
图2 各组胃黏膜组织中NLRP3、ASC和Caspase-1蛋白表达水平比较
3 讨论
Hp 最早于1893 年由意大利病理学家Bizzozero 首次在动物胃内发现[4],作为唯一可存活于胃内的细菌,具有高致病性,其借助特有的毒力因子,长期定植于宿主体内,引起一系列Hp 相关性疾病[5]。有研究表明,Hp 感染是慢性胃炎和消化性溃疡的主要致病原因,且经历从慢性浅表性胃炎、萎缩性胃炎、不典型增生至胃癌的病理演变过程,在此过程中不同阶段阳性率有所差异[6]。我国Hp 感染率约为50%~90%,高于发达国家平均水平(50%~70%),各年龄段人群Hp 感染率存差异,而男女性别差异不明显;不同种族、信仰以及受教育程度不同,Hp 感染同样存在差异,作者认为这可能与民族风俗、生活习惯以及易感人群等原因有关[7]。目前推荐含铋剂四联(PPI+铋剂+2 种抗生素)作为主要治疗根除Hp 方案[8]。近年来,随着临床抗菌药物的广泛使用及经验性治疗方案的制定,致使我国Hp 对较多抗菌药物耐药,明显降低临床根除治疗率[9]。因此,需寻求一种高效、且副作用小的根除Hp 的药物。
miRNA 是近年来发现的一类长18~26 个核苷酸的高度保守的小分子RNA,其几乎可以完全互补靶mRNA 的3'非编码区(3'UTRs),并在转录水平上发挥降解作用;也可以与之不完全互补,在翻译水平上抑制蛋白质的合成,从而在基因表达中发挥重要调节作用[10]。成熟的miRNA 形成过程通常由RNA 聚合酶II 从相应的基因组DNA 转录成初级miRNA,再经核酶切割形成释放至胞质中。研究显示miRNA 可参与细胞增殖、凋亡、炎症、肿瘤等多种生理病理过程[11-13]。
NLRP3 炎症小体主要表达于中性粒细胞、单核细胞、巨噬细胞、树突状细胞,其异常表达可诱导一系列炎症反应[14],是目前研究较多的炎症小体,其受体蛋白是NOD 样受体蛋白3,属于NLRs 家族,NLRs家族由N 端的Caspase 募集和活化结构域或热蛋白结构域(PYD)、C 端富含亮氨酸的重复序列和中间的NACHT 结构域(NOD 结构域)3 部分组成。NLRP3 炎症小体是由NLRP3、ASC 和Caspase-1 所组成蛋白复合物。其在激活后可通过Caspase-1 水解前体IL-1β(pro-IL-1β)、前体IL-18(pro-IL-18)和gasdermin D,使其形成并释放具有活性的IL-1β、IL-18 和gasdermin D 的N 端片段,被多种病原相关的分子模式或损伤相关的分子模式活化,对固有免疫系统的免疫调节过程具有重要作用[15-17]。有实验以Hp 联合N-甲基-N-亚硝酸脲(MNU)灌胃小鼠胃癌模型为研究对象[18],结果显示Hp 感染的组织中miR-22 表达抑制,而对NLRP3 的抑制减弱,诱发NLRP3 炎症小体发生聚集及激活,导致巨噬细胞产生大量的IL-1β。大量研究表明,NLRP3 是miR-22 的直接靶点,NLRP3 炎症小体信号通路在Hp 感染致炎过程中发挥重要作用。
本资料结果显示,Hp 阳性组患者胃黏膜组织中miR-22 表达水平低于阴性组,而NLRP3 炎症小体各组成成分的基因及蛋白表达水平高于阴性组;在根除后的胃黏膜组织中,miR-22 表达水平升高,同时,NLRP3 炎症小体各组分的基因与蛋白表达水平相较于根除前各组表达水平降低。作者认为NLRP3 炎症小体对胃黏膜具有致炎作用,而miR-22 则起到抑制炎症的作用。在Hp 感染过程中,可能是通过抑制miR-22的表达,参与激活NLRP3 炎症小体信号通路,致使各炎症因子大量释放,从而导致胃黏膜的持续性病理损伤。但其是如何导致胃黏膜炎症改变的具体作用机制还需进一步的探索,明确此作用的关系可能为临床中Hp 相关性疾病的防治提供理论基础。
