补肾活血法对再生障碍性贫血患者骨髓MSCs增殖及成血管功能的影响
2020-06-11史亚婷刘文宾吴迪炯沈一平周郁鸿叶宝东
史亚婷 刘文宾 吴迪炯 沈一平 周郁鸿 叶宝东
再生障碍性贫血(aplastic anemia,AA)是一种以全血细胞减少、骨髓造血功能衰竭为特征的血液病,其发病机制尚未明确。目前认为免疫机制异常、造血微环境改变和造血干细胞缺陷是其三大原因[1],其中造血微环境异常在其发病中的作用越来越受到重视。作者前期研究发现AA 患者骨髓微血管密度(MVD)显著低于正常人[2],且重型AA 更显著,低血管密度势必会影响骨髓血供,对造血细胞的成熟与分化不利。而骨髓间充质干细胞(BMSCs)是骨髓微环境的重要组成部分,与造血细胞直接接触,起到支持和营养造血细胞的作用。前期研究发现无论肾阳虚还是肾阴虚再障患者,BMSCs 的增殖能力较正常对照减弱[3]。再障的基本中医病机为肾虚髓亏,因虚证、瘀证而发病,一定程度上与现代认识的微循环相契合[4],同时应用补肾活血法取得较好的临床疗效[5]。本文探讨补肾活血法对再生障碍性贫血患者BMSCs 增殖和成血管作用的影响,为临床应用提供理论依据。
1 材料与方法
1.1 实验药物 补肾活血中药处方:太子参30g,补骨脂20g,仙灵脾20g,肉桂4g,生地15g,熟地20g,茯苓10g,菟丝子15g,制何首乌10g,丹参10g,当归10g,赤芍9g,丹皮9g,山药30g,均选取江阴天江药业有限公司标准中药颗粒剂。
1.2 实验动物 周龄雄性SPF 级荷兰兔,体重2~3kg,由浙江中医药大学实验动物中心提供。
1.3 制备含药血清及对照血清 将212g×6 包原生药加一定量的水,用水提法浓缩成1000ml 液体。随机将6 只兔子分成两组,对照血清组予灌胃生理盐水20ml/次,2 次/d,共7d;含药血清组予每次灌胃中药汤液20ml,2 次/d,共7d。从实验第4 天起,每天分别对2 组兔子在第2 次灌胃2h 后耳静脉取10ml 全血,后立即离心,每组获得约5ml 血清。将4 次血清混合后,每组共获得约20ml 血清,置于水浴箱中56℃,30min 灭活,0.22μm 过滤器过滤除菌,分装至15ml 离心管中,-20℃冷藏备用。
1.4 再障患者BMSCs 的获取 选取2018 年6 月1 日至12 月31 日本院血液内科住院的初发AA 患者8 例,其中男4 例,女4 例;中位年龄26(18~46)岁。病例诊断均符合再生障碍性贫血诊断与治疗中国专家共识(2017 年版)[6]。所有患者均知情同意,签署知情同意书。常规抽取再障患者骨髓5~10ml,采用已经建立的骨髓MSCs 提取方法[3],采用流式细胞术鉴定MSCs,取3 ~6 代细胞进行后续研究。
1.5 主要仪器与试剂 多功能全波长酶标仪(K3),美国Thermo 公司;8μm 孔径 transwell 装置,Corning Coster Corp 公司。
1.6 CCK8 检测补肾活血法对再障患者BMSCs 增殖的影响 (1)取生长状态良好的P3 代细胞,以5×103密度接种于96 孔板中,每孔200μl。(2)无血清培养24h 后,分成12 组,分别为5%、10%、15%、20%、25%、30% 含 药 血 清 组 和5%、10%、15%、20%、25%、30%对照血清组每组5 个复孔,培养24h、48h、72h 后, 加 入CCK8 溶 液10μl/ 孔,5% CO2,37 ℃细胞培养箱内培养4h。(3)取出96 孔板,低速震荡15min,酶标仪570nm 波长检测吸光度(OD)值。
1.7 Transwell 检测补肾活血法对重型再障患者BMSCs体外迁移的影响 (1)取生长良好的P3 代BMSCs 细胞,无血清培养24h 后,分成12 组,分别为5%、10%、15%、20%、25%、30%含药血清组和对照血清组,予对应血清浓度预处理24h。(2)调整各组细胞密度为5×105/ml,在transwell 下室加入含100μg/ml SDF-1 培养液;上室分别加预处理后的各组细胞悬液200μl。置于37℃、5% CO2细胞培养箱中孵育6h。(3)取出transwell 装置,PBS 洗涤,置于4%多聚甲醛中固定 15min。(4)PBS 洗涤3 次后,将transwell 装置置于0.1%结晶紫溶液中染色15min。(5)弃染色液,PBS 洗涤3次,自然晾干,棉签拭去小室上层细胞。(6)倒置相差显微镜观察小室下层细胞。(7)将transwell 小室置于200μl 结晶紫脱色液中脱色30min。酶标仪570nm波长检测脱色液吸光度(OD)值。
1.8 Western Blot 检测诱导后细胞血管内皮细胞标志表达 (1)取生长良好的P3-P5 代再障BMSCs 予含VEGF10ug/LDMEM 培养基预处理24h。(2)分别搜集25%含药血清和25%对照血清诱导1d、3d、5d、7d细胞于EP 管中,加入1 ∶100 混匀的含蛋白酶抑制剂和RIPA 裂解液混合液100μl,震荡混匀,予冰上裂解1h。4℃以12000r/min 离心15min。弃上清液,加入100μl 蛋白上样缓冲液,取少量测定蛋白浓度,绘制标准曲线,剩余蛋白予98℃水浴加热10min,存入-80℃冰箱备用。(3)按试剂盒操作说明进行CD31、Tie-2蛋白测定。
1.9 统计学处理 采用SPSS 23.0 统计学软件。计量资料以(±s)表示,两组比较采用t 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 补肾活血含药血清对BMSCs 增殖影响 与对照血清组比较,10%和25%含药血清培养24h,5%、15%和25%含药血清培养48h,各浓度培养72h 对BMSCs 增殖具有明显促进作用(P<0.05)。含药血清对BMCs 增殖促进作用与时间呈一定依赖关系,24h 与48h 作用相似,但72h 明显增强。与对照血清组比较,25%含药血清浓度在各时间段的差异均有统计学意义(P<0.05),因此选择25%含药血清浓度为后续形态学观察和WB 检测血管内皮细胞标志实验浓度,见图1~3。

注:与对照血清组比较,*P<0.05

图2 补肾活血含药血清对BMSc增殖影响(48h)
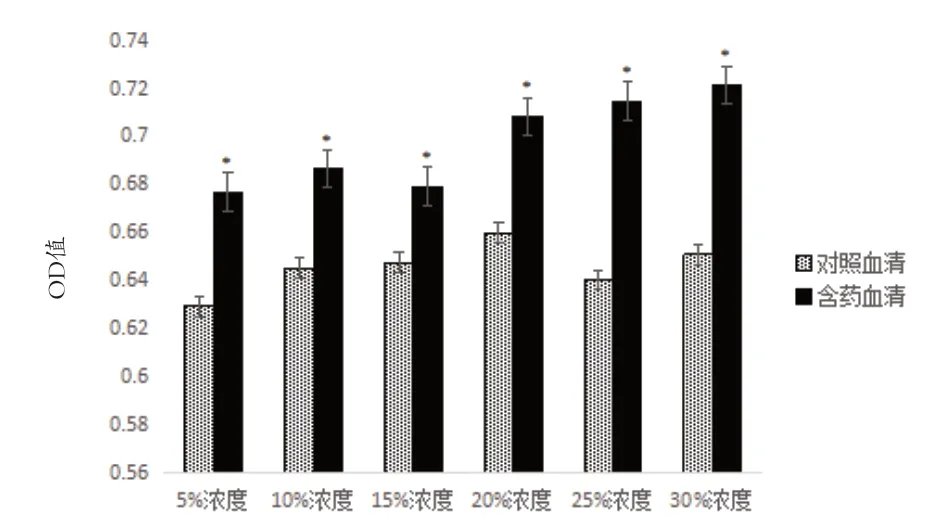
图3 补肾活血含药血清对BMSc增殖影响(72h)
2.2 补肾活血含药血清对BMSCs 体外迁移的影响 应用上述Transwell 装置重复实验5 次,结果显示:不同浓度对照血清及含药血清组均可见梭形结晶紫染色BMSCs,其中15%、20%、25%、30%含药血清组较其他组细胞数较多,对照血清各浓度组相似。脱色后测得OD 值统计分析结果示:与对照血清组比较,5%、10%含药血清OD 值相似差异无统计学意义(P>0.05),15%、20%、25%、30%含药血清OD 值较高,差异有统计学意义(P<0.05),15%、20%、25%、30%含药血清促进作用相似,无明显浓度依赖关系,见图4。
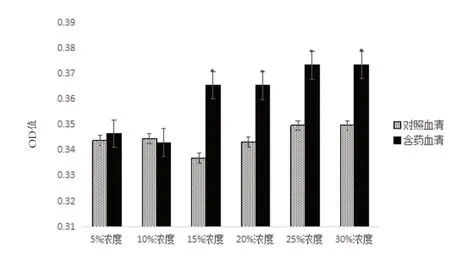
图4 补肾活血含药血清对BMSCs体外迁移的影响
2.3 含药血清诱导后形态观察 25%含药血清诱导1d 后,BMSCs 形态未见明显改变,仍呈长梭形生长,排列紧密,诱导7d 后细胞间距增大,排列松散,胞体呈多角形或不规则形。含药血清诱导21d 可见少量管腔样结构形成。25%对照血清21d 形态无改变。见图5。
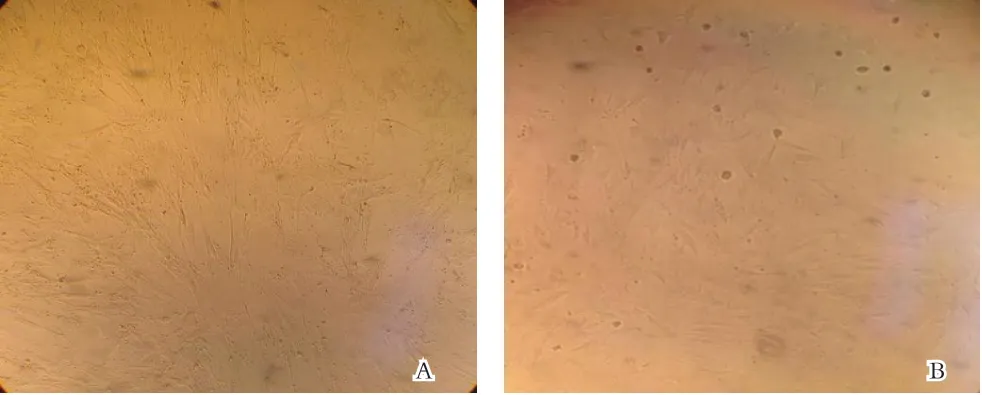

图5 不同含药血清诱导后BMSCs形态的变化
2.4 WB 检测血管内皮细胞标志 25%含药血清诱导1d 后有少量CD31、Tie-2 蛋白,后随着时间延长,表达量逐渐增多,25%对照血清诱导7d 后未见CD31、Tie-2 蛋白表达,见图6。

图6 WB检测血管内皮细胞表面标志(CD31和Tie-2)表达
3 讨论
骨髓造血微环境(BMHM)是造血细胞直接的生存环境,其主要作用是为造血细胞运输氧气、营养成分、信号因子,同时运输代谢废物,是其生存和健康发育必备条件之一。骨髓微血管是BMHM 的场所,其生成受多种因子的联合影响,取决于促血管形成因子与血管抑制因子的作用偏倾。目前已经明确AA 患者的BMHM 受损,不过尚未明确是免疫因素导致其受损还是先有BMHM 受损,或二者相互作用而导致AA 发生。前期研究发现AA 患者骨髓微血管密度(MVD)显著低于正常人[2],且重型AA 更显著,低血管密度势必会影响骨髓血供,对造血细胞的成熟与分化不利。造血细胞的增殖分化需要来自骨髓细胞自分泌及外周循环的各类因子的刺激,再障患者骨髓MVD 减少,与骨髓血管内皮生长因子(VEGF)表达减少相关[2,7],且在免疫抑制剂或骨髓移植治疗后,MVD 及VEGF 均显著上升,但以免疫抑制剂的作用更明显,可能与环孢菌素(CsA)直接刺激造血或非造血细胞分泌VEGF有关[8]。中药药理发现,活血化瘀类中药能在一定程度上促进血管新生,故在此基础上提出补肾固本兼以活血化瘀的基本治疗方法,临床疗效亦得到提高[9-10]。相关分析显示IL-2、IL-10、IL-4、IFN-γ 与骨髓MSCs 生成负相关,IL-6、TNF-α 呈正相关[11],提示补肾活血法可能通过提高骨髓MSCs 粘附分子的表达水平,改善骨髓造血微环境,从而提高疗效。在AA患者异基因造血干细胞移植过程中应用补肾健脾祛瘀法干预,发现补肾活血可以明显提高移植物植入率,减少移植排斥[12],可能也是与补肾健脾祛瘀改善患者骨髓微循环有关。
本实验将再障BMSCs 分离并体外培养,观察不同浓度含药血清对再障BMSCs 增殖作用的影响,10%和25%含药血清培养24h,5%、15%和25%含药血清培养48h,各浓度培养72h 对BMSCs 增殖具有明显促进作用(P<0.05)。含药血清对BMSCs 增殖促进作用与时间呈一定依赖关系,24h 与48h 作用相似,但72h 明显增强。与对照血清组比较,25%含药浓度在各时间段均有意义(P<0.05)。通过体外诱导实验发现,25%补肾活血含药血清随着时间的延长,能诱导BMSCs 向血管内皮细胞分化,主要体现在细胞形态的变化和管腔样结构的形成和血管内皮细胞标志的出现。综上,补肾活血法可能是通过促进再障患者BMSCs 的增殖以及向血管内皮细胞分化来促进骨髓微血管的生成,从而作为补肾活血法改善骨髓微环境的机制之一。
AA 归于中医“虚劳”、“髓劳”、“血证”等范畴,目前认为先天肝肾不足、后天劳役失养,邪毒之气乘虚而入是其主要的病因病机。治疗上主张从肾论治,临床疗效得到提高,但是有部分患者的临床疗效并不理想,且对于重型或非重型再障、急性或慢性再障,中医药介入的时机和疗效还有比较大的争议。对于AA,在从肾论治的基础上,如何进一步阐明其病因病机并相应的调整疗法以提高疗效,值得进一步探索。
