超声监测容量反应性在静脉-动脉体外膜肺氧合撤机中的价值
2020-06-10刘少中蔡健爱吴彦铭辛少博马圣博李嘉懿
刘少中 ,周 兵,蔡健爱,吴彦铭,辛少博,马圣博,李嘉懿,李 芳
(广东省中山市人民医院①超声影像科,②重症医学科,广东 中山 528403)
1976 年Bartlett 成功为1 例新生儿进行床边心肺支持治疗,开始了体外膜肺氧合(extracorporeal membraneoxygenation,ECMO)支持治疗在临床上的应用。静脉-动脉体外膜肺氧合(venoarterial extracorporeal membrane oxygenation,VA-ECMO)作为短期机械循环的辅助,目前已成为难治性心源性休克的一线治疗方案之一[1-2]。VA-ECMO 的成功撤机对患者后续治疗及生存率有重要影响。尽管有研究[3-4]对撤机时机进行了探讨,但目前仍无有关ECMO 撤机的最佳评估指标,因此本研究探讨超声监测患者容量反应性在VA-ECMO 撤机中的价值。
1 资料与方法
1.1 一般资料 选取2017 年1 月至2019 年6 月在我院接受VA-ECMO 治疗的患者27 例,其中,男19例,女8 例。纳入标准:①各种原因致左心功能衰竭接受VA-ECMO 支持治疗的患者;②年龄≥18 岁;③行有创机械通气。排除标准:①心律不齐;②循环衰竭需行主动脉内球囊反搏术;③恶性肿瘤。根据VA-ECMO 撤机试验是否成功,分为撤机试验成功组为A 组(20 例),撤机试验失败组为B 组(7 例),并在撤机试验前,检测患者的相关血流动力学参数。
1.2 仪器与方法
1.2.1 ECMO 的置管情况 VA-ECMO 支持系统采用美国Medtronic 公司美敦力CBIQ91R6 套包,经右股动、静脉分别置入15~20 F(1 F=0.333 mm)和19~22 F 插管,动脉插管尖端位于腹主动脉中段,静脉插管尖端位于下腔静脉内肝静脉出口远心端1.0~2.0 cm水平;动脉插管侧远端肢体置入6~8 F 再灌注导管,连接于股动脉插管分流孔接头处。机械通气参数:相关血流动力学指标采集时均为压力控制模式(潮气量8~12 mL/kg 体质量)、呼吸频率12~20 次/min、呼气末正压5 cm H2O(1 cm H2O=0.098 kPa)。常规监测患者的心率、肱动脉收缩压、肱动脉舒张期、平均血压、中心静脉压(central venous pressure,CVP)。
1.2.2 超声检查 在撤机试验前,采用GE Vividi 彩色多普勒超声诊断仪,1.5~3.6 MHz 相控阵探头、1.8~6.0 MHz 凸阵探头行超声检查。获得左室长轴观,采用M 型Teicholz 法计算左室射血分数(left ventricular ejection fraction,LVEF)。获得心尖五腔观,将脉冲多普勒取样容积置于左室流出道,测量血流速度频谱并描记速度曲线下面积,以获得速度-时间积分(velocity time integral,VTI)(图1),于机械通气吸气末和呼气末分别进行测量,获得VTImax、VTImin,并计算主动脉速度-时间积分呼吸变异率(ΔVTI)=(VTImax-VTImin)/VTImax×100%。

图1 主动脉VTI 测量(VTI,速度-时间积分)
于机械通气、呼气末和吸气末同步冻结超声图像,于下腔静脉距肝静脉出口远心端1.0~2.0 cm 处分别测量下腔静脉内径Dmax、Dmin,并计算下腔静脉的呼吸变异指数(respiratory variability index,ΔRVI),ΔRVI=(Dmax-Dmin)/Dmax×100%。
超声检查过程中,输液速度、血管活性药物剂量、镇痛镇静药物均保持不变。同一患者检测由超声影像科同一位经过培训的医师进行,每项数据均测量3 次,取平均值。
1.2.3 撤机试验 ECMO 撤机试验时机:混合静脉血氧饱和度(venous oxygen saturation,SVO2)≥70%,CVP<12 cm H2O,平均血压>60 mm Hg(1 mmHg=0.133 kPa),LVEF≥0.40,未接受(或仅接受低剂量)血管活性药物,并记录撤机试验前的血流动力学参数。患者取仰卧位,逐渐降低ECMO 辅助流量(每次1 L/min)直至1 L/min,参数维持平稳10~15 min 后,则撤机成功。如试验过程中平均血压明显下降且持续<60 mm Hg,或出现容量过负荷、肺水肿(超声B线)、心律失常及需调整基础药物用量等突发情况,应立即终止撤机,试验失败。
1.3 统计学方法 采用SPSS 19.0 软件进行数据分析,计数资料行Fisher 确切概率法,计量资料以±s表示,2 组间比较行Mann-Whitney U 秩和检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组一般资料比较 2 组性别比例、年龄、体质量指数等一般资料比较差异均无统计学意义(均P>0.05)(表1)。
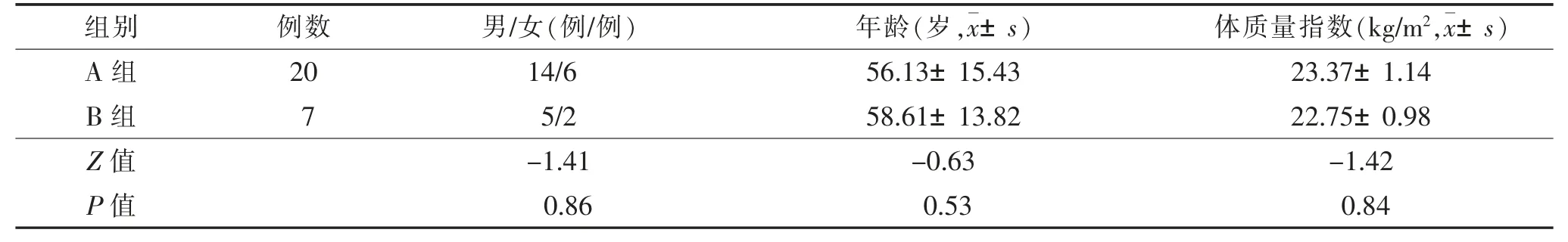
表1 2 组一般资料比较
2.2 2 组血流动力学参数比较 撤机试验前A 组ΔVTI>B 组(P<0.05),2 组ΔRVI、LVEF、CVP、心率比较差异均无统计学意义(均P>0.05)(表2)。
3 讨论
VA-ECMO 在临床已得到广泛应用,是治疗各种病因导致的难治性心源性休克的有效选择[5]。而VA-ECMO 撤机过程对血流动力学影响较大,包括全身血管扩张、左心功能不全、左室流出道梗阻及右心功能不全等[6]。因此,撤除VA-ECMO 前需进行严格的临床评估。
左室每搏输出量(stroke volume,SV)是左心室每次搏动射出的血量,取决于前负荷(舒张末期室壁张力)、心肌收缩力和后负荷(收缩末期室壁张力)。根据Frank-Starling 定律,当左室心肌细胞处于Frank-Starling 曲线上升支时,若左室前负荷增加,心肌细胞被拉伸、收缩更有力,此时随循环容量(前负荷)增加,SV 也随之增加;当左室心肌细胞处于Frank-Starling曲线平台支、伸展超过一定水平、不能更有力地收缩时,其SV 不能进一步增加,继而出现左心衰竭[7-8]。左室容量反应性能够反映左室前负荷的潜能,当相对或绝对容量过多时,心肌细胞过度伸展,左室容量反应性会降低。
表2 2 组撤机试验前血流动力学参数比较(±s)

表2 2 组撤机试验前血流动力学参数比较(±s)
注:ΔVTI,主动脉速度时间积分呼吸变异率;ΔRVI,下腔静脉呼吸变异指数;LVEF,左室射血分数;CVP,中心静脉压。1 mm H2O=0.098 kPa。
VA-ECMO 启动需700~1 000 mL 液体管路预冲,这部分液体在撤机过程中全部回到患者体内,增加体循环容量,加重心脏前负荷,同时,辅助流量减少,亦导致左、右心室前负荷增加[9],甚至出现心力衰竭,因此,密切监测患者的容量反应性,可预测心脏能否适应撤机后增加的循环容量。
在监测VA-ECMO 患者的容量反应性方面,传统经肺热稀释法使用Swan-Ganz 导管常规测定心输出量对VA-ECMO 患者的价值有限[10],而脉搏轮廓等微创监测同样不可靠[11]。超声提供的如ΔVTI、ΔRVI等指标则是监测容量反应性的有效手段[12]。
本研究中,撤机试验前A 组ΔVTI 相对较大,提示当左室前负荷潜能较大时,左室心肌细胞处于Frank-Starling 曲线的上升支,患者能适应VA-ECMO撤机所致的循环容量增加,有利于成功撤机。B 组试验前的ΔVTI 相对较小,可能由于此时左室心肌细胞处于Frank-Starling 曲线的平台支,左室难以适应增加的循环容量,易出现左心衰竭导致撤机失败。因此,ΔVTI 在预测VA-ECMO 成功率上有一定价值。
2 组试验前的ΔRVI 比较差异无统计学意义,可能是由于VA-ECMO 静脉插管尖端位于下腔静脉上段,其抽吸作用对下腔静脉直径的影响抵消了呼吸对其直径的影响。2 组试验前的LVEF、CVP 比较差异均无统计学意义,可能是由于LVEF 反映的是左室心肌当前的收缩能力,CVP 反映的是循环系统当前的容量状态,两者皆无法反映心肌的容量负荷潜力。因此,LVEF 与CVP 在预测VA-ECMO 撤机能否成功上有不确定性。
综上所述,超声可在VA-ECMO 插管及治疗过程中提供指导并获得患者恢复情况和有无并发症等重要信息,还可监测患者的容量反应性,在VA-ECMO撤机过程中有重要作用[13]。
