新型冠状病毒的研究进展
2020-06-10矫雪乔唐利博熊丽霞
王 怡,矫雪乔,唐利博,熊丽霞
(南昌大学a.研究生院医学部2019级; b.玛丽女王学院2016级;c.第二临床医学院2017级; d.基础医学院病理生理学教研室,南昌330006)
2020年2月11日,国际病毒分类委员会(ICTV)声明,将新型冠状病毒命名为“SARS-CoV-2”(Severe Acute Respiratory Syndrome Coronavirus 2)[1]。世卫组织突发事件委员会认为,新型冠状病毒肺炎(COVID-19)疫情是国际关注的突发公共卫生事件。截至4月23日,中国共有84 305例COVID-19确诊病例,全球共确诊2573467例[2-3]。
冠状病毒是人类呼吸系统的主要病原体之一,SARS-CoV-2是目前已知的第7种可以感染人的冠状病毒,其余6种中包括导致重症急性呼吸综合征(SARS)的SARS-CoV和导致中东呼吸系统综合征(MERS)的MERS-CoV,两者都被定性为对公众健康构成巨大威胁的病毒[4]。在冠状病毒的结构元件中,有由S1和S2两个亚基组成的刺突(S)蛋白,S蛋白的同型三聚体组成病毒表面的尖峰,引导与宿主受体的连接[5]。值得注意的是,SARS-CoV-2与SARS-CoV都是通过与人体细胞表面的血管紧张素转化酶2(ACE2)受体结合而感染细胞[6]。SARS-CoV-2可以通过呼吸道飞沫或密切接触在人与人之间传播,同时,在相对封闭的环境下存在经气溶胶传播的可能[7]。最近的研究[8]表明,亚临床患者不仅可以有效传播病毒,而且即使从急性疾病中恢复后,患者也可以散播大量病毒并感染其他人。提醒人们需要采取积极严密的防护措施(例如N95口罩,护目镜和防护服等),避免社区感染及院感,从而确保普通群众以及医护人员在这次SARS-CoV-2爆发以及未来可能发生的二次爆发期间的安全[9]。本文从SARS-CoV-2的病原学、流行病学以及临床特征三方面进行简要分析,以便对现行状况下的COVID-19疫情的进展和防控有更加清晰的认识。
1 病原学
1.1 SARS-CoV-2的侵袭与复制
冠状病毒能够快速突变和重组,是有包膜的单股正链RNA病毒,分为α-冠状病毒和β-冠状病毒,它们都具有蝙蝠的基因来源,主要存在于哺乳动物中,例如蝙蝠、啮齿动物和人类等。冠状病毒进入易感细胞是一个复杂的过程,需要配体-受体结合和S蛋白的蛋白水解共同作用,以促进病毒-细胞融合。冠状病毒表面有S蛋白,由S1和S2两个亚基组成。S1亚基由一个受体结构域RBD组成,通过结合宿主受体使病毒感染宿主细胞。而S2亚基则介导病毒和宿主细胞膜之间的融合,位于紧接融合肽上游的S2’位点的宿主蛋白酶进一步裂解S蛋白,从而激活膜蛋白,促使病毒进入宿主细胞[5]。
SARS-CoV-2属于冠状病毒科β-冠状病毒属,是有包膜的单股正链RNA病毒,可通过S蛋白RBD结构域与人体细胞表面的ACE2受体结合而感染细胞,引起一系列病理改变。当未感染者吸入感染者所排出带有SARS-CoV-2的分泌物时,该病毒就进入未感染者的鼻腔和咽喉,该处细胞表面有大量ACE2受体,SARS-CoV-2通过S蛋白与该受体结合进入细胞并进行RNA基因组复制,形成长链多聚蛋白,而后通过SARS-CoV-2的非结构性蛋白酶进行解离。因此,SRAS-CoV-2能够以少量的核苷酸编码最大数量的基因[10]。随着病毒的大量复制,感染者可散播大量病毒,尤其是在被感染的第一周左右。在此阶段,如果机体的免疫系统无法抵抗SARS-CoV-2的侵袭,则病毒会沿着气管行进,攻击肺部,进而诱发多系统衰竭[11]。这个过程可概述为:S蛋白通过与ACE2受体结合介导SARS-CoV-2进入宿主细胞,激活炎症、免疫反应,对宿主细胞造成严重损害,引发肺损伤甚至肺衰竭,S蛋白作为抗体的主要靶点,为SARS-CoV-2疫苗以及靶向药物的研发提供了可行的研究方向[6]。
SARS-CoV-2在感染后会在体内进化,这可能会影响其毒力、传染性和可传播性,尽管宿主内变体如何在人群中传播尚不清楚,但有研究[12]对SARS-CoV-2患者的支气管肺泡灌洗液样本进行转录组测序,发现宿主内变体的数量在0~51之间,中位数为4,提示SARS-CoV-2的进化速率很高;SARS-CoV-2在宿主体内的变异和在人群中的变异都比较高频,但是不同患者,体内病毒的变异率不同,且与患者发病的先后、症状的严重程度以及年龄无关,在宿主体内产生的变异型SARS-CoV-2似乎并未继续传染别人,SARS-CoV-2也没有导致宿主体内特定的菌群失衡或者改变。由于缺乏聚合酶的校对活性,RNA病毒突变率高,导致RNA病毒容易产生对药物的抗药性,并且机体无法对其进行免疫监视。高突变率也会导致RNA病毒中宿主内变体的水平较高,SARS-CoV-2患者中宿主内变体的发生率与埃博拉病毒研究报告(134个样本中655个频率≥5%的变体)中的结果类似,表明SARS-CoV-2的突变率也与埃博拉病毒相当[13]。在外切核糖核酸酶(ExoN)中提供SARS-CoV和SARS-CoV-2的校对活性,注意到ExoN基因中的所有3个关键基序在SARS-CoV和SARS-CoV-2之间是相同的,在这些基序中均未检测到多态性或宿主内变异,表明该基因是高度保守的,有可能作为抗病毒治疗的潜在靶点[12]。
1.2 SARS-CoV-2的理化特性
SARS-CoV-2呈球形或椭圆形,直径为60~140 nm,具有多形性[14]。对SARS-CoV-2的理化特性目前尚未完全明确,根据《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[15],SARS-CoV-2对紫外线和热敏感,56 ℃条件下90 min或75 ℃ 30 min可灭活,对含氯消毒剂、乙醚、75%乙醇、过氧乙酸和氯仿等脂溶剂敏感,对氯己定不敏感。
2 流行病学
钟南山等[16]在1099例COVID-19患者的流行病学研究中发现,71.8%的患者接触过来自疫区的人,仅仅只有1.18%的患者有接触野生动物史,证明SARS-CoV-2感染可在人际间传播。根据《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[15],SARS-CoV-2的传染源主要是SARS-CoV-2患者,但感染患者潜伏期和无症状感染者也具有一定的传染性。主要传播途径为呼吸道传播,通过患者咳嗽、大声说话、打喷嚏时飞沫直接在人与人之间传播;亦可通过密切接触传播,如通过被污染的手接触口鼻部或眼结膜。同时,在相对封闭的环境中长时间暴露于高浓度气溶胶情况下存在经气溶胶传播的可能。激光实验研究[17]发现,呼吸和交谈会产生更小的微粒(称为气溶胶微粒),而“超级传播”的患者产生的气溶胶微粒比其他患者多,这些微粒的直径以微米为单位,微粒太小而无法在重力作用下沉降,被气流携带,进而扩散且随空气湍流分散。最近的一项研究[18]表明,实验生产的含有SARS-CoV-2的气雾剂在组织培养试验中仍具有传染性,并且在3 h的观察期内感染性仅略有降低。因此,在封闭空间或通风不良的情况下,即使与感染者保持相当远的距离,感染者所产生的气溶胶也可能构成吸入威胁。提示当有感染者可能在附近时,应做好防护,并将感染者曾停留的封闭空间进行足够的通风和消毒工作。另外,在粪便及尿中可分离到SARS-CoV-2,应注意粪便及尿对环境污染造成气溶胶或接触传播[19]。SARS-CoV-2病毒人群普遍易感,老年人和患有基础疾病者感染后病情较重,儿童及婴幼儿也有发病,但病情多较轻。如若确诊为COVID-19患者,应立即隔离治疗,并隔离观察其近期密切接触者。
有学者[20]分析181例确诊COVID-19患者的临床资料,以评估SARS-CoV-2的潜伏期,结果表明中位潜伏期估计为5.1 d(95%CI,4.5~5.8 d),占97.5%症状将在感染后的11.5 d内(CI为8.2~15.6 d)出现,这些估计值提示,在保守的假设下,每10 000例病例中有101例(第99个百分位数,482)在经过14 d的主动监测或隔离监测后会出现症状,与美国疾病控制与预防中心[21]建议的当前主动监测期(14 d)一致。但作者选取的病例可能代表住院患者和其他严重症状的患者,其潜伏期可能与轻度或亚临床感染者的潜伏期不同,对于无症状感染者的潜伏期可能不适用。
3 临床特征
3.1 临床表现
COVID-19的临床症状以发热、乏力、干咳等下呼吸道症状为主,其中,多数发热患者表现为高热(>38℃),少数患者为低热(>37.3℃)。有少数患者出现鼻塞、流涕、咽痛、头晕、头痛、腹泻等症状,另有少数患者无任何明显症状。重症患者发病1周后出现呼吸困难和低氧血症,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的酸中毒和凝血功能障碍等。重症及危重症患者在病程中可表现为中低热甚至无热,轻型患者仅表现为乏力、低热,无肺炎表现[22]。
3.2 受累器官
3.2.1 肺
当感染者排出带有SARS-CoV-2的飞沫而未感染者将其吸入时,SARS-CoV-2进入未感染者的鼻腔和咽喉,SARS-CoV-2通过ACE2受体进入细胞,开始大量自我复制继而入侵新的细胞。如机体的免疫系统在初始阶段无法消除SARS-CoV-2,则SARS-CoV-2会沿着气管行进,到达肺部,由于肺泡细胞表面同样富含ACE2受体,SARS-CoV-2能够借此侵入肺泡细胞并大量繁殖。肺泡作为血氧交换的重要场所,通常情况下氧气穿过肺泡进入毛细血管,然后被运输到身体的其他部位。当肺部被感染SARS-CoV-2时,免疫系统在与SARS-CoV-2交战时会破坏正常血氧交换,免疫系统的白细胞释放出趋化因子,并召唤出更多的免疫细胞来靶向杀死被病毒感染的细胞,从而在肺泡部位产生大量的脓液和死亡细胞,因此机体出现相应的症状:咳嗽、发热、快而浅呼吸[19]。
3.2.2 胃肠道
由于胃、十二指肠以及直肠中腺上皮细胞表面富集ACE2受体,SARS-CoV-2得以入侵胃肠道腺上皮细胞并大量复制,使患者出现腹泻等胃肠道症状。且有研究已从SARS-CoV-2患者的粪便分离出SARS-CoV-2,证实SARS-CoV-2不仅能够侵袭胃肠道细胞引发相关症状,且存在粪口传播途径[19]。
3.2.3 肝胆
有研究[19]认为,由于发生细胞因子风暴免疫过度反应,重症COVID-19患者多并发肝脏损害,但轻症患者合并肝脏损害的原因和机制尚不清楚。虽然胆管细胞表面有大量ACE2受体,但未见大量SARS-CoV-2侵袭和增殖,原因尚不清楚。
3.2.4 脑
ACE2作为SARS-CoV-2的功能受体,存在于神经系统和骨骼肌。在严重感染者中,神经系统受累较严重,包括急性脑血管疾病,意识障碍和骨骼肌损伤,导致临床状况恶化,加速患者死亡。COVID-19患者的尸检结果表明,患者有脑组织充血、水肿以及部分神经元变性,并且发现这些患者的脑脊液和脑组织中有SARS-CoV核酸[23]。因此,中枢神经系统症状是COVID-19患者神经系统损伤的主要形式。
3.2.5 心脏以及血管
临床上观察到COVID-19患者有心脏以及血管损伤的并发症状。有研究[19]推测,心脏与血管富含有ACE2受体,从而造成SASR-CoV-2对心脏和血管内壁的直接攻击。此外,肺部病因所导致的缺氧和细胞因子风暴免疫过度反应是否能导致心血管损伤尚待考究。
3.2.6 肾脏
肾脏富含ACE2受体而被作为SARS-CoV-2侵袭的直接靶点,进而造成肾脏功能受损,除此之外,治疗过程中呼吸机的应用、抗病毒药物的使用以及细胞因子风暴所造成的肾脏血流量减少都有可能成为肾脏受损的原因,此类因素仍有待进一步的研究[19]。
3.3 临床检测
COVID-19患者临床检测常表现为白细胞正常或减少、淋巴细胞计数下降、C反应蛋白及血沉升高,肝酶、肌红蛋白、乳酸脱氢酶和肌酶升高。特异性表现为SARS-CoV-2核酸检测阳性,肺部CT显示散在、多发或广泛磨玻璃样间质改变。然而,病毒核酸检测的准确性尚存疑问,有病例核酸检测阴性而肺部CT显示磨玻璃样间质改变,或连续2次核酸检测阴性但第3次为阳性的病例。目前,疑似病例筛查采用实时荧光RT-PCR检测病毒核酸、血清特异性抗体IgM和IgG测定和病毒基因测序并联实验,只要其中有一项符合即确诊为COVID-19患者[24]。若出现疑似症状,应立即戴口罩到附近社区卫生机构进行筛查,若有1项流行病史和2项及以上临床表现,即可诊断为疑似病例[25]。疑似病例者需尽快进行核酸检测、血清抗体测定和肺部CT进行确诊。
COVID-19患者依据症状不同分为轻型、普通型、重型和危重型。轻型患者临床症状轻微,CT未见肺炎表现。普通型患者具有发热、呼吸道等症状,影像学可见肺炎表现。若患者出现以下五项中任意一项,则被认定为重型患者:气促,RR≥30 次·min-1;静息状态下,指血氧饱和度≤93%;动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg(1 mmHg=0.133 kPa);肺部影像学显示24~48 h内明显进展。若患者出现呼吸衰竭,且需要机械通气或休克或合并其他器官功能衰竭,则被诊断为危重型患者[15]。
3.4 临床治疗
治疗方案应遵循“四抗二平衡”的原则,即抗病毒、抗休克、抗低氧血症、抗继发感染、维持水电解质平衡、维持微生态平衡[26]。目前,临床治疗尚无特效药物及疫苗,现多运用广谱抗病毒药物辅以传统的中药等进行治疗[27],但最新研究[26]表明,将康复者恢复期血浆运用于危重症患者有一定的临床效果,同时针对SARS-CoV-2的特效药物和疫苗的研发工作仍在快速有序的进行中。总体来说,除老年人以及有慢性基础病患的患者预后较差以外,多数患者的预后较好[11]。目前,SARS-CoV-2尚无特效治疗药物,临床主要用于治疗的药物如下。
3.4.1 广谱抗病毒药物
干扰素α由白细胞产生,在病毒复制的不同阶段均能产生抗病毒作用。干扰素α对SRAS-CoV、MERS-CoV感染具有抗病毒作用[28],因SARS-CoV-2的基因序列与SRAS-CoV相似度达75%~80%[23],因此SARS-CoV-2的治疗中也应用了干扰素α雾化吸入,推荐指数为低级别。阿比多尔是一种非核苷类广谱抗病毒药物,用于治疗甲型、乙型流感病毒引起的呼吸道感染,阿比多尔可促进干扰素α 合成,进而预防病毒侵袭。经过体外实验[29]证明,阿比多尔在较低浓度时,可有效抑制SARS-CoV-2。
3.4.2 潜在抗SARS-CoV-2的药物
目前,临床用于治疗COVID-19的抗病毒药物主要有洛匹那韦/利托那韦合剂、氯喹以及瑞德西韦。洛匹那韦/利托那韦合剂是治疗艾滋病病毒感染的药物。洛匹那韦/利托那韦合剂能降低急性呼吸窘迫综合征的发生率和病死率,而且能够抑制SRAS-CoV的增殖[12]。氯喹主要用于治疗疟疾,同时也有抗阿米巴原虫的作用,近期武汉病毒研究所进行体外试验,证明氯喹有潜在的广谱抗病毒作用[30]。利巴韦林是一种广谱抗病毒药物,主要用于治疗呼吸道合胞病毒(RSV)感染以及和干扰素α联用治疗丙肝,有研究[31]证明,利巴韦林可以抑制人体细胞株感染SARS-CoV-2。瑞德西韦对广谱冠状病毒具有抗病毒作用,HOLSHUE等[32]在2020年3月5日报道,对1例有高胆固醇血症病史的COVID-19患者(男性,32岁)予瑞德西韦治疗,其临床症状得到明显改善,但该药对埃博拉病毒只进行了Ⅱ期试验,因此对SARS-CoV-2疗效有待进一步观察。美国最新COVID-19指南[33]指出,应用羟氯喹、瑞德西韦、洛匹那韦/利托那韦合剂等抗病毒药物,有潜在毒性,没有足够的临床数据推荐使用。
3.4.3 抗生素治疗
COVID-19患者体内并未出现特定菌群失衡或改变,因此慎用抗菌药物,避免盲目或不恰当使用抗菌药物,尤其是广谱抗菌药物的联合使用。
3.4.4 传统中药治疗
中医认为COVID-19属于疫病,病位在肺,主张以表里双解、汗和清下四法联用为主[18]。目前应用的抗病毒中药多清热解毒类,性味多苦寒,归肝肺经。当疑似患者处于医学观察期内,如有乏力伴胃肠不适,可服用藿香正气胶囊(丸、水、口服液);如有乏力伴发热症状,可服用金花清感颗粒、连花清瘟胶囊(颗粒)、疏风解毒胶囊(颗粒)进行治疗。
3.4.5 恢复期血浆治疗
由于康复者恢复期血浆内含有SARS-CoV-2的特异性抗体,可中和患者体内的病毒,主要适用于病情进展较快的重型危重型患者的治疗。SHEN等[34]对5例合并急性呼吸窘迫综合征的危重型患者在入院后10~22 d予400 mL恢复期血浆治疗,同时接受抗病毒和类固醇治疗,患者症状均有改善,未见不良反应。另,DUAN等[35]对10例重症患者在症状出现后10~20 d注射200 mL恢复期血浆,同时接受抗病毒治疗,其中6例患者还接受类固醇治疗,结果显示患者症状均得到改善,未见严重不良反应;然而,目前尚无有效标准评定恢复期血浆中的有效抗体含量,因此采集血浆的合格率值得注意。美国最新COVID-19指南[33]提出,目前尚无足够的数据推荐使用康复者血浆治疗,且理论上而言,恢复期血浆治疗存在抗体依赖性感染增强和输血相关性肺损伤的风险,因此不推荐使用血浆治疗。
3.4.6 激素治疗
虽然糖皮质激素能够抑制肺部炎症,但其能够通过多种方式影响病毒感染机制,在SARS和MERS治疗中,糖皮质激素可导致病毒延迟清除[36-37];在流感肺炎治疗中,糖皮质激素可能导致预后不良,包括继发性细菌感染和死亡[38]。ZHOU等[39]报道,15例确诊COVID-19的危重症患者接受每日400 mg氢化可的松,平均9.5 d的糖皮质激素治疗,其中7例死亡,病死率为46.7%,与未接受糖皮质激素治疗的危重型MERS患者校正后显示病死率相近,提示糖皮质激素有可能不会增加危重症患者病死率。但由于样本量太少以及相关数据的缺乏,尚无法判定糖皮质激素对危重型COVID-19的疗效。美国最新COVID-19指南[33]提出,对于轻症及无急性呼吸窘迫综合征的重症患者,不推荐使用糖皮质激素;而对于合并难治性休克的危重症患者,可酌情使用低剂量皮质类固醇疗法以逆转休克。总的来说,除了已经气管插管、机械通气的COVID-19重症及危重症患者,其他患者不推荐使用糖皮质激素治疗。
褪黑素由于其抗炎、抗氧化和免疫增强的作用,被认为有间接抗病毒的效果。在呼吸道合胞体病毒模型中,褪黑素可抑制急性肺氧化损伤,促炎性细胞因子释放以及炎性细胞的聚集,提示褪黑素对COVID-19的治疗可能具有一定的潜力[40]。
4 SARS-CoV-2与MERS-CoV、SARS-CoV的比较
SARS-CoV-2与SARS-CoV的基因组相似性为75%~80%,与MERS-CoV的相似性为50%,与蝙蝠冠状病毒的相似性是96%[27]。对SARS-CoV-2与MERS-CoV、SARS-CoV进行多角度的比较发现,同MERS和SARS一样,SARS-CoV-2没有特异性的临床特征,其症状与其他严重的急性呼吸道感染有很大的重叠[30,41-47],见表1。目前正在收集世界各地的临床病例,以更好地定义该疾病自然史、预后以及特定的风险因素。
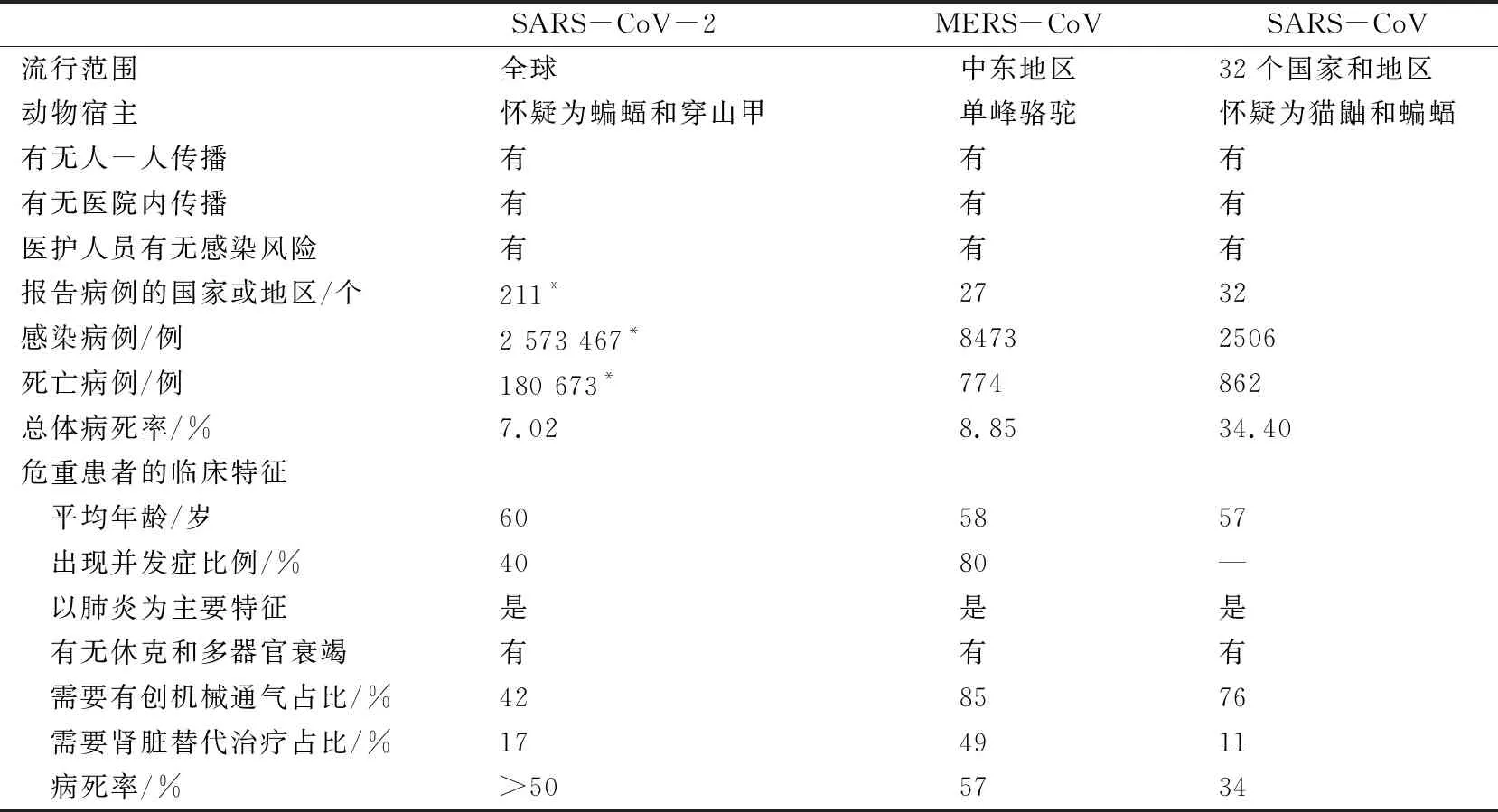
表1 SARS-CoV-2与MERS-CoV、SARS-CoV的比较
*数据来源截止至2020年4月23日。-:空缺。
5 结语与展望
目前,SARS-CoV-2已经成为亟待解决的最强烈和致命的病毒感染。各国政府通过关闭公共场所、中断传输链等方法,减少人员聚集,最大程度地减少人与人之间的接触,以控制该病毒的传播和扩散。由于SARS-CoV-2的基因重组、突变,阻断宿主细胞的免疫系统并且感染多种物种,分析和了解SARS-CoV-2中的非结构蛋白和辅助蛋白的作用将有助于了解其作用机制,明确SARS-CoV-2独特的RNA复制过程的框架将能够找到其宿主的免疫反应的突破点。故识别和消除人畜共患病源仍然是阻止新的病毒动物宿主传染人类的重要任务。
根据SARS和MERS的治疗经验,从已有抗病毒药物中筛选潜力药物用以治疗SARS-CoV-2是现阶段主要的治疗策略。目前,全球多个国家已经分离出SARS-CoV-2毒株,并用于SARS-CoV-2的特效药物及疫苗的研发。其中,美国Moderna公司研发的核酸疫苗(mRNA-1273)、中国军事科学院陈薇院士团队研发的重组蛋白疫苗以及美国GeoVax Labs公司研发的重组病毒载体疫苗已经开展了多项临床实验[48]。然而疫苗和特效治疗药物的研发之路依旧障碍重重,比如缺乏有参考价值的药效评价灵长类动物模型以及SARS-CoV-2的多样性和高突变性。由于缺乏特效治疗药物和针对SARS-CoV-2的特异性疫苗,预防和控制SARS-CoV-2感染的最有效措施仍然是早发现、早隔离新的感染源、疑似感染者及无症状感染者,并对其进行早期诊断和支持治疗。针对全球日益严峻的疫情发展,现阶段最重要的措施是在中国乃至国际范围内形成健康保护体系,做好应对人口跨国流动的防控计划,以便合理统筹安排各种防疫资源,包括确保药品、个人防护设备、医院的供应链安全、物资储备充足和必要的人力资源等,来应对疫情带来的严峻挑战。
