消瘀泄浊饮对慢性环孢素肾病大鼠ACE2-Ang(1-7)-MAS轴相关组分表达的影响
2020-06-10鲁科达张冰冰石承乾张培培叶黎青
鲁科达 张冰冰 石承乾 张培培 叶黎青
1.浙江中医药大学附属第一医院 杭州 310006 2.浙江中医药大学
环孢素A现已被广泛应用于肾、肝、心脏、骨髓等实体器官移植后免疫排斥反应及自身免疫性疾病的治疗,但其肾毒性成为限制其运用的重要原因[1-3]。环孢素A具有慢性肾小管间质毒性,长期应用可引起慢性环孢素肾病(chronic cyclosporine nephropathy,CCN)。研究发现,CCN的病理特点是肾小动脉玻璃样变性、间质纤维化及肾小球硬化,诱导氧化应激并破坏抗氧化系统、激活肾素-血管紧张素系统 (reninangiotensin systems,RAS)等是CCN进展的重要机制[4-5]。RAS作为人体的重要体液调节系统,在CCN发生发展中起到关键作用。研究报道,针对RAS的主要活性成分血管紧张素Ⅱ(angiotensionⅡ,AngⅡ)进行干预可有效保护肾脏[5-6]。近年来逐渐发现了RAS的新成员,包括血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)、血管紧张素(1-7)[angiotension(1-7),Ang(1-7)]及Ang(1-7)受体MAS等,ACE2主要作用是将AngⅡ转化为活性物质Ang(1-7),与MAS结合后发挥拮抗AngⅡ的效应,从而延缓肾间质纤维化进展[7-8]。消瘀泄浊饮是全国名老中医李学铭教授的经验方,临床上广泛用于慢性肾衰竭的治疗。既往研究证实,消瘀泄浊饮对单侧输尿管梗阻(unilateral ureteral obstruction,UUO)、5/6肾切除等多种肾间质纤维化模型具有良好的抗纤维化效果[9-10]。本研究通过建立CCN大鼠模型,观察消瘀泄浊饮对CCN大鼠ACE2-Ang(1-7)-MAS轴的影响以及相关的作用机制。
1 材料和方法
1.1 实验动物 SPF级雄性SD大鼠40只,体质量(200±20)g,购于中科院上海实验动物中心[实验动物生产许可证号码:SCXK(沪)2017-0005],饲养于浙江中医药大学动物实验中心 [实验动物使用许可证号码:SYXK(浙)2018-0012]。所有大鼠均在全封闭SPF状态下隔离饲养。
1.2 主要试剂和药品 消瘀泄浊饮由生黄芪30g、制大黄10g、川牛膝12g、桃仁12g、地龙12g、车前草20g组成,以上中药均由浙江中医药大学附属第一医院中药房提供,浓缩成浓度为0.96g·mL-1的药液,4℃保存备用;盐酸贝那普利片(商品名:洛汀新)由北京诺华制药有限公司生产(规格:10mg/片,批号:国药准字H20030514),按照60kg体质量计算,成人用量10mg·d-1,大鼠的用药量根据人与大鼠体表面积的转换系数6.25计算得出,即大鼠每kg体质量的用药量为成人的6.25倍,得出大鼠用药量为1mg/(kg·d);环孢素A溶液由杭州中美华东制药有限公司生产 (规格:5g/50mL,批号:国药准字H10930130),以橄榄油配置成浓度为3mg·mL-1的溶液,棕瓶密封后4℃避光保存,大鼠用药量为25mg/(kg·d);低盐饲料购于开源动物饲料(常州)有限公司(批号:16091902);ACE2、Ang(1-7)、肾素酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自美国R&D公司 (批号:F3490-B、F9188-A、F2344-B);ACE2、Ang(1-7)及Ⅳ型胶原(collagenⅣ,ColⅣ)免疫组化检测试剂盒购自TaKaRa公司(批号:G0815、E2912、13707B03)。
1.3 主要仪器 AU640全自动生化分析仪购于日本Olympus公司;显微镜为日本Nikon公司产品;Leica彩色病理图像分析系统购于德国Leica公司;STP12脱水机、HM335E切片机及AP280-2包埋机均为德国Microm公司产品。
1.4 方法
1.4.1 动物分组与模型制备 大鼠适应性饲养1周后,以随机数字表法分为空白对照组、模型组、消瘀泄浊饮组和贝那普利组,每组10只。空白对照组大鼠上午予橄榄油10mL/(kg·d)灌胃,下午予0.9%氯化钠溶液10mL/(kg·d)灌胃;其他各组上午均予环孢素A 30mg/(kg·d)灌胃,模型组下午予0.9%氯化钠溶液10mL/(kg·d)灌胃,贝那普利组下午予贝那普利溶液10mL/(kg·d)灌胃,消瘀泄浊饮组下午予消瘀泄浊饮10mL/(kg·d)灌胃。 各组灌胃时间均为4周。
1.4.2 检测指标
1.4.2.1 各组大鼠一般情况 观察各组大鼠精神状态、进食、大小便及体质量的变化,同时观察记录死亡情况。
1.4.2.2 肾功能指标检测 灌胃完成后,各组大鼠麻醉后腹主动脉取血,3 000r/min离心15min后-20℃保存,采用全自动生化分析仪检测血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)水平。大鼠处死前1d转移至代谢笼,禁食不禁水,至次日8时收集尿液,记录24h尿量,并测定24h尿肌酐水平,计算肌酐清除率(creatinine clearance rate,Ccr)。
1.4.2.3 肾组织病理形态学观察 取血后处死大鼠,分离左侧肾脏,取部分肾组织以10%甲醛溶液固定,脱水、石蜡包埋后行2μm切片,苏木精-伊红(hematoxylin-eosin,HE)染色,400倍光镜下观察肾组织病理形态学改变;Masson染色后200倍光镜下观察肾间质纤维化情况。
1.4.2.4 免疫组化检测肾组织ACE2、Ang(1-7)及ColⅣ表达 采用ABC染色法,棕黄色为阳性染色区,每张切片400倍光镜下随机采集5个不重叠视野,测量阳性染色面积;以德国Leica彩色病理图像分析系统对阳性反应产物进行半定量分析,计算出总光密度=∑阳性染色面积(Area)×该部位的平均光密度(Density),以阳性染色面积和总光密度为参数进行分析。
1.4.2.5 ELISA法检测血清及肾组织ACE2、Ang(1-7)和肾素含量 酶标仪于450nm波长下测定吸光度(optical density,OD)值,计算样品浓度。所有操作依据ELISA试剂盒说明书进行。
1.5 统计学分析 采用SPSS 17.0统计软件进行统计学分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较,满足方差齐性则采用LSD-t法;方差不齐则采用Dunnett's T3检验。计数资料组间比较采用χ2检验,样本数不足时采用Fisher精确检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况和死亡情况观察 空白对照组大鼠一般状况良好,活动、精神状况及饮食无明显异常。模型组大鼠饮食减少,大便稀溏,毛发枯黄,精神萎靡,一般情况较差。消瘀泄浊饮组和贝那普利组大鼠毛发光泽度、精神、饮食情况较模型组有改善。模型组和贝那普利组各死亡4只,消瘀泄浊饮组和对照组各死亡1只,造模动物总死亡率25%。
2.2 各组大鼠肾功能指标比较 与空白对照组比较,模型组大鼠BUN、Scr水平明显升高(P<0.01),Ccr水平显著降低(P<0.01);与模型组比较,消瘀泄浊饮组和贝那普利组BUN、Scr水平明显降低(P<0.01,P<0.05),Ccr水平显著升高(P<0.05);消瘀泄浊饮组和贝那普利组肾功能指标差异无统计学意义(P>0.05)。 见表1。
2.3 各组大鼠肾脏组织病理形态学观察
2.3.1 HE染色 空白对照组肾小球结构基本正常,肾小管排列无紊乱,偶有空泡样变性及炎性细胞浸润;模型组肾间质有大量炎性细胞浸润,小管上皮细胞变性、坏死;消瘀泄浊饮组炎性细胞浸润及肾小管上皮细胞变性程度较模型组减轻;贝那普利组可见炎性细胞浸润,肾小管细胞变性坏死,但均较模型组减轻。见图1。
2.3.2 Masson染色 空白对照组无明显胶原纤维沉积,结构清晰;模型组结构肾小管空泡样变性、坏死,胶原纤维沉积;消瘀泄浊饮组和贝那普利组病变较模型组明显减轻。见图2。
2.4 各组大鼠肾组织免疫组化检查结果
2.4.1 各组大鼠肾组织ColⅣ表达比较 与空白对照组比较,模型组肾组织ColⅣ阳性染色面积、总光密度明显升高(P<0.01);与模型组比较,消瘀泄浊饮组和贝那普利组肾组织ColⅣ阳性染色面积、总光密度明显降低(P<0.01)。消瘀泄浊饮组和贝那普利组差异无统计学意义(P>0.05)。 见表2、图3。
表1 各组大鼠肾功能指标比较(±s)Tab.1 Comparison of renal function indexes in each group(±s)

表1 各组大鼠肾功能指标比较(±s)Tab.1 Comparison of renal function indexes in each group(±s)
注:与空白对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01Note:Compared with blank control group, **P<0.01; compared with model group, △P<0.05, △△P<0.01
组别 n BUN(mmol·L-1) Scr(μmol·L-1) Ccr(mL·min-1)空白对照组 9 5.92±1.22 55.82±4.33 0.90±0.21模型组 6 62.61±11.84** 190.19±35.12** 0.18±0.04**消瘀泄浊饮组 9 38.33±8.93△△ 114.14±40.19△△ 0.33±0.05△贝那普利组 6 47.91±13.33△ 134.41±57.86△△ 0.31±0.06△
表2 各组大鼠肾组织ColⅣ表达比较(±s,×104)Tab.2 Comparison of ColⅣ expression of renal tissue in each group(±s,×104)

表2 各组大鼠肾组织ColⅣ表达比较(±s,×104)Tab.2 Comparison of ColⅣ expression of renal tissue in each group(±s,×104)
注:与空白对照组比较,**P<0.01;与模型组比较,△△P<0.01Note:Compared with blank control group,**P<0.01;compared with model group, △△P<0.01
组别 n 阳性染色面积 总光密度空白对照组 9 0.30±0.54 0.10±0.18模型组 6 5.83±5.97** 2.22±2.55**消瘀泄浊饮组 9 0.33±0.15△△ 0.13±0.08△△贝那普利组 6 0.93±1.25△△ 0.35±0.57△△
2.4.2 各组大鼠肾组织ACE2、Ang(1-7)表达比较 与空白对照组比较,模型组肾组织ACE2、Ang(1-7)阳性染色面积、总光密度均升高(P<0.01,P<0.05)。 与模型组比较,消瘀泄浊饮组和贝那普利组肾组织中ACE2、Ang(1-7)阳性染色面积、总光密度均明显升高(P<0.05)。消瘀泄浊饮组和贝那普利组间差异无统计学意义(P>0.05)。 见表3及图4、5。
2.5 各组大鼠肾组织及血清肾素、ACE2、Ang(1-7)含量比较
2.5.1 各组大鼠肾组织及血清肾素含量比较 与空白对照组比较,模型组肾组织中肾素含量明显上升(P<0.01);与模型组比较,消瘀泄浊饮组和贝那普利组肾组织中肾素含量下降,其中贝那普利组差异有统计学意义(P<0.05)。与空白对照组比较,模型组血清中肾素含量明显上升(P<0.01);与模型组比较,消瘀泄浊饮组和贝那普利组血清肾素含量均明显下降(P<0.05)。 见表 4。
2.5.2 各组大鼠肾组织及血清ACE2、Ang(1-7)含量比较 与空白对照组比较,模型组肾组织中ACE2含量显著上升(P<0.05),而Ang(1-7)含量显著下降(P<0.05);与模型组比较,消瘀泄浊饮组和贝那普利组肾组织中ACE2、Ang(1-7)含量均明显上升(P<0.05)。与空白对照组比较,模型组血清ACE2、Ang(1-7)含量明显上升(P<0.01);与模型组比较,消瘀泄浊饮组和贝那普利组血清ACE2含量下降(P<0.01),而Ang(1-7)含量上升(P<0.05)。 见表5。
表3 各组大鼠肾组织ACE2、Ang(1-7)表达比较(±s,×105)Tab.3 Comparison of ACE2,Ang(1-7)expression of renal tissues in each group(±s, ×105)
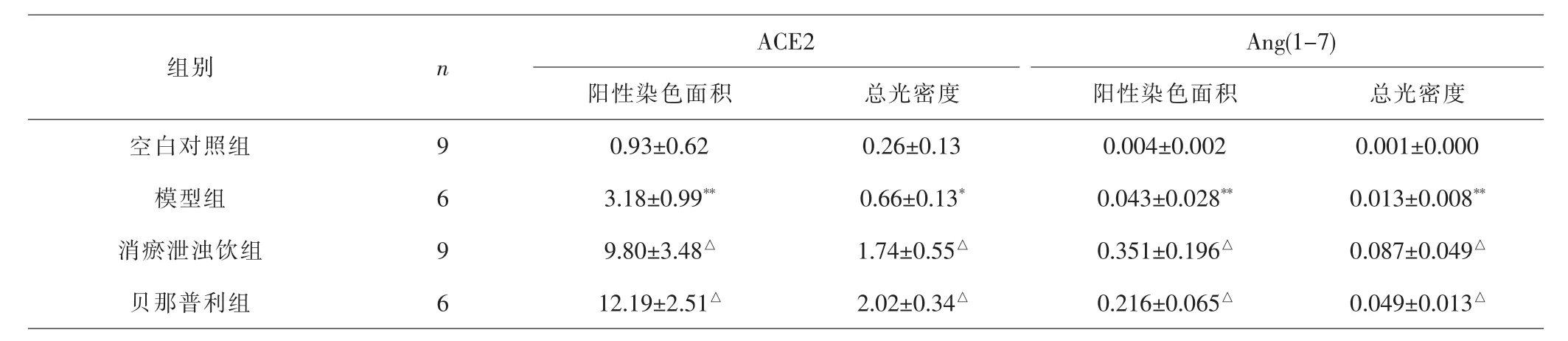
表3 各组大鼠肾组织ACE2、Ang(1-7)表达比较(±s,×105)Tab.3 Comparison of ACE2,Ang(1-7)expression of renal tissues in each group(±s, ×105)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05Note:Compared with blank control group,*P<0.05,**P<0.01;compared with model group, △P<0.05
ACE2 Ang(1-7)阳性染色面积 总光密度 阳性染色面积 总光密度空白对照组 9 0.93±0.62 0.26±0.13 0.004±0.002 0.001±0.000模型组 6 3.18±0.99** 0.66±0.13* 0.043±0.028** 0.013±0.008**消瘀泄浊饮组 9 9.80±3.48△ 1.74±0.55△ 0.351±0.196△ 0.087±0.049△贝那普利组 6 12.19±2.51△ 2.02±0.34△ 0.216±0.065△ 0.049±0.013△组别 n images/BZ_11_1558_1188_1573_1240.png
表4 各组大鼠肾组织及血清中肾素含量比较(±s,ng·L-1)Tab.4 Comparison of renin content of renal tissues and serum in each group(±s,ng·L-1)

表4 各组大鼠肾组织及血清中肾素含量比较(±s,ng·L-1)Tab.4 Comparison of renin content of renal tissues and serum in each group(±s,ng·L-1)
注:与空白对照组比较,**P<0.01;与模型组比较,△P<0.05Note:Compared with blank control group,**P<0.01;compared with model group, △P<0.05
组别 n 肾组织肾素含量 血清肾素含量空白对照组 9 66.38±4.12 420.65±74.03模型组 6 80.59±3.45** 751.56±103.67**消瘀泄浊饮组 9 76.40±3.58 516.78±106.82△贝那普利组 6 73.75±3.31△ 518.34±168.79△
表5 各组大鼠肾组织及血清中ACE2、Ang(1-7)含量比较(±s)Tab.5 Comparison of ACE2 and Ang(1-7)content of renal tissue and serum in each group(±s)

表5 各组大鼠肾组织及血清中ACE2、Ang(1-7)含量比较(±s)Tab.5 Comparison of ACE2 and Ang(1-7)content of renal tissue and serum in each group(±s)
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.05Note:Compared with blank control group,*P<0.05,**P<0.01;compared with model group, △P<0.05, △△P<0.05
组别空白对照组n 9肾组织ACE2含量(ng·g-1)7.85±0.71肾组织Ang(1-7)含量(pg·g-1)274.16±14.56血清ACE2含量(ng·mL-1)32.28±10.30血清Ang(1-7)含量(ng·L-1)934.39±188.31模型组 6 10.22±0.93* 196.40±31.53* 62.85±25.95** 1 213.71±298.71**消瘀泄浊饮组 9 13.94±1.27△ 225.85±26.68△ 40.18±13.16△△ 1 492.32±268.79△贝那普利组 6 13.01±0.70△ 235.58±22.01△ 37.71±6.68△△ 1 563.92±281.08△
3 讨论
环孢素A是临床上广泛应用的基础免疫抑制剂,但长期使用后容易发生CCN,从而严重影响肾脏功能。CCN以肾小管毒性损害、肾小动脉玻璃样变性、肾间质纤维化及肾小球硬化为主要病理表现[4-5],其相关病理机制尚不明确,但众多研究指出RAS激活在CCN发生发展中起到至关重要的作用[5,11-12]。肾素是RAS起始的特异性限速酶,通过作用于其唯一底物血管紧张素原(angiotensinogen,AGT)而激活RAS,因此可作为体内RAS激活的标记物[13]。RAS系统激活后随之产生的核心成分AngⅡ则通过一系列途径刺激成纤维细胞增生,促进细胞外基质(extracellular matrix,ECM)生成及在肾间质内的过度沉积,加速CCN的进展[14],故拮抗AngⅡ是延缓CCN进展的重要环节。近年来发现的RAS新成员ACE2能够将AngⅡ转化为ACE2-Ang(1-7)-MAS轴的主要活性物质Ang(1-7),发挥拮抗AngⅡ的效应,从而延缓肾间质纤维化进展。因此新的通路与传统的RAS通路在很多功能上相互拮抗和对立,影响着肾间质纤维化的发展和转归。
血管紧张素转化酶抑制剂 (angiotensin converting enzyme inhibitors,ACEI)和血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)是当前临床上拮抗AngⅡ的两大类主流药物,抗肾间质纤维化作用确切,因此本研究以ACEI类药物贝那普利为阳性对照。ACEI和ARB类药物很多时候无法将蛋白尿控制在理想水平,而且在严重肾功能衰竭、高钾血症、肾动脉狭窄等情况时禁用,其中ACEI类药物临床上还存在明显干咳等不良反应,这些不良反应以及禁忌证限制了ACEI和ARB的临床应用,因此挖掘疗效确切、禁忌证少、不良反应轻的新型AngⅡ拮抗剂具有十分重大的意义。中医药防治肾间质纤维化近年来取得了较好的疗效,特别是中医药专方专药的研究和应用,充分显示了中医药在抗肾间质纤维化方面的独特优势。
消瘀泄浊饮是全国名老中医李学铭教授由《医林改错》“补阳还五汤”化裁而来的经验方。全方由黄芪、川牛膝、桃仁、地龙、制大黄、车前草组成,以祛瘀泄浊为特点,具有瘀祛络通、水行浊泄之效,兼能益气扶正化瘀、协同补气,临床上广泛应用于慢性肾功能衰竭气虚夹瘀浊证的治疗[15]。本课题组通过临床观察发现,消瘀泄浊饮能够明显改善慢性肾功能衰竭患者的临床症状,降低BUN、Scr水平,提高Ccr[16]。进一步开展的一系列基础研究提示,消瘀泄浊饮可下调转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达,抑制α-平滑肌肌动蛋白 (α-smooth muscle actin,α-SMA)表达,减轻肾小管间质损害,有效延缓UUO大鼠模型肾间质纤维化进程;并可调节基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9) 和基质金属蛋白酶组织抑制因子-1(tissue inhibitor of matrix metalloproteinase-1,TIMP-1)之间的平衡,减少纤维连接蛋白(fibronectin,FN)、ColⅣ等ECM在肾组织中的沉积,从而能够保护5/6肾切除大鼠模型的残肾功能[9-10,17]。肾间质纤维化是所有慢性肾脏病包括CCN等终末期的共同表现,以大量成纤维细胞增生和ECM沉积为特征,ColⅣ高表达则说明肾间质纤维化加重。本研究构建了环孢素A所致的肾间质纤维化模型,从ACE2-Ang(1-7)-MAS轴入手,进一步研究消瘀泄浊饮对延缓CCN肾间质纤维化的作用机制。
本研究显示模型组BUN、Scr升高,Ccr下降,肾间质纤维化程度增高,证实了CCN模型成功建立。肾组织病理形态学、ColⅣ免疫组化结果显示贝那普利、消瘀泄浊饮均具有良好抗纤维化效果,而贝那普利和消瘀泄浊饮作用无明显差异。既往研究中笔者发现,在CCN模型中肾组织AngⅡ表达明显升高[18]。本研究ELISA法检测显示模型组血清和肾组织肾素含量较空白对照组明显升高,证实CCN中经典RAS被激活,而贝那普利、消瘀泄浊饮组血清和肾组织肾素含量均较模型组下降,但只有贝那普利组的肾组织和血清肾素含量以及消瘀泄浊饮组的血清肾素含量有统计学差异,表明贝那普利能抑制RAS的激活;消瘀泄浊饮组与贝那普利组之间比较无统计学差异,因此消瘀泄浊饮能否抑制RAS的激活尚有待于证实。
进一步采用免疫组化和ELISA法对ACE2-Ang(1-7)-MAS轴相关组分表达进行检测,免疫组化结果提示,与模型组比较,消瘀泄浊饮组及贝那普利组肾组织中ACE2、Ang(1-7)表达均明显升高,而消瘀泄浊饮组及贝那普利组间差异无统计学意义。ELISA检测结果显示贝那普利组和消瘀泄浊饮组肾组织ACE2、Ang(1-7)的含量较模型组明显升高;两组血清Ang(1-7)的含量较模型组明显升高,ACE2含量则较模型组明显下降,而贝那普利组和消瘀泄浊饮组以上指标的含量无统计学差异。以上研究结果表明贝那普利和消瘀泄浊饮均能够上调ACE2-Ang(1-7)-MAS轴相关组分的表达,而贝那普利组和消瘀泄浊饮组血清ACE2的含量较模型组明显下降,与两组肾组织ACE2的表达均升高的结果并不一致,有待于进一步研究。
综上所述,本研究结果提示在CCN动物模型中,经典的RAS被激活,肾组织中ACE2-Ang(1-7)-MAS轴核心活性物质Ang(1-7)表达下降,提示在CCN中该轴受到抑制,消瘀泄浊饮和贝那普利均能提高Ang(1-7)水平,从而减轻CCN肾间质纤维化进展,表明中药消瘀泄浊饮可调节ACE2-Ang(1-7)-MAS而发挥肾脏保护作用,本研究结果为中医药防治肾间质纤维化提供了新的方向和思路。
