神经内分泌标志物 ProGRP、 CGA、NSE在肺小细胞癌患者中表达的临床意义及对预后的影响
2020-06-09赵玉捧籍顺利卢亮郑爽李小亮耿玉霞
赵玉捧 籍顺利 卢亮 郑爽 李小亮 耿玉霞
肺癌是世界上最常见的恶性肿瘤之一,根据其细胞形态学、生物学和临床特征的不同,可分为小细胞肺癌((small cell lung cance, SCLC)(15%~20%)和非小细胞肺癌((non small cell lung cance, NSCLC)(80%)。
SCLC的特点是其快速倍增时间和早期的转移倾向[1-3]。最新的研究证实,SCLC的主要预后指标为患者的表现状态和疾病分期[4- 6]。SCLC的典型特征是其神经内分泌现象,可以通过对胞质内的神经内分泌颗粒及一些神经肽类、激素类的分泌物的监测,从而得到SCLC形态学和功能学上的重要信息。但这些血清神经内分泌标记在临床实践中尚未被常规用作预后指标。神经元特异性烯醇化酶 (neuron-specific enolase, NSE)也称作烯醇化酶-γ,是一种神经/神经内分泌特异性烯醇化酶的同工酶。NSE参与糖的有氧酵解,可以在神经起源或神经内分泌起源的肿瘤中检测到NSE,也可以在红细胞、血浆细胞和血小板中找到,在SCLC中水平较高[7]。嗜铬粒蛋白A(chromogranin A, CGA)是一种49 kDa的酸性可溶蛋白,普遍存在于神经内分泌组织中,并且在SCLC患者表现为升高水平。促胃泌素释放肽(pro-gastrin-releasing peptide,ProGRP)是一种胃肠激素,存在于胎儿肺中的神经纤维、脑和神经内分泌细胞,在SCLC患者中普遍升高,但是由于其在血清中非常不稳定而未被用作诊断标志物。各种研究表明,其前体蛋白ProGRP在区分SCLC和NSCLC的能力方面优于其它标记物[8- 9]。本文前瞻性分析SCLC患者的神经内分泌标记CGA,ProGRP和NSE表达水平,探讨其可能在SCLC患者中的临床意义以及对预后的影响。
资料与方法
一、研究对象
收集本医院病理科确诊的并未接受治疗的SCLC患者40例(23名男性/17名女性),中位年龄为62岁(37~78岁),22例患者疾病分期为局限期,18例患者为广泛期。25例患者的一般健康状态评分(PS)为0~1分,15例患者的一般健康状态评分(PS)为 2~4分。 中位随访时间为13个月(范围1~31个月)。采用2009年国际肺癌组织的TNM分期标准对SCLC进行分期。所有患者均签订知情同意书,本研究同时经医院伦理道德委员会审核通过。
纳入标准:(1)病理证实为小细胞肺癌SCLC;(2)年龄18~70岁;(3)PS评分≥4;(4)有可测量病灶(CT测得长径≥10 mm);(5)心电图、血常规、肝肾功能、骨髓功能基本正常;(6)未进行其他抗肿瘤治疗;(7)预计生存期大于3个月;(8)患者及家属同意接受本方案治疗,依从性好。
排除标准:(1)造血功能严重障碍者;肝肾功能严重损害患者;(2)精神病患者;(3)怀孕或哺乳期妇女;(4)疗效观测部位合并放疗;(5)复治患者。
二、 主要观察指标及其定义
所有患者在化疗开始前1 d清晨采集其静脉血清(采集量多少),并储存在- 80℃。所有患者均接受顺铂-依托泊苷化疗,顺铂30 mg/m2静脉滴注,第1~3天;依托泊苷100 mg/m2静脉滴注,第1~5天,每21~28 d重复,最多六个周期。血红蛋白(Hb)、血清肌酐、乳酸脱氢酶、碱性磷酸酶、白细胞、白蛋白等测定,均在化疗开始前进行检测。血清CGA采用“双位点夹心”免疫放射分析(CGA-RIACT)进行测量,单克隆抗体抗人CGA的氨基酸序列分别为145~197和198~245,该检测检测到完整的分子和不同的分子片段。血清NSE使用市售的固相“双位点夹心”免疫放射分析(ELSA-NSE)进行测量,拟分析探讨两种单克隆抗体,第一个是特定的NSE涂覆在埃尔莎固相上,第二个是放射性标记的碘-125,并被用作示踪剂。血清ProGRP采用ELISA试剂盒(厂家)测定。所有患者以病例跟踪、电话随访为主,短信随访为辅。临床分期以病理和病历资料对照2009年国际肺癌组织的分期标准并结合影像学或病理学、细胞学检查对SCLC进行分期,分为局限期和广泛期;从病理确诊之日开始至死亡,以月为单位计算患者总生存期。
三、统计学方法
用 SPSS20.0 软件进行数据整理、筛选与统计分析:计数资料数据以N(%)形式记录,两组间计量指标采用独立样本t检验进行组间比较;采用Kaplan-meier法绘制生存曲线,计算平均生存期并验证等比例风险假设,采用log-rank检验比较一般资料及临床资料生存率的差别,并行多因素COX回归进行单变量及多变量生存分析,并根据单变量分析中有意义的变量纳入多变量Cox回归分析,以探究患者生存预后的独立影响因素。按0.05检验水准,P<0.05则差异具有统计学意义。
结 果
一、SCLC癌患者血清中CGA,ProGRP,NSE水平
SCLC患者血清中NSE,CGA,ProGRP水平与年龄及性别无关,但随着健康状况及疾病等级的变化而显著变化。一般健康状态评分为2~4分的患者,相比于一般健康状态评分为0~1的患者,血清中CGA水平(99.26vs59.34 ng/mL;P<0.001), ProGRP水平(207.10vs112.69 pg/mL;P<0.001),NSE水平(48.43vs32.64 ng/mL;P<0.001)显著升高。同时疾病分期在广泛期的患者相比于分期为局限期的患者,血清中也具有更高的神经内分泌相关标志物,(CGA 82.34vs55.64 ng/mL,P<0.001;ProGRP 183.69vs88.91 pg/mL;P<0.001,NSE 47.19vs26.20 ng/mL;P<0.001)(见表1)。
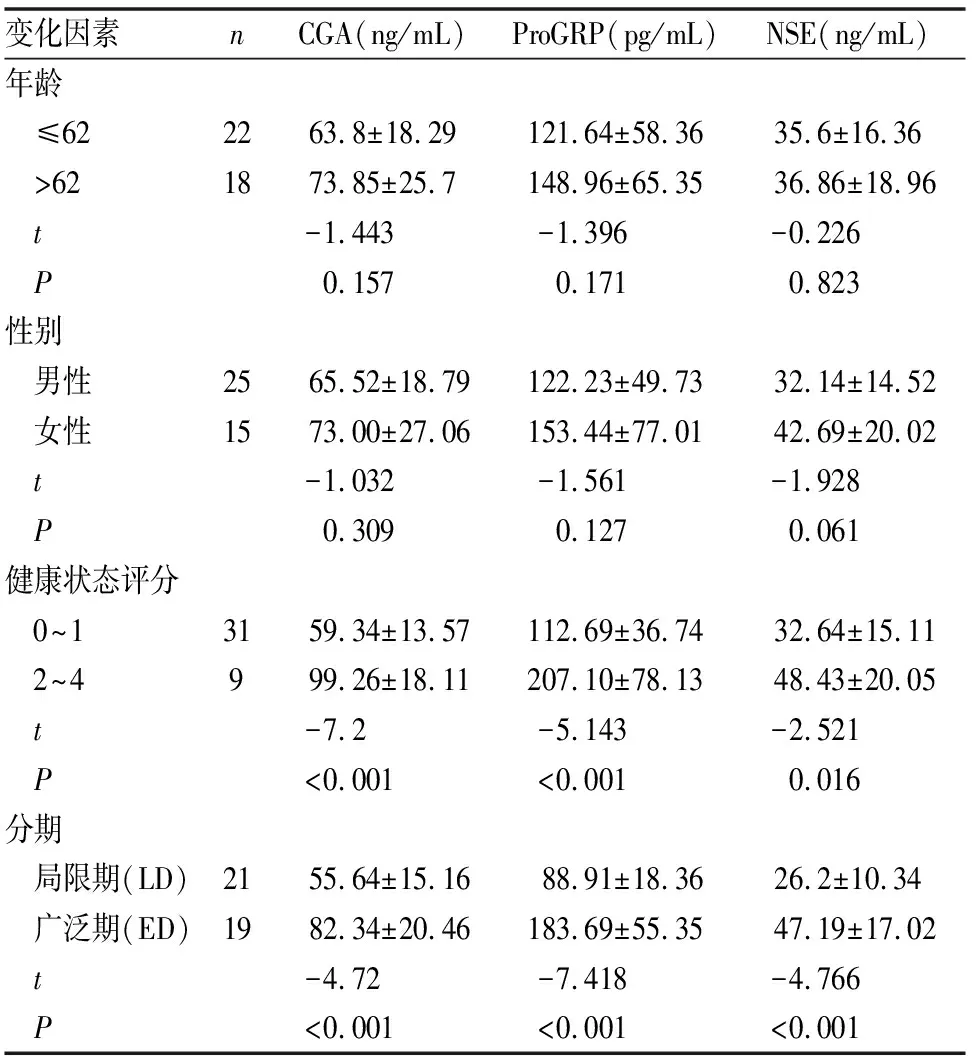
表1 SCLC癌患者血清中CGA,ProGRP,NSE水平
二、单因素和多因素生存分析
纳入研究的SCLC患者中位生存期为13个月。单因素变量分析发现存活率与一般健康状态评分(P=0.001),疾病分期(P<0.001)以及血清中CGA(P<0.001),ProGRP(P<0.001)和NSE(P<0.001)的水平状态具有显著相关性,并具有统计学意义。而与年龄及性别不具有统计学意义(见表2)。
单变量Cox回归模型发现一般健康状态评分(B=-0.774;P=0.002)、肺小细胞癌分期(B=-1.073;P<0.001)、血清中CGA(B=0.116;P=0.001)、ProGRP(B=0.037;P=0.017)、NSE(B=0.221;P=0.007)是统计学上生存率的重要预测因子(见表3)。
单变量分析发现,健康状态PS≥2的患者(中位生存期为12vs14个月,P=0.001)(图1),肺小细胞癌分期为广泛期的患者(中位生存期为10vs15个月,P<0.001)(图2),血清CGA水平 >56ng/mL(中位生存期为10vs14个月,P<0.001)(图3),血清ProGRP水平 >58 pg/mL(中位生存期为10vs15个月,P<0.001)(图4),血清NSE水平 >19 ng/mL(中位生存期为10vs15个月,P<0.001)(图5),具有更短的生存期。

表2 预后因素的Kaplan-Meier生存分析

表3 Cox 单变量回归分析
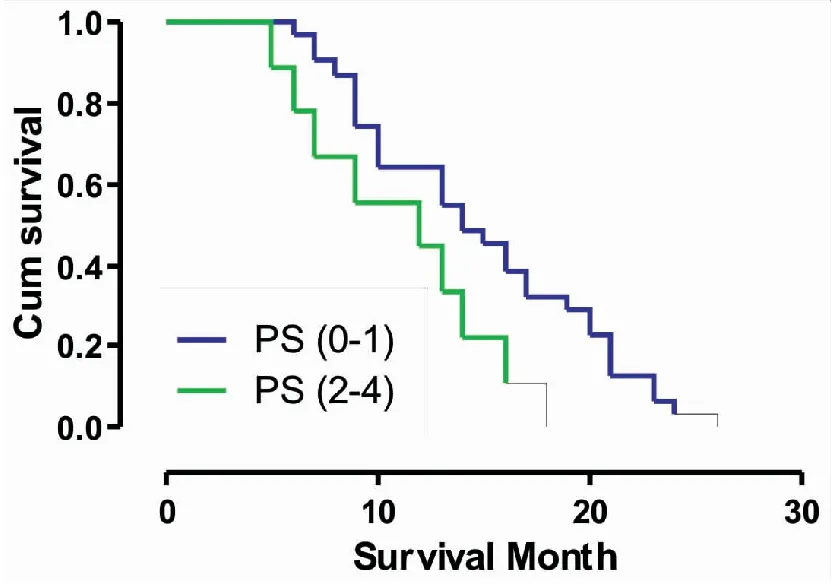
图1 SCLC患者一般健康状态评分的生存曲线
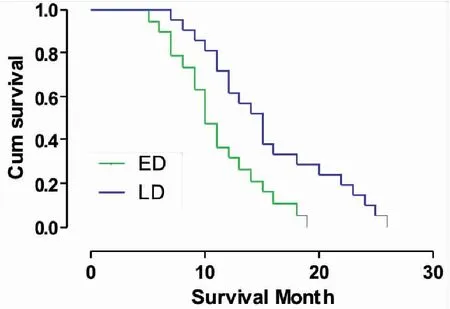
图2 SCLC患者疾病等级的生存曲线
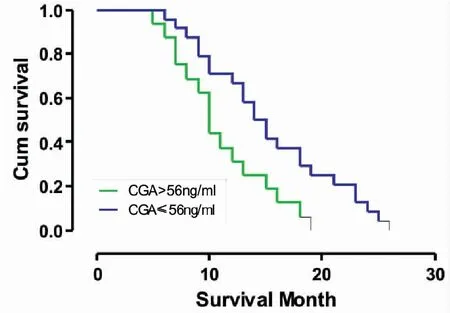
图3 SCLC患者血清中CGA水平的生存曲线
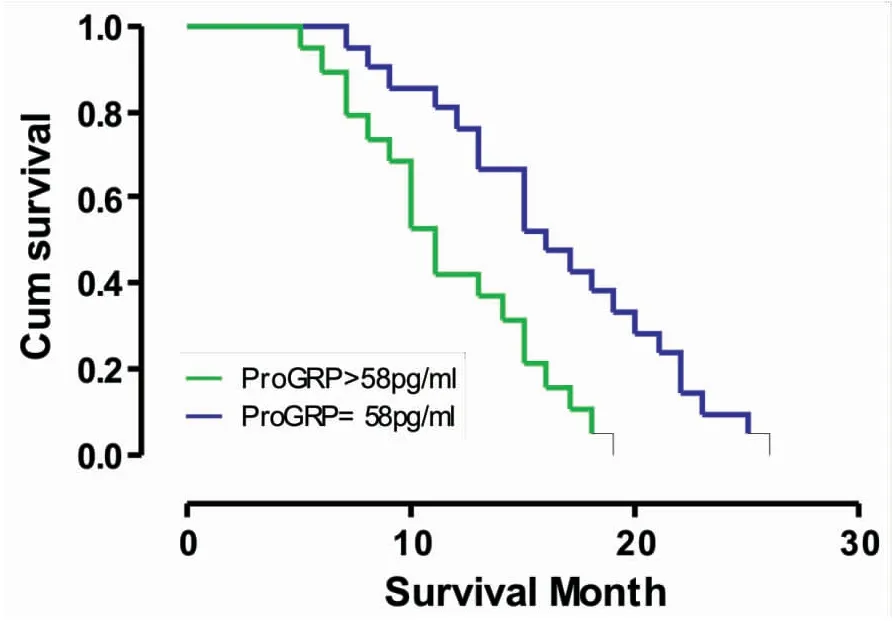
图4 SCLC患者血清中ProGRP水平的生存曲线
使用多重Cox回归模型分析所有显着变量(表4),发现健康状态PS和肺小细胞癌分期是生存率的显著预测因子(分别为B=-0.799;P=0.001和B=-1.171;P<0.001)。
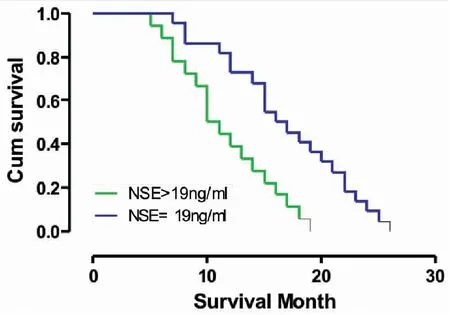
图5 SCLC患者血清中NSE水平的生存曲线
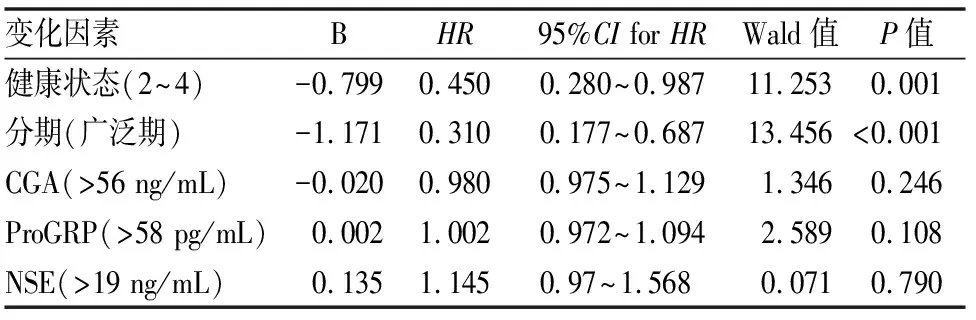
变化因素BHR95%CI for HRWald值P值健康状态(2~4)-0.7990.4500.280~0.98711.2530.001 分期(广泛期)-1.1710.3100.177~0.68713.456<0.001CGA(>56 ng/mL)-0.0200.9800.975~1.1291.3460.246 ProGRP(>58 pg/mL)0.0021.0020.972~1.0942.5890.108 NSE(>19 ng/mL)0.1351.1450.97~1.5680.0710.790
讨 论
SCLC是一种具有神经内分泌(neuro endocrine,NE)分化特征的恶性肿瘤。因此,神经内分泌标志物如神经元特异性烯醇化酶(NSE),嗜铬粒蛋白A(CGA),突触素(Synaptophysin, Syn),肌酸激酶BB(Creatine kinase BB),蛙皮素和神经细胞粘附分子(Neuronal Cell Adhesion Molecule)等,有助于利用免疫组织化学方法来表征这些恶性肺肿瘤,释放到循环中的这些神经内分泌因子可以作为肿瘤标志物[8-9]。理想的肿瘤标志物不仅可用于早期诊断及预后工具,还能可以反映疾病的进展及其对治疗的反应。但上述标志物中没有一种是肺癌特异性的,且敏感性较差,在其他恶性肿瘤中这些标志物水平也表现为异常,到目前为止,还没有发现一种理想的标志物,通常需要组合两种或三种肿瘤标志物,以获得可接受的灵敏度。目前SCLC中使用最多的肿瘤标志物是NSE,它有助于诊断(75%的患者在诊断时升高)[10],预后预测及SCLC的随访。但NSE的敏感性较低,特别是在LD患者中。在40%的SCLC患者中,CGA水平显示异常[11],并且LD患者可能具有更高的敏感性。先前实验证实ProGRP相比于NSE,对LD和ED具有更高的敏感性[12]。
本研究发现,相比于局限期的SCLC,广泛期的SCLC患者CGA,ProGRP和NSE水平均显着增高(P<0.001),与之前报道的广泛期的SCLC中ProGRP和NSE水平显着升高结果一致[13]。此研究还发现,较差的健康状况PS(2~4)也与血清中NSE,CAG,ProGRP较高的水平相关,该研究结果也与Molina 等研究结果一致。但另一项针对37名SCLC患者的研究发现,根据患者年龄,性别或健康状况,ProGRP和NSE标记物水平没有显着差异,并且只有NSE显示与疾病等级有关联(ED患者显着增加)[14]。
单变量生存分析显示中位生存时间与以下参数之间存在显着关联:PS,疾病分期和血清中ProGRP,NSE和CGA水平。更差的健康状态,广泛期的SCLC患者,以及血清中ProPRP >58 pg/mL,CGA >56 ng/mL和NSE >19.0 ng/mL都与中位生存期时间缩短显著相关。Cox回归模型发现PS,疾病分期,NSE,CGA和ProGRP水平均为生存的独立预后指标。
但关于上述标志物的相关研究结果并不一致。ProGRP对用顺铂为基础的化疗治疗的SCLC患者没有预后价值[15-16],但也有研究发现,ProGRP水平升高导致中位生存期显著缩短[12,17]。这些差异可能与不同研究使用的不同肿瘤标志物阈值水平有关。例如,一个SCLC系列将其标志物阈值设定为其系列的中位数ProGRP水平(138 pg/mL);当使用它作为阈值设置时,两组患者之间的中位生存期没有显着差异。然而,当应用更高的阈值截止值 (>800 pg/mL)时,中位生存期差异显著[18]。因此,首先需要做更多的研究来确定这些神经内分泌标志物是否为良好的SCLC肿瘤标志物,其次是为每种标志物建立适当的阈值水平。此外,本研究为了简化分析范围,只是分析相关指标对患者临床分期以及生存期的影响分析。因生物指标物的变化与具体化疗药物以及方案有关联,而并未探讨其对患者化疗效果的影响,因此作为后续研究探究其与化疗药物药代动力学的相关性。本研究发现,ProGRP,NSE和CGA在SCLC患者的分期和预后存活中都具有潜在的作用。
