CD73与调节性T细胞在非小细胞肺癌中的表达及其临床意义
2020-06-09高锋陈丽秀朱于娟陈敏洁许梅杰张洁如钱文霞
高锋 陈丽秀 朱于娟 陈敏洁 许梅杰 张洁如 钱文霞
由于烟草、大气污染等因素的影响,近年来肺癌的发病率显著上升,GLOBOCAN2018报告显示:2018年全球肺癌新发病例约209万,死亡约176万,占恶性肿瘤新发病例及死亡病例的11.6%及18.4%,位居恶性肿瘤之首[1]。深入了解肺癌的发生、发展机制,对指导临床治疗、改善肺癌患者生存率具有重要价值。CD73,即5′胞外核苷酸酶,是参与胞外腺苷酸转化为腺苷的生物学过程的关键酶,是肿瘤微环境中的免疫抑制因子,在肿瘤的免疫逃逸、侵袭转移有重要意义[2]。调节性T细胞(regulatory T cells,Treg)是具有独特免疫调节功能的T细胞亚群,参与肿瘤的免疫逃逸、促进肿瘤的发展,发现其与多种恶性肿瘤相关,如胃癌、胰腺癌等[3],叉头状核转录因子(Foxp3)在Treg细胞呈特异性表达,通过检测Foxp3表达可以有效提示Treg细胞数量。本研究旨在通过采用免疫组化SP法分析CD73与Foxp3+Treg细胞在非小细胞肺癌中的表达,了解非小细胞肺癌浸润与转移过程中的可能机制,以期能形成新的肿瘤标志物,更好的监测非小细胞肺癌进展与判断预后。
资料与方法
一、临床资料
本研究选取2012年01月至2013年12月术后经病理证实为非小细胞肺癌组织标本70例,10例癌旁正常肺组织设为对照组,入组患者无其他恶性肿瘤及术后化疗病史。其中女性32例,男性38例,平均年龄 63.18±7.59岁,鳞癌33例,腺癌37例,低分化27例,中高分化43例,有淋巴结转移31例,参考第8版UICC TNM分期标准:Ⅰ期21例,Ⅱ期35例,Ⅲ期14例。该研究经由苏州大学附属张家港医院伦理委员会同意。
二、主要实验试剂
SP检测试剂盒购自福州迈新公司,CD73、Foxp3兔抗人多克隆抗体购自武汉三鹰公司。
三、实验方法
采用免疫组织化学SP法进行实验检测,实验设置阴性对照(以PBS代替一抗)。所有标本均适当取材、及时固定、石蜡包埋,3um层厚完整切片,常规脱蜡及水化,EDTA抗原修复,过氧化酶溶液阻断内源性过氧化酶活性,采用山羊血清封闭,加用一抗在4℃冰箱内孵育过夜,顺序滴加生物素标记的二抗及链霉素抗生物素——过氧化酶溶液,DAB显色,苏木素复染,中性树胶封闭,显微镜下观察。
四、阳性结果判定
CD73染色结果参考Al-Shibli[4]标准。以肺癌细胞细胞膜出现明显染色的棕黄色颗粒为阳性,观察五个高倍视野(×400倍),根据阳性细胞率计分:0分为阴性,1分为阳性细胞≤10%,2分为阳性细胞11%~50%,3分为阳性细胞51~75%为3分,4分为阳性细胞>75%;根据细胞染色强度评分:无色0分,浅黄色1分,棕黄色2分,棕褐色3分,阳性细胞率与染色强度乘积在3分以上为阳性。Foxp3定位于细胞核,呈棕黄色颗粒,随机观察每张切片的五个高倍镜视野,计算阳性细胞百分比及平均值,将阳性细胞百分比<5%定为表达阴性,≥5%定为表达阳性。
五、随访
70病例均有完整的随访资料,采用电话形式进行随访。随访截止日期为2018年12月。生存期的计算从手术日期至随访截止日期或死亡日期为止。
六、统计学分析
采用SPSS 20统计软件对数据进行统计学分析。计数资料采用率表示,采用卡方检验分析CD73与Treg细胞在不同肺组织的表达及其与临床病理特征的关系,相关性检验采用Spearman相关分析。采用 Kaplan-Meier分析CD73、Treg细胞与生存期的关系,Cox回归多因素生存分析。以P<0.05为差异有统计学意义。
结 果
一、CD73在不同肺组织中的表达
CD73在非小细胞肺癌中表达分布和阳性颗粒沉淀位置主要是以胞膜型为主,根据阳性染色细胞比例和染色强度将染色结果分为四个等级:强阳性、中等阳性、弱阳性、阴性,CD73在10例癌旁正常肺组织中无表达表达,阳性表达率为0%(0/10),CD73在70例腺癌及鳞癌中呈阳性表达率为73.7%(53/70),肺癌组与癌旁正常肺组织比较,CD73表达的差异具有统计学意义(P<0.01)(见表1,图1~6)。
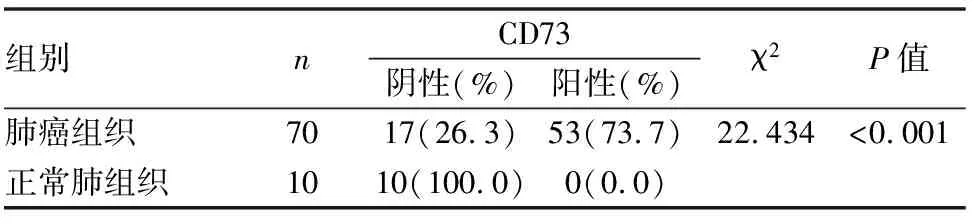
表1 CD73在不同肺组织中的表达
二、CD73的表达与临床病理特征的关系
70例肺癌组织中,TNM分期高、存在淋巴结转移者,其CD73阳性表达率明显高,与CD73阴性表达者相比差异具有统计学意义(P<0.05),而CD73的表达与年龄、性别、吸烟史、肿瘤大小、组织学类型、分化程度无关(P>0.05)(见表2)。
三、Foxp3+Treg细胞在不同肺组织中的表达
Foxp3阳性表达呈棕黄色颗粒,定位于淋巴细胞细胞核,Foxp3标记的Treg细胞在10例癌旁正常肺组织中无表达表达或仅有微弱表达,阳性表达率为0%(0/10),而在70例肺癌间质内49例可见阳性浸润表达,阳性表达率为70%(49/70),肺癌组与癌旁正常肺组织比较,Foxp3标记的Treg细胞浸润分布的差异具有统计学意义(P<0.01)(见表3、图7、8)。
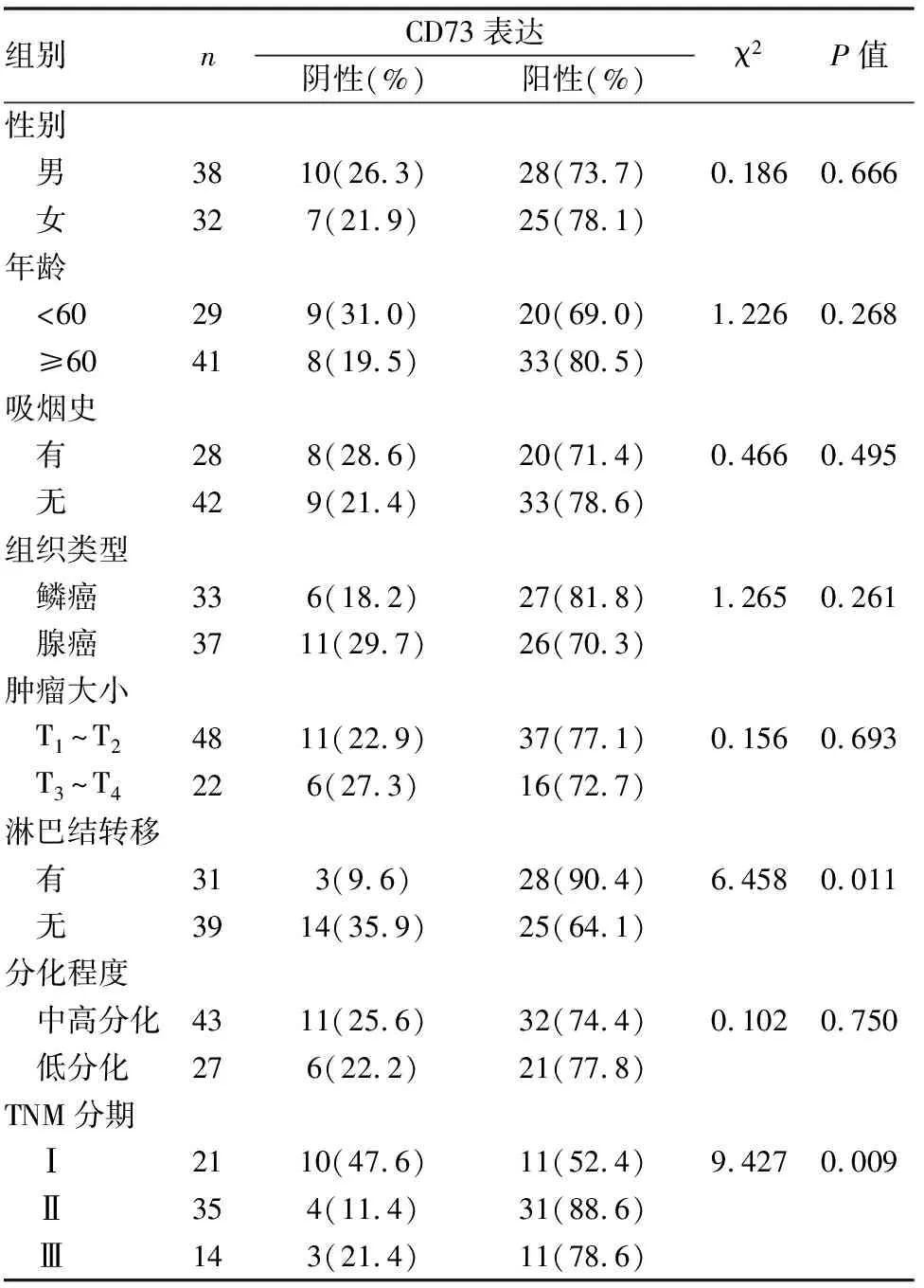
表2 CD73的表达与临床病理特征的关系
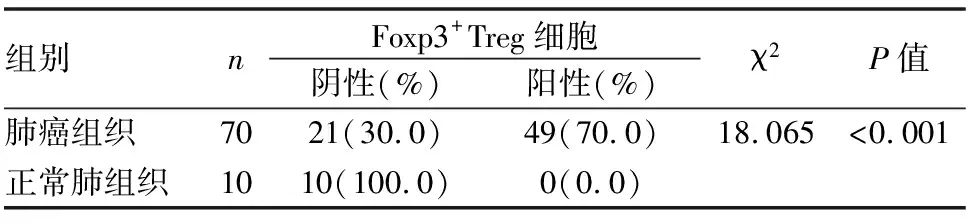
表3 Foxp3+Treg细胞在不同肺组织中的表达
四、Foxp3+Treg细胞与临床病理特征的关系
70例肺癌组织中,TNM分期高与存在淋巴结转移患者的Foxp3+Treg细胞在间质内的浸润数量明显增加,阳性表达率明显升高,与Foxp3+Treg细胞阴性表达者相比差异具有统计学意义(P<0.05),而Foxp3+Treg细胞的表达与年龄、性别、吸烟史、肿瘤大小、组织学类型、分化程度无关(P>0.05)(见表4)。
五、CD73与Foxp3+Treg细胞表达相关性分析
70例肺癌组织中,CD73的阳性表达与Foxp3+Treg细胞在肺癌间质内的阳性浸润呈正相关(r=0.284,P<0.05)(见表5)。
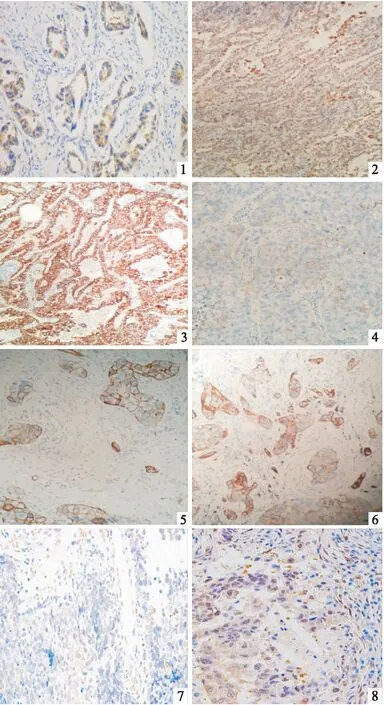
图1 C达(×400) 图2 CD73在肺腺癌中中等阳性表达(×100) 图3 CD73在肺腺癌中强阳性表达(×100) 图4 CD73在肺鳞癌中弱阳性表达(×400) 图5 CD73在肺鳞癌中中等阳性表达(×400) 图6 CD73在肺鳞癌中强阳性表达(×400) 图7 Foxp3+Treg细胞在肺鳞癌中阳性表达(×200) 图8 Foxp3+Treg细胞在肺腺癌中阳性表达(×200)
六、CD73与Foxp3+Treg细胞表达与预后的关系
Kaplan-Meier生存曲线分析提示在70例非小细胞肺癌中,CD73阴性表达组患者中位生存期(58.00±5.65月)明显优于阳性表达组患者(32.00±1.55月),两者差异具有统计学意义(P<0.01)。Foxp3+Treg细胞阴性表达组患者中位生存期(58.00±4.57月)与阳性表达组(32.00±1.16月)相比,差异亦具有统计学意义(P<0.01)。单因素分析提示患者预后与肿瘤大小、淋巴结转移、肿瘤细胞分化程度、TNM分期、CD73与Foxp3+Treg细胞的阳性表达密切相关。Cox回归多因素分析显示淋巴结转移、TNM分期、CD73与Foxp3+Treg细胞的阳性表达密切相关(P<0.05)。分析结果提示CD73与Foxp3+Treg细胞是判断患者预后的独立预测因子(见图9、10、表6、7)。
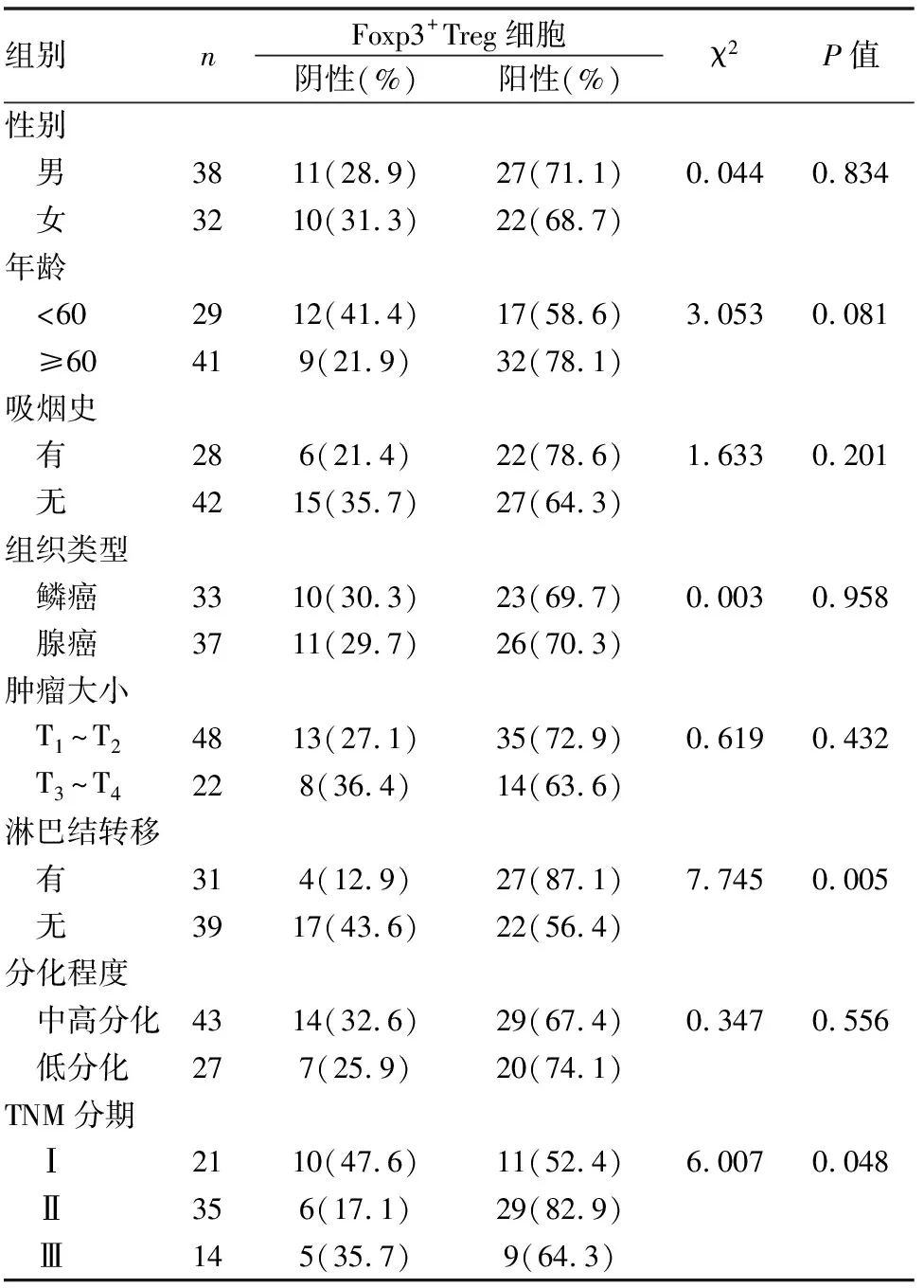
表4 Foxp3+Treg细胞的表达与临床病理特征的关系

表5 CD73与Foxp3+Treg细胞表达的相关性
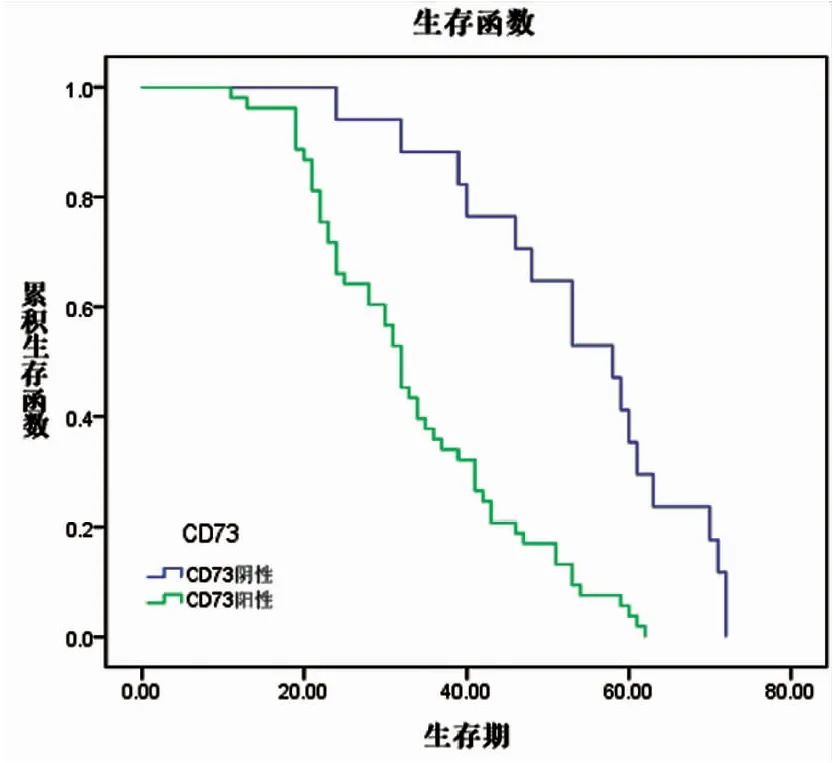
图9 CD73与生存期
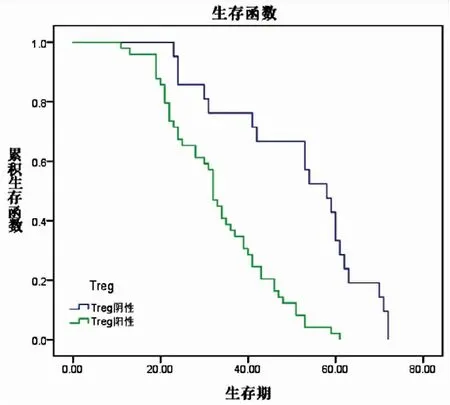
图10 Foxp3+Treg细胞与生存期
讨 论
肺癌是全球范围内最常见的恶性肿瘤之一,具有高患病率及高死亡率的特点,严重威胁人类的生命健康,其中约85%为非小细胞肺癌(NSCLC)[5]。近年来,由于烟草、大气污染等因素的影响,NSCLC的患病率和死亡率均呈上升趋势,其治疗也面临着严峻的挑战。由于NSCLC发病隐匿、早期缺乏典型症状且具有侵袭转移力强、易复发等特点,多数患者确诊时已错过最佳治疗时期,其5年的生存率仅为17%[6],因此探索NSCLC发生、发展机制对于指导患者早期诊疗、开发新的靶点治疗以及改善患者预后具有十分重要的意义。
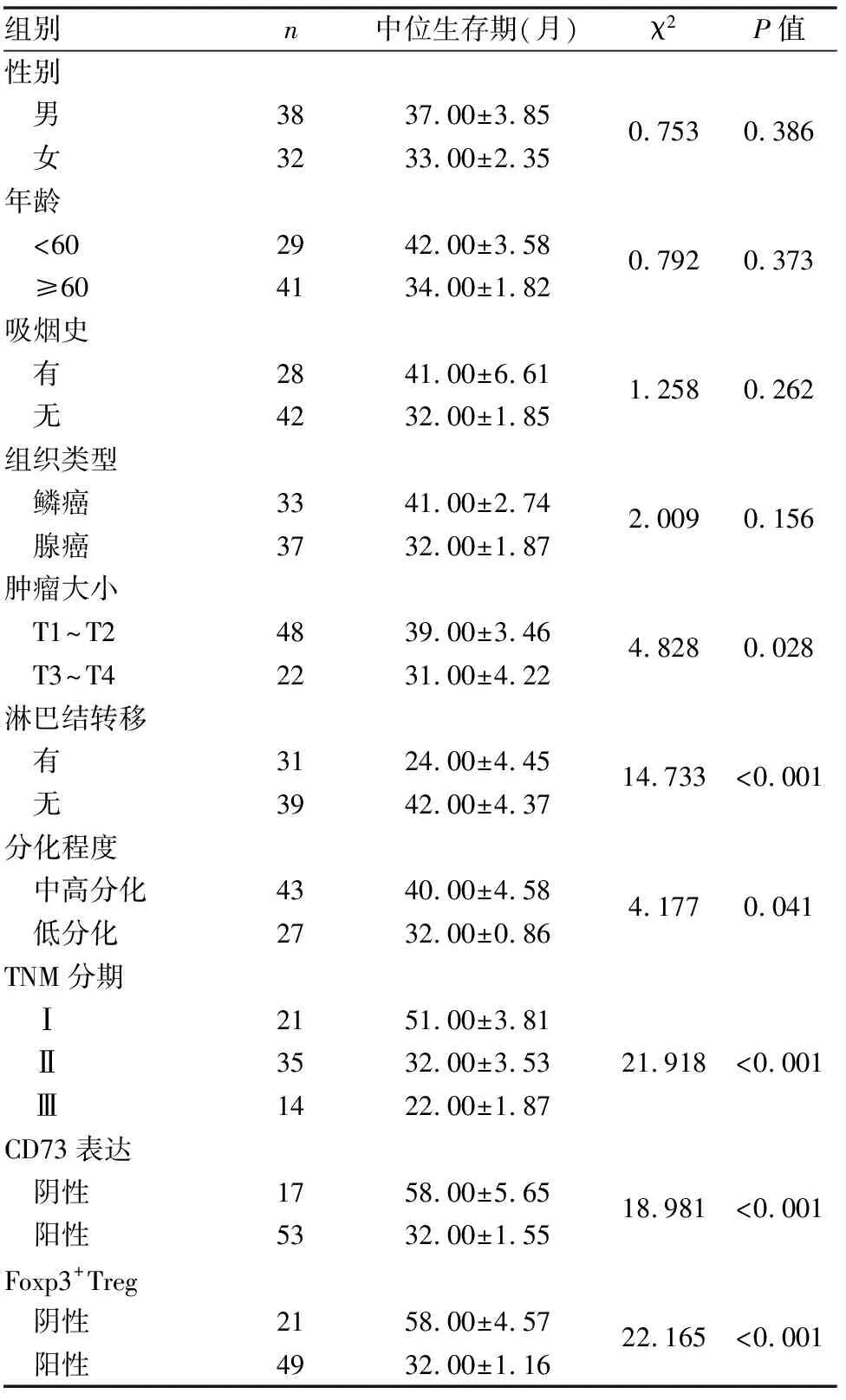
表6 非小细胞肺癌生存期相关因素单因素分析
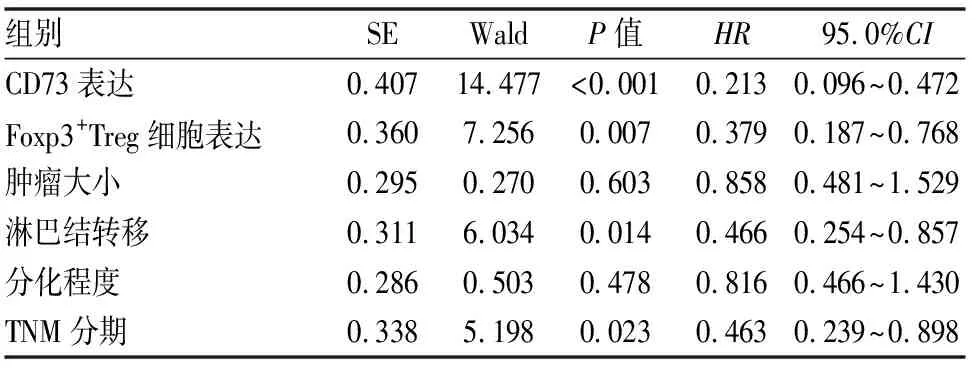
表7 非小细胞肺癌生存相关因素Cox回归多因素分析
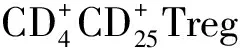
综上所述,NSCLC的发生一个多种因素影响、多种环节参与的复杂过程,早期发现与诊断肺癌是改善患者预后的重要措施,通过本研究结果提示CD73、Foxp3+Treg细胞参与了NSCLC的进展过程,CD73、Foxp3+Treg细胞可能成为监测NSCLC病情变化的新型标志物及肿瘤防治的新突破口,形成肺癌精准治疗的新途径,从而有效改善患者预后。
